Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fuerzas de Van Der Waals Puente de Hidrógeno
Cargado por
Diego Onofre0 calificaciones0% encontró este documento útil (0 votos)
15 vistas1 páginaTítulo original
1.4.5
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
15 vistas1 páginaFuerzas de Van Der Waals Puente de Hidrógeno
Cargado por
Diego OnofreCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
FUERZAS DE VAN PUENTE DE
DER WAALS HIDRÓGENO
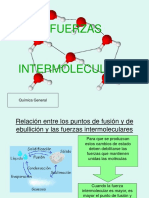
Estas son fuerzas débiles de Es una fuerza intermolecular especial que se
da en moléculas con hidrógeno unido a
atracción entre moléculas átomos altamente electronegativos, como el
oxígeno, el nitrógeno o el flúor. Implica una
que se deben a atracción fuerte entre el átomo
fluctuaciones temporales electronegativo y el hidrógeno de otra
molécula.
en la densidad electrónica. 1. Átomos Participantes: Las fuerzas de
puente de hidrógeno involucran al menos
Se componen de tres tipos tres átomos: un átomo de hidrógeno unido
principales: a un átomo electronegativo y dos átomos
FUERZAS electronegativos adicionales con pares de
electrones no compartidos.
2. Electronegatividad: Los átomos que
INTERMOLECULARES: participan en el puente de hidrógeno
deben tener diferencias significativas en su
electronegatividad, lo que crea una carga
parcialmente positiva en el átomo de
hidrógeno y una carga parcialmente
FUERZAS INTERMOLECULARES (FUERZAS DE VAN DER WAALS) negativa en el átomo electronegativo.
/ | \ 3. Fuerza Atractiva: El átomo de hidrógeno
FUERZAS DE DISPERSIÓN FUERZAS DIPOLO-DIPOLO PUENTES DE HIDRÓGENO con carga parcialmente positiva es atraído
hacia los átomos electronegativos con
DE LONDON (LONDRES) (DIPOLE-DIPOLE) (HYDROGEN BONDING) carga parcialmente negativa, lo que genera
/ \ / \ una fuerza atractiva entre las moléculas.
MOMENTO DIPOLAR MOMENTO DIPOLAR MOLÉCULAS CON HIDRÓGENO 4. Importancia: Las fuerzas de puente de
hidrógeno son más fuertes que las fuerzas
INDUCIDO (MOMENTARY PERMANENTE (PERMANENT UNIDO A UN ÁTOMO MUY dipolo-dipolo y las fuerzas de dispersión, lo
DIPOLE INDUCED DIPOLE) DIPOLE-DIPOLE) ELECTRONEGATIVO que las convierte en una fuerza
| | intermolecular importante en sustancias
como el agua (H2O), el ADN y las proteínas.
MOLÉCULAS NO POLARES MOLÉCULAS POLARES 5. Propiedades: Las fuerzas de puente de
SIN DIPOLO PERMANENTE CON DIPOLO PERMANENTE hidrógeno tienen un impacto significativo
| | en las propiedades físicas y químicas de las
sustancias. Por ejemplo, son responsables
FUERZAS DE DISPERSIÓN FUERZAS DE DISPERSIÓN de la alta tensión superficial y el alto punto
ENTRE TODAS LAS MOLÉCULAS ENTRE MOLÉCULAS POLARES de ebullición del agua.
También podría gustarte
- Formato Cuadro Comparativo Actividad N°5Documento5 páginasFormato Cuadro Comparativo Actividad N°5ElviciooAún no hay calificaciones
- Enlaces Químicos y Fuerzas IntermolecularesDocumento2 páginasEnlaces Químicos y Fuerzas IntermolecularesMelanie V. Balam Chan 3BAún no hay calificaciones
- Teoria de BandasDocumento1 páginaTeoria de BandasEvelyn LaraAún no hay calificaciones
- Actividad 5-Enlace Químico e Interacción MolecularDocumento3 páginasActividad 5-Enlace Químico e Interacción MolecularEduardo Lara100% (1)
- Guiatallerintermoleculares PDFDocumento4 páginasGuiatallerintermoleculares PDFMayerly CelisAún no hay calificaciones
- Interacciones No Covalentes Diagrama PDFDocumento2 páginasInteracciones No Covalentes Diagrama PDFCab CatAún no hay calificaciones
- ACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QADocumento23 páginasACFrOgCOBnR Zzq9uXh0Zt0cA p3IzdIM5-ET2YWavS2konAVLUcjqgqYZdhUvM28BgVlVFlTf-7QmkK 3ejN2EP5M8zR 0Bg7KKMGBAM5By05NYFJQDB EVXrR8QAJuli WidnikiewiczAún no hay calificaciones
- Fuerzas IntermolecularesDocumento13 páginasFuerzas IntermolecularesDavid Ignacio Gallardo DeloyaAún no hay calificaciones
- Fiq3-Propiedades Electricas de SuperficieDocumento59 páginasFiq3-Propiedades Electricas de SuperficieCarlos Anfer0% (1)
- En LacesDocumento1 páginaEn LacesChelo ZRAún no hay calificaciones
- Unidad Ll. Termodinamica de FasesDocumento76 páginasUnidad Ll. Termodinamica de Faseslitog72210Aún no hay calificaciones
- Tema 3 Enlace QuímicoDocumento20 páginasTema 3 Enlace Químicounai 007Aún no hay calificaciones
- Bloc de Notas Sin TítuloDocumento1 páginaBloc de Notas Sin TítulocatalinaAún no hay calificaciones
- Enlace QuímicoDocumento10 páginasEnlace Químicoal.samaykiAún no hay calificaciones
- Fuerzas IntermolecularesDocumento7 páginasFuerzas IntermolecularesecmAún no hay calificaciones
- Tipos de Enlace y GlosarioDocumento5 páginasTipos de Enlace y GlosarioAndres PelayoAún no hay calificaciones
- Cuadro ComparativoDocumento3 páginasCuadro ComparativoodalisAún no hay calificaciones
- Actividad 5. Enlaces Quimicos e I Nteracciones MolecularesDocumento6 páginasActividad 5. Enlaces Quimicos e I Nteracciones MolecularesJhon GomezAún no hay calificaciones
- Act 9Documento2 páginasAct 9duranximena96Aún no hay calificaciones
- TREPEVy FI - APDocumento11 páginasTREPEVy FI - APNot easy CodeAún no hay calificaciones
- Taller N°4 - Enlace Químico (1) ArregladoDocumento4 páginasTaller N°4 - Enlace Químico (1) ArregladoangelAún no hay calificaciones
- EXPOSICION QuimicaDocumento24 páginasEXPOSICION QuimicaDanna Paulina Gutierrez RosasAún no hay calificaciones
- Cuadro Sinoptico Enlaces QuimicosDocumento1 páginaCuadro Sinoptico Enlaces QuimicosGustavo Cc100% (2)
- Tipos de Enlaces Cuadro Comparativo Edilson PDFDocumento12 páginasTipos de Enlaces Cuadro Comparativo Edilson PDFDaniel FierroAún no hay calificaciones
- Presentación de Fuerzas Intermoleculares 2020aDocumento37 páginasPresentación de Fuerzas Intermoleculares 2020aleninAún no hay calificaciones
- Taller 2 Estructura de Los MaterialesDocumento13 páginasTaller 2 Estructura de Los Materialesabimael badran morenoAún no hay calificaciones
- Química TrípticoDocumento2 páginasQuímica TrípticoJennifer AriasAún no hay calificaciones
- Resumen Las Bases Quimicas de La VidaDocumento11 páginasResumen Las Bases Quimicas de La VidaJoha Quintero100% (1)
- FUERZAS INTERMOLECULARES (Inforgrafía)Documento2 páginasFUERZAS INTERMOLECULARES (Inforgrafía)Jesús JiménezAún no hay calificaciones
- Cuestionario de 100 PreguntasDocumento10 páginasCuestionario de 100 PreguntasUlises OlveraAún no hay calificaciones
- Archivo 20215818177Documento23 páginasArchivo 20215818177Erick RicardoAún no hay calificaciones
- Dra. Patricia GrimaltDocumento21 páginasDra. Patricia GrimaltrinohardoAún no hay calificaciones
- Semana 5 Fuerzas Intermoleculares 2024-1Documento28 páginasSemana 5 Fuerzas Intermoleculares 2024-1PRINS JEREMY VILLEGAS JULCAAún no hay calificaciones
- Formato de Entrega Tarea 1Documento4 páginasFormato de Entrega Tarea 1LISETH TATIANA ACUÑA ROBLESAún no hay calificaciones
- CLASE 1 Fuerzas IntermolecularesDocumento20 páginasCLASE 1 Fuerzas IntermolecularesAlisont Mella OlaveAún no hay calificaciones
- Mapa Conceptual Doodle A Mano MulticolorDocumento2 páginasMapa Conceptual Doodle A Mano Multicolor23030393Aún no hay calificaciones
- Actividad 5 - Quimica - Cuadro ComparativoDocumento6 páginasActividad 5 - Quimica - Cuadro ComparativoArmando MorenoAún no hay calificaciones
- Wuolah Free TEMA 5Documento6 páginasWuolah Free TEMA 5AuroraAún no hay calificaciones
- Tema II - Estructura y Propiedades (2016) PDFDocumento34 páginasTema II - Estructura y Propiedades (2016) PDFCamila EscobarAún no hay calificaciones
- FUERZAS IntermolecularesDocumento39 páginasFUERZAS IntermolecularesBelen BustarAún no hay calificaciones
- Quimica Dif Presentacion Fuerzas IntermolecularesDocumento15 páginasQuimica Dif Presentacion Fuerzas IntermolecularesTony LedesmaAún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS Intermolecularesloquillo1Aún no hay calificaciones
- Tarea 5. Enlaces QuímicosDocumento2 páginasTarea 5. Enlaces QuímicosjusellyAún no hay calificaciones
- Tema II - Estructura y Propiedades (2020)Documento37 páginasTema II - Estructura y Propiedades (2020)Mica CaceresAún no hay calificaciones
- FUERZAS IntermolecularesDocumento30 páginasFUERZAS IntermolecularesBrandon Jossehp Quispe ZarateAún no hay calificaciones
- Tarea 6 QuimicaDocumento4 páginasTarea 6 QuimicaESMARLIS BELLO JOSEAún no hay calificaciones
- S11 - Tema 4.4. Estructuras Supramoleculares v2Documento35 páginasS11 - Tema 4.4. Estructuras Supramoleculares v2ferney zarateAún no hay calificaciones
- Actividad 5 Enlace Quimico e Interaccion MolecularDocumento9 páginasActividad 5 Enlace Quimico e Interaccion MolecularBrahian RojasAún no hay calificaciones
- Glosario 3 QuímicaDocumento5 páginasGlosario 3 QuímicawilmanAún no hay calificaciones
- 6 Enlace Químico.Documento18 páginas6 Enlace Químico.pomachahuapinoyakimonicaAún no hay calificaciones
- Líquidos y SólidosDocumento42 páginasLíquidos y SólidosJuan Sebastian GilAún no hay calificaciones
- Fuerzas IntermolecularesDocumento7 páginasFuerzas IntermolecularesGabi RicoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento15 páginasFuerzas IntermolecularesLeo SAún no hay calificaciones
- Fuerzas de Enlaces Intermoleculares para Tercer Grado de SecundariaDocumento8 páginasFuerzas de Enlaces Intermoleculares para Tercer Grado de SecundariaNENA TORRES BORGESAún no hay calificaciones
- Adhesión y Cohesión PDFDocumento29 páginasAdhesión y Cohesión PDFJulio & Alejandra proyecto integradorAún no hay calificaciones
- Esquema IntermolecularesDocumento2 páginasEsquema Intermolecularesalvarius.9999Aún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS Intermolecularesdannaeh gomez cortesAún no hay calificaciones
- Fuerzas IntermolecuaresDocumento15 páginasFuerzas IntermolecuareskdaguileraAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- 2.1 Oxido ReducciónDocumento1 página2.1 Oxido ReducciónDiego OnofreAún no hay calificaciones
- 2.1.2 Etapas Número de OxidaciónDocumento1 página2.1.2 Etapas Número de OxidaciónDiego OnofreAún no hay calificaciones
- 1.6 PolímerosDocumento1 página1.6 PolímerosDiego OnofreAún no hay calificaciones
- Formato DemolicionesDocumento3 páginasFormato DemolicionesDiego OnofreAún no hay calificaciones
- Generador Instalacion Telefonica Tipo EmpresarialDocumento39 páginasGenerador Instalacion Telefonica Tipo EmpresarialDiego OnofreAún no hay calificaciones
- Generador Instalacion Sanitaria Tipo EmpresarialDocumento6 páginasGenerador Instalacion Sanitaria Tipo EmpresarialDiego OnofreAún no hay calificaciones
- Gaussian Entradas Impor PDFDocumento164 páginasGaussian Entradas Impor PDFJacob BautistaAún no hay calificaciones
- Clase 4Documento18 páginasClase 4Elizabeth CastroAún no hay calificaciones
- Practica 1 Quimica BasicaDocumento16 páginasPractica 1 Quimica BasicaEnrique Romero BlancoAún no hay calificaciones
- Tema 8 - Combinaciones Hidrogenadas de ENM de Los Grupos 17 - 13Documento23 páginasTema 8 - Combinaciones Hidrogenadas de ENM de Los Grupos 17 - 13Sara Solano100% (1)
- Apuntes Formulación InorgánicaDocumento12 páginasApuntes Formulación InorgánicaDRJAún no hay calificaciones
- Actividades de Quimica Contingencia Covid19Documento9 páginasActividades de Quimica Contingencia Covid19Omar Alejandro CBAún no hay calificaciones
- Actividad3 - Química BRAUDocumento13 páginasActividad3 - Química BRAUBraulio Oyervides0% (1)
- TALLER DE Enlaces QuimicosDocumento4 páginasTALLER DE Enlaces QuimicosCarlos MojicaAún no hay calificaciones
- Experimento de ThompsonDocumento28 páginasExperimento de ThompsonObed Jesus Del Valle SalasAún no hay calificaciones
- InorganicaDocumento19 páginasInorganicaanon_4002930740% (1)
- Unidad II Cap. 2 Reacciones OrgánicasDocumento10 páginasUnidad II Cap. 2 Reacciones OrgánicasDaniel Tapia BurgosAún no hay calificaciones
- Laboratorio Tabla PeriodicaDocumento32 páginasLaboratorio Tabla PeriodicaElvis Manco67% (3)
- Seccion QuimicaDocumento16 páginasSeccion QuimicaLiam CruzAún no hay calificaciones
- Resonancia o MesomeríaDocumento71 páginasResonancia o MesomeríaLuis E Aguilar RAún no hay calificaciones
- Tabla Periodica ModernaDocumento22 páginasTabla Periodica ModernaAndriy Aldair Macalupu RamirezAún no hay calificaciones
- 7 TALLER Tabla Periodica 2.3 BASICADocumento2 páginas7 TALLER Tabla Periodica 2.3 BASICASantiago AlvarezAún no hay calificaciones
- Enlaces VIIDocumento17 páginasEnlaces VIIDaniel RamírezAún no hay calificaciones
- Ejercicios de ComprobacionDocumento4 páginasEjercicios de ComprobacionyandrekAún no hay calificaciones
- Que Es El AtomoDocumento10 páginasQue Es El AtomoDavidCovicAún no hay calificaciones
- Propiedades Del AguaDocumento32 páginasPropiedades Del AguaSabrina AVILA BAEZAAún no hay calificaciones
- Presentacion Enlace QuimicoDocumento33 páginasPresentacion Enlace QuimicoTio InataAún no hay calificaciones
- Resumenes QuimicaDocumento59 páginasResumenes QuimicaAgustin LescanoAún no hay calificaciones
- Ciencias Quimica YumboDocumento24 páginasCiencias Quimica YumboJuanCarlosOrozcoCaicedo75% (4)
- Mecanismos de ReacciónDocumento7 páginasMecanismos de ReacciónrafaelticAún no hay calificaciones
- Antecedentes Práctica 1 Oxidación de Los Metales y PDFDocumento4 páginasAntecedentes Práctica 1 Oxidación de Los Metales y PDFKazuyaUedaTatsuyaAún no hay calificaciones
- Actividad 2 - Ingenieria de Los MaterialesDocumento20 páginasActividad 2 - Ingenieria de Los MaterialesJuan David Silva RojanoAún no hay calificaciones
- Propiedades PeriódicasDocumento35 páginasPropiedades PeriódicasLeidi HernandezAún no hay calificaciones
- Unidad 2 Lección 1 Taller ResonanciaDocumento22 páginasUnidad 2 Lección 1 Taller ResonanciamariaAún no hay calificaciones
- S 2 Q1216 (10-1)Documento4 páginasS 2 Q1216 (10-1)los sabiosAún no hay calificaciones
- Oxidación y ReducciónDocumento13 páginasOxidación y ReducciónKiaraAún no hay calificaciones