Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Linea Del Tiempo VBVA
Cargado por
Vanee Villanueva0 calificaciones0% encontró este documento útil (0 votos)
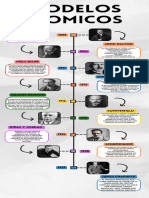
7 vistas1 páginaEl documento describe la evolución del modelo atómico desde Dalton hasta Schrödinger. Dalton propuso que los átomos eran las unidades básicas de los elementos que podían combinarse químicamente. Posteriormente, Rutherford, Thomson y Bohr realizaron experimentos que llevaron a modelos atómicos más precisos con núcleo y electrones. Finalmente, Schrödinger propuso un modelo cuántico no relativista donde los electrones se contemplaban como ondas estacionarias.
Descripción original:
Título original
Linea Del tiempo VBVA
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento describe la evolución del modelo atómico desde Dalton hasta Schrödinger. Dalton propuso que los átomos eran las unidades básicas de los elementos que podían combinarse químicamente. Posteriormente, Rutherford, Thomson y Bohr realizaron experimentos que llevaron a modelos atómicos más precisos con núcleo y electrones. Finalmente, Schrödinger propuso un modelo cuántico no relativista donde los electrones se contemplaban como ondas estacionarias.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
7 vistas1 páginaLinea Del Tiempo VBVA
Cargado por
Vanee VillanuevaEl documento describe la evolución del modelo atómico desde Dalton hasta Schrödinger. Dalton propuso que los átomos eran las unidades básicas de los elementos que podían combinarse químicamente. Posteriormente, Rutherford, Thomson y Bohr realizaron experimentos que llevaron a modelos atómicos más precisos con núcleo y electrones. Finalmente, Schrödinger propuso un modelo cuántico no relativista donde los electrones se contemplaban como ondas estacionarias.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
Vanessa Betzabeth Villanueva Aldape
1808
La primera hipótesis de Dalton fue mucho más compleja,
detallada y especifica que la de su antecesor Demócrito. A
pesar de que no trato de explicar la estructura atómica 1897
porque no tenía pruebas de cómo era un átomo, si descubrió
que elementos diferentes presentaban propiedades diferentes
y esto solo podía ocurrir si estaban formados por átomos.
A paliar de la teoría atómica de Dalton se puede definir al Al hacer pasar la corriente eléctrica, observó
átomo como la unidad básica de un elemento que puede que salían unos rayos del electrodo cargado
intervenir en una combinación química.
negativamente al electrodo cargado
positivamente, a los que nombró rayos
catódicos. En estudios posteriores identificó
1909 que estos rayos eran afectados por un campo
eléctrico y que eran atraídos por la parte
Rutherford observo que cuando utilizaba rayos emitidos positiva, por lo que se concluyó que estaban
por materiales radiactivos, estos atravesaban las láminas compuestos por partículas negativas a las que
de otros metales sin ninguna resistencia. Este experimento se llamó electrones. A partir de estas
le sugirió que los átomos estaban prácticamente huecos y
que no eran una masa homogénea positiva. También
observaciones experimental, Thomson
concluyó que, si el átomo tenía electrones, para sugirió el primer modelo de átomo.
neutralizar la carga negativa debían existir partículas de
carga positiva en la misma cantidad y esta debía estar muy
concentrada, a lo que llamó núcleo atómico. 1911
1913 Los descubrimientos de Rutherford lo llevaron
a proponer un nuevo modelo atómico en 1911,
Bohr propuso su modelo de estructura atómica,
el cual también se conoce como modelo
teniendo en cuenta el modelo planetario, la teoría
planetario, por su semejanza con la estructura
de cuantización de la energía propuesta por Max
del Sistema Solar.
Planck unos pocos años antes y el efecto
fotoeléctrico observado por Einstein. La emisión
de energía por parte de los átomos está cuantizada, 1926
o sea, que hay una cantidad mínima que se puede
liberar y si se libera más tiene que ser en múltiplos
de esa cantidad, esto fue utilizado por Bohr en su
El modelo atómico de Schrödinger es un
modelo, con lo cual resolvió algunos de los
problemas de su predecesor. modelo cuántico no relativista. En este
modelo los electrones se contemplaban
1932 originalmente como una onda
estacionaria de materia cuya amplitud
fue hasta 1932 que james Chadwick, físico decaía rápidamente al sobrepasar el radio
de origen inglés publicó como resultado de atómico.
sus investigaciones, el descubrimiento del
neutrón
También podría gustarte
- Linea Del Tiempo VBVADocumento1 páginaLinea Del Tiempo VBVAVanee VillanuevaAún no hay calificaciones
- Estructura Interna de La MateriaDocumento9 páginasEstructura Interna de La Materiakevin moralesAún no hay calificaciones
- Quimica - 4 ToDocumento5 páginasQuimica - 4 ToVictor Huerta RojasAún no hay calificaciones
- El Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaDocumento6 páginasEl Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaMariaElizabeth14Aún no hay calificaciones
- Química PREDocumento4 páginasQuímica PREVictor Huerta RojasAún no hay calificaciones
- Unidad 2Documento10 páginasUnidad 2Siocled Rls 635Aún no hay calificaciones
- Linea Del Tiempo de Los Modelos AtomicosDocumento8 páginasLinea Del Tiempo de Los Modelos AtomicosLaloo Antonio67% (3)
- Taller 2 El ÁtomoDocumento4 páginasTaller 2 El ÁtomocarolinaAún no hay calificaciones
- Tema 1. Estructura de La Materia (Apuntes y Actividades)Documento28 páginasTema 1. Estructura de La Materia (Apuntes y Actividades)Gloria GarciaAún no hay calificaciones
- Qui MicaDocumento235 páginasQui MicaJupiter GonzalezAún no hay calificaciones
- El Átomo. Conceptos Básicos.Documento12 páginasEl Átomo. Conceptos Básicos.Laura ColomAún no hay calificaciones
- Teorías AtómicasDocumento5 páginasTeorías AtómicasAlejandro SegoviaAún no hay calificaciones
- Guia Teoria Atomica 8° BASICODocumento7 páginasGuia Teoria Atomica 8° BASICOAnonymous PShSARDzgYAún no hay calificaciones
- Modelo AtómicoDocumento12 páginasModelo AtómicoVanesa PaniaguaAún no hay calificaciones
- Investigacion Sobre El AtomoDocumento4 páginasInvestigacion Sobre El AtomodahietsyAún no hay calificaciones
- PRESENTACIÓN T4 - FyQ - 3ºESODocumento20 páginasPRESENTACIÓN T4 - FyQ - 3ºESOKirvyxAún no hay calificaciones
- Historia Modelo AtomicoDocumento3 páginasHistoria Modelo Atomicopocholo9415Aún no hay calificaciones
- Teoría AtómicaDocumento4 páginasTeoría AtómicaBryan GavilánezAún no hay calificaciones
- Teoría AtómicaDocumento30 páginasTeoría AtómicaSEGECSACAún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicosNelson-black-master130Aún no hay calificaciones
- Actividad de Aprendizaje Biii Modelo Atomico-1Documento3 páginasActividad de Aprendizaje Biii Modelo Atomico-1Angie OchoaAún no hay calificaciones
- Tema IDocumento32 páginasTema IExequiel RomeoAún no hay calificaciones
- 3ºA Carazas Linea de Tiempo AtomoDocumento26 páginas3ºA Carazas Linea de Tiempo AtomoAmparo Rodriguez0% (1)
- Guia de Trabajo Modelos AtomicosDocumento8 páginasGuia de Trabajo Modelos AtomicosCarlos MolinaAún no hay calificaciones
- Taller 2 Quimica, Grupo 4Documento11 páginasTaller 2 Quimica, Grupo 4Andres CedeñoAún no hay calificaciones
- Modelos Del AtomoDocumento2 páginasModelos Del Atomocamiv14ygAún no hay calificaciones
- El Átomo A Través Del TiempoDocumento8 páginasEl Átomo A Través Del Tiempoorlando pachecoAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosannyAún no hay calificaciones
- Guia QuimicaDocumento26 páginasGuia QuimicaANA KAREN HERNANDEZ BERUMENAún no hay calificaciones
- Modelo Atómico de ThomsonDocumento3 páginasModelo Atómico de ThomsonLeri OspinaAún no hay calificaciones
- Antecedentes Del AtomoDocumento11 páginasAntecedentes Del AtomoKevin100% (1)
- Modelos AtomicosDocumento3 páginasModelos AtomicosSantiago San MiguelAún no hay calificaciones
- Modelo Atomico de RutherfordDocumento7 páginasModelo Atomico de RutherfordAlejandro122009Aún no hay calificaciones
- Modelos Atómicos. Breve DescripciónDocumento8 páginasModelos Atómicos. Breve DescripciónLaporte y AsociadosAún no hay calificaciones
- 3esomapi GD Esu06Documento12 páginas3esomapi GD Esu06M IAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosSaranndongaAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosSaranndonga100% (1)
- Teorias de Modelos Atómicos y AntecedentesDocumento13 páginasTeorias de Modelos Atómicos y Antecedentesquitoquito2012Aún no hay calificaciones
- Antecedentes Del AtomoDocumento11 páginasAntecedentes Del AtomoKevinAún no hay calificaciones
- Ilovepdf MergedDocumento14 páginasIlovepdf MergedFELIPE RONALDO ROSADO SALTOSAún no hay calificaciones
- GRUPO DE TRABAJ2 QuimicaDocumento10 páginasGRUPO DE TRABAJ2 QuimicaFELIPE RONALDO ROSADO SALTOSAún no hay calificaciones
- La Evolucion de Los Modelos AtomicosDocumento13 páginasLa Evolucion de Los Modelos AtomicosFELIX RAUL ECHEVERRIA CUBASAún no hay calificaciones
- CF 5F3 A Física Nuclear Y Departículas: SEMESTRE 2022-1Documento20 páginasCF 5F3 A Física Nuclear Y Departículas: SEMESTRE 2022-1ALEJANDRO FALCONERIO TORRES MALDONADOAún no hay calificaciones
- Experimentos Que Condujeron Al Descubrimiento de Las Partículas Subatómicas y El Planteamiento de Los Modelos Atómicos de Thompson y BohrDocumento4 páginasExperimentos Que Condujeron Al Descubrimiento de Las Partículas Subatómicas y El Planteamiento de Los Modelos Atómicos de Thompson y BohrFATIMA SARAHY MEDINA ESPARZAAún no hay calificaciones
- Modelos AtomicosDocumento12 páginasModelos AtomicosXtian LopezAún no hay calificaciones
- Modelos AtomicosDocumento7 páginasModelos AtomicosLalo EspinoAún no hay calificaciones
- Teoría AtómicaDocumento6 páginasTeoría AtómicaAngello MolinaAún no hay calificaciones
- Lectura 3Documento8 páginasLectura 3Josue RuizAún no hay calificaciones
- Guía de Trabajo Modelos AtomicosDocumento7 páginasGuía de Trabajo Modelos AtomicosNorella FernándezAún no hay calificaciones
- c08102l Educarchile Modelo AtomicoDocumento4 páginasc08102l Educarchile Modelo AtomicoVictor Figueroa AvilaAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosCecia VallejosAún no hay calificaciones
- Actividad 1 Teoria AtomicaDocumento12 páginasActividad 1 Teoria AtomicaAlexis CastilloAún no hay calificaciones
- 03-Nacimiento de La Teoría Cuantica 1 y 2Documento16 páginas03-Nacimiento de La Teoría Cuantica 1 y 2DanAún no hay calificaciones
- Quimica General e Inorganica Clase 3Documento56 páginasQuimica General e Inorganica Clase 3Edwin Pomatanta PlasenciaAún no hay calificaciones
- Cuadro ComparativoDocumento2 páginasCuadro Comparativojorje antonio morales londoñoAún no hay calificaciones
- LECTURA 2.1 El Átomo, Historia y Estructura.Documento7 páginasLECTURA 2.1 El Átomo, Historia y Estructura.Esther GuanangaAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- El Cabello Tambien HablaDocumento111 páginasEl Cabello Tambien HablaAndrea Mendez100% (3)
- Mensaje de Navidad 1967-68 - Los Cuerpos SolaresDocumento76 páginasMensaje de Navidad 1967-68 - Los Cuerpos SolaresmikehawkAún no hay calificaciones
- Examen Intermedio Comipems 2016 PDFDocumento18 páginasExamen Intermedio Comipems 2016 PDFlitsy joselinAún no hay calificaciones
- Historia Del ÁtomoDocumento5 páginasHistoria Del ÁtomoDanna Irais Ramírez PérezAún no hay calificaciones
- Isotopos RadiactivosDocumento3 páginasIsotopos RadiactivosluisAún no hay calificaciones
- Umm f1 b1 Ep1 1,1 2Documento12 páginasUmm f1 b1 Ep1 1,1 2German MartinezAún no hay calificaciones
- CristalofisicaDocumento56 páginasCristalofisicaJonathan MóntalvoAún no hay calificaciones
- Enlace IonicoDocumento4 páginasEnlace Ionicomariliag730Aún no hay calificaciones
- La Materia y Sus Interacciones - PromoDocumento40 páginasLa Materia y Sus Interacciones - PromoJose de Jesus Esquivel Salcedo100% (4)
- C4 EstáticaDocumento45 páginasC4 EstáticaSEBASTIAN ALEJANDRO ARCE VILLARAún no hay calificaciones
- Introduccion A La Quimica y Estructura AtomicaDocumento38 páginasIntroduccion A La Quimica y Estructura AtomicaJesus ToroAún no hay calificaciones
- Ciencia PreguntasDocumento5 páginasCiencia Preguntasmayra dayana mamani gonzalesAún no hay calificaciones
- Artículo RevistaDocumento13 páginasArtículo RevistaJocelyn Miranda QuesadaAún no hay calificaciones
- Cuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Documento3 páginasCuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Rogger Rjor100% (1)
- Temario OLCOQUIM Avanzada 2023Documento17 páginasTemario OLCOQUIM Avanzada 2023Lasfrek BackgroundAún no hay calificaciones
- Clases de Química Grado SéptimoDocumento83 páginasClases de Química Grado SéptimoCristian David Camacho RodriguezAún no hay calificaciones
- Silabo Quimica GeneralDocumento7 páginasSilabo Quimica GeneralAndy RojasAún no hay calificaciones
- Clase 1 - Física PDFDocumento38 páginasClase 1 - Física PDFJOHN ALEXANDER GAITAN PALENCIAAún no hay calificaciones
- SOLUCIONARIODocumento50 páginasSOLUCIONARIOLaMagaYFitoVillamarínCastro100% (1)
- El Modelo Atómico de DaltonDocumento6 páginasEl Modelo Atómico de DaltonOrtiz WilliamAún no hay calificaciones
- RQUI404Documento3 páginasRQUI404VES18Aún no hay calificaciones
- Planificación Semestral Primero 2022Documento4 páginasPlanificación Semestral Primero 2022José Nicolás Venegas RodríguezAún no hay calificaciones
- Trabajo de La Tabla PeriodicaDocumento12 páginasTrabajo de La Tabla PeriodicaDeivi Perez100% (1)
- Reporte de Lectura Por Que Se Rompen Los ObjetosDocumento2 páginasReporte de Lectura Por Que Se Rompen Los ObjetosIsrael Rivas Iglesias100% (1)
- Infografia Línea Del TiempoDocumento1 páginaInfografia Línea Del TiempoShanida Jimena Acuña collachaguaAún no hay calificaciones
- Naturaleza Del Enlace QuímicoDocumento15 páginasNaturaleza Del Enlace QuímicoRUMBASILONAún no hay calificaciones
- Repaso 2 Semana 9 Química 2do SecundariaDocumento18 páginasRepaso 2 Semana 9 Química 2do SecundariaAnthony HuacachiAún no hay calificaciones
- Nucleo y SubparticulasDocumento12 páginasNucleo y SubparticulasAna Luz FloresAún no hay calificaciones
- Guía N°10 Modelos AtómicosDocumento4 páginasGuía N°10 Modelos AtómicosCarolina mAún no hay calificaciones
- Uso de Isotopos en La MedicinaDocumento5 páginasUso de Isotopos en La Medicinakatherine100% (1)