Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Actividad de Aprendizaje Biii Modelo Atomico-1
Cargado por
Angie Ochoa0 calificaciones0% encontró este documento útil (0 votos)
53 vistas3 páginasTítulo original
ACTIVIDAD DE APRENDIZAJE BIII MODELO ATOMICO-1
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
53 vistas3 páginasActividad de Aprendizaje Biii Modelo Atomico-1
Cargado por
Angie OchoaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
ACTIVIDAD DE APRENDIZAJE BIII MODELO ATÓMICO
¿Cómo se llegó al conocimiento del átomo actual?
I. Completa el siguiente cuadro que muestra el orden cronológico de las aportaciones
al modelo atómico, cuidando la ortografía y redacción.
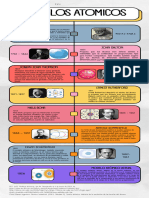
Año Científico(s) Principal aportación Modelo propuesto
Dalton ideó el primer sistema de símbolos
para los elementos (sustituido después por el
de Berzelius) y publicó una tabla de pesos
1808 Dalton atómicos de 21 elementos. Sabía, por
ejemplo, que el hidrógeno era el más ligero,
así que le asignó un peso atómico de uno.
Decía que mantenía que el átomo es una
esfera de carga positiva distribuida
uniformemente de un amstrong de diámetro,
1904 Thomson en la cual se encuentran empotrados los
electrones neutralizando la carga positiva. Si
los electrones son desplazados, intentarían
volver a su posición original, lo cual le da una
estabilidad inherente.
Determinó el valor carga/masa para el
protón,por lo que a él se le atribuye su
1930 Goldstein descubrimiento. La masa del protón tiene un
valor 1837 veces mayor que la del electrón.
Router Fort había postulado en 1914 la
existencia de protones en los núcleos.v
Se le debe un modelo atómico, con el que
probó la existencia del núcleo atómico, en el
1911 Rutherford que se reúne toda la carga positiva y casi toda
la masa del átomo.
1932 Chadwick Un descubrimiento que condujo
directamente a la fisión nuclear y a la bomba
atómica.
1925 Heisemberg Afirmaba que la posición exacta de un
electrón dentro de un núcleo atómico en un
momento dado no podía conocerse con
certeza, sino que solo se calculaba
estadísticamente dentro de una probabilidad.
1913 Bohr Propuso su modelo cuantizado del átomo
para explicar cómo los electrones pueden
tener órbitas estables alrededor del núcleo.
Bohr se dio cuenta de que para construir un
modelo atómico satisfactorio tenía que incluir
de alguna manera el cuanto de energía de
Planck-Einstein.
1916 Sommerfeld introdujo la constante de estructura fina ( a =
1/137), como una medida relativista de las
desviaciones en las líneas espectrales
atómicas de las predicciones hechas por el
modelo de Bohr, pero que con el paso de los
años pasó a caracterizar la fuerza de la
interacción electromagnética entre partículas
1926 Schrödinger Sugirió que el movimiento de los electrones
en el átomo correspondía a la dualidad
onda-partícula y, en consecuencia, los
electrones podían moverse alrededor del
núcleo como ondas estacionarias.
1928 Dirac-Jordan Fundó la teoría cuántica de campos con su
interpretación de la ecuación de Dirac como
una ecuación de muchos cuerpos, con la cual
predijo la existencia de la antimateria así
como los procesos de aniquilación de materia
y antimateria.
Objeto de aprendizaje:
Conceptos básicos (número atómico, masa atómica y número
de masa)
Actividad de Aprendizaje
BIII: Modelos Atómicos
¿Cuáles son las relaciones y cantidades de las partículas subatómicas?
¿Cuáles son las
II. Resuelve los siguientes ejercicios relacionados con el número atómico y número de
masa. Apóyate consultando la información sobre número atómico, masa atómica y
número de masa.
Define los siguientes conceptos:
Número atómico
Número de masa
Masa atómica
También podría gustarte
- Modelos AtómicosDocumento14 páginasModelos Atómicossseb@ss95% (44)
- Diodos ElectrónicaDocumento18 páginasDiodos ElectrónicaJesus Brito RodríguezAún no hay calificaciones
- Qui MicaDocumento235 páginasQui MicaJupiter GonzalezAún no hay calificaciones
- Linea de Tiempo Aportaciones en El Modelo AtomicoDocumento5 páginasLinea de Tiempo Aportaciones en El Modelo AtomicoJuan PabloAún no hay calificaciones
- 3ºA Carazas Linea de Tiempo AtomoDocumento26 páginas3ºA Carazas Linea de Tiempo AtomoAmparo Rodriguez0% (1)
- Mapa de Tiempo Del Átomo - QuímicaDocumento5 páginasMapa de Tiempo Del Átomo - QuímicaDavid FarinangoAún no hay calificaciones
- Modulo 3 Teorias AtómicasDocumento4 páginasModulo 3 Teorias AtómicasAnghela Robles CotrinaAún no hay calificaciones
- Cuadro Comparativo - Modelos AtomicosDocumento3 páginasCuadro Comparativo - Modelos AtomicosEuan Sánchez Gabriel EduardoAún no hay calificaciones
- La Teoría Atómica Unidad 2Documento3 páginasLa Teoría Atómica Unidad 2Luis Manuel Garcia de la CruzAún no hay calificaciones
- Infografia Informativa Bellas Artes Cuadros Simple Llamativa AzulDocumento2 páginasInfografia Informativa Bellas Artes Cuadros Simple Llamativa Azulwtgw4nw66gAún no hay calificaciones
- Modelo AtomicoDocumento4 páginasModelo AtomicoRoberto Lopez HernándezAún no hay calificaciones
- Historia de los modelos atómicosy modelo mecanico cuanticoDocumento20 páginasHistoria de los modelos atómicosy modelo mecanico cuanticoDELMY ISABEL ÁLVAREZ VILLAFRANCOAún no hay calificaciones
- MÓDULO 2 - Fundamentos de QuímicaDocumento52 páginasMÓDULO 2 - Fundamentos de Químicajose.torres1Aún no hay calificaciones
- Linea de Tiempo Modelos AtomicosDocumento1 páginaLinea de Tiempo Modelos AtomicosMARCO ANTONIO RAMIREZ REYESAún no hay calificaciones
- ModelosDocumento3 páginasModelosricky hernandezAún no hay calificaciones
- Átomo CuestionarioDocumento5 páginasÁtomo CuestionarioGabriel MataAún no hay calificaciones
- Evolución modelos atómicosDocumento6 páginasEvolución modelos atómicosYamilet ReyesAún no hay calificaciones
- Modulo - 3 - Teorias AtómicasDocumento4 páginasModulo - 3 - Teorias Atómicasrideroy0105Aún no hay calificaciones
- NIVELACIÓN FORMATIVA 2 - 2do. CURSODocumento4 páginasNIVELACIÓN FORMATIVA 2 - 2do. CURSOVanessa CBAún no hay calificaciones
- Clase ESTRUCTURA DE LA MATERIA Y SUS PROPIEDADESDocumento24 páginasClase ESTRUCTURA DE LA MATERIA Y SUS PROPIEDADESBerny DiazAún no hay calificaciones
- Tarea Evidencias de Estructura AtómicaDocumento5 páginasTarea Evidencias de Estructura Atómicaalanntorres09ctrlAún no hay calificaciones
- Estructura atómica 3o ESODocumento20 páginasEstructura atómica 3o ESOKirvyxAún no hay calificaciones
- QG1 - C5 - Teoría AtómicaDocumento39 páginasQG1 - C5 - Teoría AtómicaJULIÁN HERNÁNDEZ COLORADOAún no hay calificaciones
- ATOMOS_Y_ENLACES_QUIMICODocumento5 páginasATOMOS_Y_ENLACES_QUIMICOgevipo7855Aún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtomicosDocumento1 páginaCuadro Comparativo de Los Modelos Atomicoslautarobre10Aún no hay calificaciones
- 4.1.1 y 4.1.2 Modelos-AtomicosDocumento34 páginas4.1.1 y 4.1.2 Modelos-AtomicosjimezasAún no hay calificaciones
- Modelos Del AtomoDocumento2 páginasModelos Del Atomocamiv14ygAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosRaulZorrillaAún no hay calificaciones
- Linea Del Tiempo VBVADocumento1 páginaLinea Del Tiempo VBVAVanee VillanuevaAún no hay calificaciones
- Línea de Tiempo (Átomo)Documento1 páginaLínea de Tiempo (Átomo)l.q.nan.vAún no hay calificaciones
- Linea Del Tiempo VBVADocumento1 páginaLinea Del Tiempo VBVAVanee VillanuevaAún no hay calificaciones
- Hernández Cruz Frida Pamela - Modelos Átomicos - 551Documento3 páginasHernández Cruz Frida Pamela - Modelos Átomicos - 551ho liAún no hay calificaciones
- Modelos AtómicosDocumento2 páginasModelos AtómicosSo VAún no hay calificaciones
- Cuadro ComparativoDocumento2 páginasCuadro Comparativojorje antonio morales londoñoAún no hay calificaciones
- Research Methods Lesson by SlidesgoDocumento3 páginasResearch Methods Lesson by SlidesgoLuis Eduardo Sanchez PerezAún no hay calificaciones
- Química InorgánicaDocumento26 páginasQuímica InorgánicaSayde SifuentesAún no hay calificaciones
- Modelos AtomicosDocumento17 páginasModelos AtomicosRubenAún no hay calificaciones
- El Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaDocumento6 páginasEl Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaMariaElizabeth14Aún no hay calificaciones
- Teoria AtomicaDocumento6 páginasTeoria AtomicaAnthonyAún no hay calificaciones
- Semana 1 Estructura AtómicaDocumento63 páginasSemana 1 Estructura AtómicaEdder Daga RiveraAún no hay calificaciones
- Modelos atómicos históricosDocumento1 páginaModelos atómicos históricosFranklin Enmanuel Cordero BobadillaAún no hay calificaciones
- Modelo Atómico de DaltonDocumento3 páginasModelo Atómico de Daltonpokemon gonAún no hay calificaciones
- 4Documento6 páginas4perladz12Aún no hay calificaciones
- Quimica - 4 ToDocumento5 páginasQuimica - 4 ToVictor Huerta RojasAún no hay calificaciones
- Modelo Atomico de RutherfordDocumento7 páginasModelo Atomico de RutherfordAlejandro122009Aún no hay calificaciones
- Guía N°3 - Módelo y Estructura AtómicaDocumento6 páginasGuía N°3 - Módelo y Estructura AtómicaAngrySquirl 24Aún no hay calificaciones
- Lectura Modelos AtómicosDocumento5 páginasLectura Modelos AtómicosJuan Jose EusseAún no hay calificaciones
- 1.-Modelos AtomicosDocumento23 páginas1.-Modelos Atomicosalanalambre2607Aún no hay calificaciones
- Resumen Modelos AtómicosDocumento6 páginasResumen Modelos Atómicosyour.worst.nightmare79417873Aún no hay calificaciones
- Actividades Química 4Documento10 páginasActividades Química 4valentinauruenaaAún no hay calificaciones
- Boson FermionDocumento5 páginasBoson FermionInformatica Municipalidad de ZacapaAún no hay calificaciones
- Teorias Atomicas en Orden Cronologico PDFDocumento1 páginaTeorias Atomicas en Orden Cronologico PDFManuel José Rodríguez MillánAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosannyAún no hay calificaciones
- El Átomo A Través Del TiempoDocumento8 páginasEl Átomo A Través Del Tiempoorlando pachecoAún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtómicosDocumento6 páginasCuadro Comparativo de Los Modelos AtómicosJesús Alexander MejíazAún no hay calificaciones
- Guia N°1 Cálculo III UCTDocumento3 páginasGuia N°1 Cálculo III UCTErick Hoffman DatwaylerAún no hay calificaciones
- PE Estática PDFDocumento2 páginasPE Estática PDFOlimpiada Ciencia TabascoAún no hay calificaciones
- Practica 1Documento2 páginasPractica 1jonathanedgar.aguirre8Aún no hay calificaciones
- Horarios Electromecanica - 202150Documento1 páginaHorarios Electromecanica - 202150Samy Tefyta CunalataAún no hay calificaciones
- Curso Instalador Split Con Tecnología Inverter Clase N°1Documento14 páginasCurso Instalador Split Con Tecnología Inverter Clase N°1Arii MiicaaelaAún no hay calificaciones
- Teoría Cuántica de Max PlanckDocumento2 páginasTeoría Cuántica de Max PlanckGustavo Alonso Luévanos ArizmendiAún no hay calificaciones
- Guia de TermoDocumento2 páginasGuia de TermoSantosErnestoMamaniApazaAún no hay calificaciones
- El Geoide-1Documento16 páginasEl Geoide-1YolandaAruquipaSaldañaAún no hay calificaciones
- De Fisica 1 Parcial 1Documento46 páginasDe Fisica 1 Parcial 1Andres Ospina MuñozAún no hay calificaciones
- Triptico Bcos de Capacitores en BT Single Oct 2011Documento6 páginasTriptico Bcos de Capacitores en BT Single Oct 2011Jose ManuelAún no hay calificaciones
- TALLER 1 Convercion de Unidades Sebastian HDocumento6 páginasTALLER 1 Convercion de Unidades Sebastian HSEBASTIAN ANDRES HERNANDEZ CEBALLOSAún no hay calificaciones
- Informes Suelosii PDFDocumento72 páginasInformes Suelosii PDFWitman CrCzAún no hay calificaciones
- Generador compuesto: Características para diferentes grados de composiciónDocumento17 páginasGenerador compuesto: Características para diferentes grados de composiciónsebastian soteloAún no hay calificaciones
- Práctica Ley de Hooke-Gb-Horna Angulo StacyDocumento7 páginasPráctica Ley de Hooke-Gb-Horna Angulo StacyStacy Horna AnguloAún no hay calificaciones
- Estructuras BidimensionalesDocumento49 páginasEstructuras BidimensionalesJose Manuel Folgueral GonzálezAún no hay calificaciones
- Guia Atomos y MoléculasDocumento8 páginasGuia Atomos y MoléculasvivianaAún no hay calificaciones
- Energia Especifica en Canales FinalDocumento19 páginasEnergia Especifica en Canales FinalErwinBertBellidoAñancaAún no hay calificaciones
- Práctica Especial Cerámica - Sinterizacion y ConformadoDocumento13 páginasPráctica Especial Cerámica - Sinterizacion y ConformadoAndy ValozAún no hay calificaciones
- Metodo Estático y DinámicoDocumento0 páginasMetodo Estático y DinámicoWilian Edson Palomino ArangoAún no hay calificaciones
- Evaluac de La Mini Separata Trabajo y Energía - 2018Documento3 páginasEvaluac de La Mini Separata Trabajo y Energía - 2018Hebert MejíaheAún no hay calificaciones
- Unidad 6Documento3 páginasUnidad 6Gustavo BarriosAún no hay calificaciones
- Curva de Linealidad PracticaDocumento9 páginasCurva de Linealidad PracticaMiguelAún no hay calificaciones
- Practica 5 DispositivosDocumento16 páginasPractica 5 DispositivosEmiliano Ceron100% (1)
- Hi 2550Documento4 páginasHi 2550erwinchAún no hay calificaciones
- Lingua Latina Pars II Roma Aeterna PDFDocumento1 páginaLingua Latina Pars II Roma Aeterna PDFGabinete GioiaAún no hay calificaciones
- Solucion Ejercicios Margules ELLDocumento7 páginasSolucion Ejercicios Margules ELLJuan David Rangel PintoAún no hay calificaciones
- Trabajo Sobre El Terreno Arcilloso Del Barrio Las Terrazas de BarranquillaDocumento18 páginasTrabajo Sobre El Terreno Arcilloso Del Barrio Las Terrazas de BarranquillaJuan PachecoAún no hay calificaciones
- Tecnicas Radiograficas Usadas en VeterinariaDocumento65 páginasTecnicas Radiograficas Usadas en VeterinariaJorge Ramirez100% (1)
- FES Flower Essence Repertory TraduccionDocumento129 páginasFES Flower Essence Repertory TraduccionSonjapl100% (2)