Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Sol Diagramas de Fases
Cargado por
juan ortigosaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Sol Diagramas de Fases
Cargado por
juan ortigosaCopyright:
Formatos disponibles
Diagramas de fases
ALEACIONES. DIAGRAMAS DE EQUILIBRIO
DIAGRAMAS ISOMÓRFICOS BINARIOS
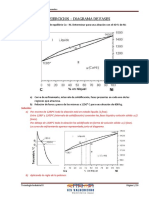
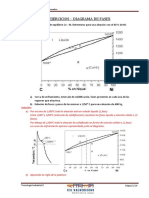
Para estudiar este tipo de diagrama
vamos a basarnos en el diagrama Cu – Ni.
Es el sistema más clásico por su fácil
comprensión e interpretación. En ordenadas
se representa la temperatura, y en
abscisas la concentración en peso.
La composición varía desde el 0% en
peso de Ni (100% de Cu) en el extremo
izquierdo, hasta el 100% de Ni (0% de Cu) en
el extremo derecho.
En el diagrama podemos observar 3
campos delimitados por 2 líneas: un campo
sólido α, un campo líquido L y un campo
bifásico α+L.
Cada campo se caracteriza por las
fases existentes en el tramo de temperaturas
y concentraciones delimitado por las líneas
limitadoras de fases.
El líquido L es una disolución
homogénea compuesta por Cu y Ni. La fase α
es una disolución sólida por sustitución, de átomos de Cu y de Ni. A temperaturas
inferiores a 1080ºC el Cu y el Ni son mutuamente solubles en estado sólido a cualquier
composición, ya que Cu y Ni tienen la misma estructura cristalina (FCC), radios atómicos
y electronegatividades casi idénticas, así como valencias muy similares. Este sistema
resultante se denomina isomorfo, porque sus componentes son totalmente solubles
en estado sólido y líquido.
Las líneas de solidus y liquidus interseccionan a derecha e izquierda con la
ordenada temperatura; los puntos de intersección coinciden con los puntos de fusión de
los componentes puros. En este caso son 1085ºC para el Cu y 1455ºC para el Ni.
Para cualquier composición diferente de los componentes puros, tiene lugar el
fenómeno de la fusión en un tramo de temperaturas comprendido entre las líneas de
solidus y liquidus. En este margen permanecen en equilibrio las fases sólida y líquida. Por
ejemplo, calentando una aleación de 50% de peso en Ni y 50% de Cu, esta comienza a
fundir a 1280ºC, y la proporción de líquido aumenta al incrementar la temperatura hasta
llegar a los s1320ºC, en que la aleación funde totalmente.
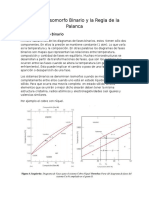
INTERPRETACIÓN GENERAL DEL DIAGRAMA DE FASES
Conociendo la concentración y la temperatura de equilibrio, los sistemas binarios
nos suministran la información siguiente: número de fases presentes en el equilibrio
composición de cada fase y la fracción o porcentaje de cada fase. Nos vamos a referir
siempre al diagrama Cu – Ni.
Javier Alijo Ramas 1
Diagramas de fases
1.- Número de fase presentes: El punto A representa una aleación de composición 60%
en peso de Ni y 40% en peso de Cu, a 1100ºC; se encuentra en la región monofásica α,
por lo que únicamente estará presente la fase α. El punto B representa una aleación de
35% en peso de Ni y 65% en peso de Cu a 1250ºC, y se encuentra en la región bifásica
α+L, por tanto, estarán presentes la fase α en equilibrio con la fase líquida L.
2.- Determinación de la composición de las fases: Primero localizaremos el punto
temperatura – concentración en el diagrama de fases. En un sistema monofásico, el
procedimiento es sencillo: la composición de la fase coincide con la composición total de
la aleación. Ejemplo: consideramos el punto A, aleación 60% en peso de Ni y 40% en
peso de Cu a 1100ºC. En estas condiciones de composición y de temperatura sólo existe
una fase.
Para una aleación en condiciones de composición y temperatura localizada en una
región bifásica, la solución es más complicada. En estas regiones podemos trazar
imaginariamente líneas horizontales a una temperatura determinada, que denominaremos
rectas de reparto o isotermas. Las concentraciones en equilibrio de las dos fases
presentes se calculan de la siguiente manera:
1.- Se traza una recta a través de la región bifásica a la temperatura de la aleación.
2.- Se anotan las intersecciones de la recta de reparto con los dos límites de fase
de los extremos.
3.- A partir de las intersecciones, se trazan perpendiculares hasta el eje de
abscisas. Las intersecciones resultantes corresponden a las composiciones de las fases
presentes.
Por ejemplo, nos fijamos en el punto B de la
figura, que se encuentra dentro de la región α+L.
Trazamos la recta de reparto, tal como se indica.
La perpendicular desde la intersección de la recta
de reparto con la línea de liquidus corta en el eje
de abscisas, resultando la siguiente composición:
32% en peso de Ni y 68% en peso de Cu, que es
la composición de la fase líquida CL . Del mismo
modo, la recta de reparto intersecciona con la línea
de solidus y la perpendicular nos da la composición
en la fase sólida Cα, que corresponde a 43% en
peso de Ni y 57% en peso de Cu.
3.- Determinación de la cantidad de fases: La cantidad relativa como fracción o como
porcentaje, de las fases presentes en el equilibrio se puede calcular mediante los
diagramas de fases. Los campos monofásicos y bifásicos se deben tratar separadamente.
La solución es obvia para la región monofásica, ya que sólo existe una fase. El
porcentaje es del 100%. Refiriéndonos al punto A de la primera figura en la aleación de
60% en peso de Ni y 40% en peso de Cu a 1100ºC, sólo existe la fase α y la aleación es
100% α.
Si el punto composición – temperatura está localizado dentro de la región bifásica,
el problema se complica un poco. La recta de reparto debe utilizarse conjuntamente con
un procedimiento que denominamos regla de la palanca, que aplicaremos de la siguiente
forma:
Javier Alijo Ramas 2
Diagramas de fases
1.- A la temperatura de la aleación se traza un segmento de recta de reparto a
través de la región bifásica.
2.- La composición total de la aleación está localizada en el segmento de recta de
reparto.
3.- La fracción de una fase se calcula midiendo la longitud del segmento de la recta
de reparto, desde la composición de la aleación hasta el límite de la otra fase, y
dividiéndola por la longitud total del segmento de isoterma.
4.- La fracción de la otra fase se determina del mismo modo.
5.- Si lo que interesa son los porcentajes de fases, se multiplican por 100 las
fracciones de fase.
La longitud del segmento de la recta de reparto se mide con la ayuda de una regla,
o bien restando los valores de composición que figuran en el eje de abscisas.
Fijándonos ahora en el punto B de la última figura, la aleación Cu – Ni tiene una
composición de 35% en peso de Ni y 65% en peso de Cu a 1250ºC, coexistiendo dos
fases α y L. La dificultad radica en calcular la proporción de ambas.
La composición de la aleación viene dada por el punto C 0, al que corresponden
unas fracciones de masa de las fases que llamaremos ω L y ωα, que calcularemos
aplicando la regla de la palanca:
ωL • R = ωα • S
ωL + ωα = 100
S R
De donde: L= 100 y α= 100
R +S R+ S
C α−C0
Podemos obtener ωL restando las composiciones como: L=
Cα−C L
Donde Cα = 43% en peso de Ni; C0 = 35% en peso de Ni; y CL = 32% en peso de Ni.
Sustituyendo obtenemos:
43−35
L= =0,73
43−32
De igual modo calculamos la fase α:
R C −C L 35−32
α= = 0 = =0,27
R+ S C α−C L 43−32
Resumiendo, si conocemos la temperatura y la composición y se ha alcanzado el
equilibrio, la regla de las fases se emplea para determinar las cantidades relativas o
fracciones de fases en los campos bifásicos de aleaciones binarias. Es fácil
confundir los procedimientos de determinación de composición de las fases con los de
cantidades relativas de fases presentes. La composición de las fases se expresa en
términos de concentración de los componentes. En una aleación monofásica, la
composición de la fase coincide con la composición total de la aleación. En una aleación
bifásica debemos utilizar la recta de reparto, cuyos extremos determinan las
Javier Alijo Ramas 3
Diagramas de fases
composiciones de las relativas fases. Respecto a las cantidades relativas de fases, la fase
equivale a la aleación en una aleación monofásica. En una bifásica se debe utilizar la
regla de la palanca, calculando la relación de las longitudes de los segmentos de la recta
de reparto.
Vídeos explicativos de los diagramas isomórficos binarios:
https://www.youtube.com/watch?v=kTiW3y_vUrQ
https://www.youtube.com/watch?v=x5_33s9UMGM
DIAGRAMAS DE EQUILIBRIO DE ALEACIONES TOTALMENTE SOLUBLES EN
ESTADO LÍQUIDO E INSOLUBLES EN ESTADO SÓLIDO.
De la lectura e interpretación de estos
diagramas, podemos saber los puntos de
fusión y solidificación de cualquier aleación;
determinar la composición de una aleación
para que funda a una temperatura fija; y lo
más importante, saber cuál es la aleación de
punto de fusión más bajo, a la cual
llamaremos eutéctica que en el diagrama
adjunto se corresponde con la vertical e. El
punto E se conoce como eutéctico y en él
coexisten las fases sólidas A y B y la fase
líquida, además la solidificación tiene lugar a
temperatura constante.
Las aleaciones situadas a la izquierda
del punto eutéctico se denominan hipoeutécticas, mientras que aquellas que se
encuentran a la derecha de dicho punto reciben el nombre de hipereutécticas.
Las líneas de solidus y liquidus dividen el diagrama en cuatro campos. Dentro de
cada uno de ellos toda aleación estará formada por las mismas fases.
Cualquier punto de la zona L representa una sola fase, líquida y homogénea de
concentración, de la aleación correspondiente, y más o menos fluida, según esté más o
menos alejada de la línea de liquidus.
En la zona L+A existen dos fases bien definidas: una de líquido y otra de cristales
de aleación A. Veamos qué pasa con una aleación de menor contenido de B que la
aleación eutéctica, por ejemplo, la que representa la línea a – d:
a) En el punto a, todo el líquido es de concentración A – B 70 – 30, que es la de la
aleación.
b) En el punto bL comienzan a formarse los primeros núcleos cristalinos de A. La
concentración de la fase líquida es de 70 – 30, y la correspondiente a los cristalinos, del
punto bS, es A – B 100 – 0.
c) En el punto n se tienen cristales de concentración n S= A – B 100 – 0, y líquido de
concentración nL= A – B 55 – 45. Las cantidades relativas de cada fase se obtienen
aplicando la regla de la palanca, resultando:
nS n C −C n 100−70
L= = nS = 100=66,7 de la fase líquida.
nS n L C nS−C nL 100−55
Javier Alijo Ramas 4
Diagramas de fases
n n L C n−CnL 70−55
S = = = 100=33,3 de la fase sólida.
n S n L C nS−C nL 100−55
d) En el punto d se tienen cristales de concentración d S = A – B 100 – 0, y el resto
será líquido, cuya concentración es la del punto c; es decir, el de la aleación eutéctica
dL = A – B 40 – 60.
d S d C dS−C d 100−70
L= = = 100=50 de la fase líquida.
d S c C dS−C c 100−40
dc C −C c 70−40
S = = d = 100=50 de la fase sólida.
d S c C dS−Cc 100−40
e) A partir del punto d hacia abajo, las aleaciones están formadas por cristales de A,
formados entre bL y d ( cristales primarios de A), y de cristales mixtos de B+A (secundarios
de A). Las concentraciones serán el 30% del total de B y 70% de A, subdividido en 50%
de A primario y 70-50=20 de A secundario.
f) En una aleación eutéctica resulta:
1.- En un punto e dentro del campo L, la aleación se encuentra en estado
líquido y los componentes totalmente disueltos; el porcentaje es el de la aleación
A – B 40 – 60 y hasta el punto c.
2.- Al llegar al punto c comienzan a cristalizar, al mismo tiempo, cristales del
componente A y del componente B, íntimamente mezclados, formando cristales
mixtos de composición total eutéctica.
3.- Por debajo de c no hay cambio alguno.
Las aleaciones eutécticas tienen la gran ventaja de fundir a la más baja temperatura
posible de estas aleaciones; por tanto, son las más idóneas para fabricar piezas
fundidas, por llenar mejor los moldes y ser más homogéneas.
g) Vamos a estudiar, por último, una aleación con mayor contenido de B que las
eutécticas:
1.- En el punto k se tiene líquido homogéneo de concentración igual a la de
aleación.
2.- En d comienza la formación de fase sólida de cristales de componente B, en
contacto con la fase líquida.
3.- En el punto p coexisten dos fases, la líquida y la sólida. La sólida está
formada por cristales puros de B. La líquida, de aleación A – B con
concentración pL = A – B 32,5 – 67,5.
La cantidad relativa de ambas fases se obtiene, como en casos anteriores:
pp S C −C pS 25
L= = p = 100=77 fase líquida.
p L p S C pL−C pS 32,5
ωS =100−77=23 % fase sólida, cristales B.
Javier Alijo Ramas 5
Diagramas de fases
4.- Al llegar a q, la fase líquida tiene una concentración c = A – B 40 – 60, la de la
eutéctica; mientras que la sólida continua siendo de cristales de elemento puro B.
Las cantidades de una y otra son:
qq S Cq−C qS 25
L= = = 100=62,5 fase líquida.
cq S C c−C qS 40
ω S=100−62,5=37,5 % fase sólida, cristales B.
5.- Al llegar a este punto, en que la concentración de la fase líquida es la eutéctica,
toda ella se transforma en fase sólida formada por cristales mixtos del elemento A y
el B, de concentración eutéctica. Así pues, en esta zona se hallan en equilibrio
cristales de B libres y cristales mezclados de A y B. Lo mismo sucede con todas las
aleaciones comprendidas entre la aleación eutéctica y la de 100% de B.
Vídeo explicativo de este tipo de diagramas:
https://www.youtube.com/watch?v=htC6RURWnOY
DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN
ESTADO LÍQUIDO Y PARCIALMENTE SOLUBLES EN ESTADO SÓLIDO
La mayor parte de los metales de uso
industrial presentan alguna solubilidad entre sí al
alearse. Para pequeñas proporciones de uno de
los componentes respecto al otro, hay solubilidad
total y se forman soluciones sólidas que
llamaremos α y β. Por ejemplo: en la aleación Cu
– Ag, el cobre no es capaz de solubilizar más de
un 7.9 % de Ag. Y la plata sólo solubiliza como
máximo un 8,8 % de Cu.
Las aleaciones α y β, son las aleaciones
formadas entre el Cu y la Ag, con las
solubilidades posibles. Pero al aumentar las concentraciones de alguno de los
componentes, ya no hay posibilidad de mezclarse y el caso es similar al de insolubilidad
total. Se consigue una aleación sólida con dos
fases α y β, que no se mezclan entre sí.
En estos sistemas los metales son
solubles pero en pequeña cantidad
(parcialmente solubles). Al solidificar aparecen
soluciones sólidas α y β.
α = solución sólida de B disuelto en A
(mucha cantidad de A y poca de B)
β = solución sólida de A disuelto en B
(mucha cantidad de B y poca de A)
Javier Alijo Ramas 6
Diagramas de fases
A la temperatura eutéctica las fases sólidas que se forman son soluciones α y β.
Se observa en el diagrama que ocurren transformaciones en estado sólido.
El diagrama se divide en seis zonas:
- En la zona L hay una sola fase, líquida y homogénea.
- En la zona L+α hay dos fases, una de líquido y otra de cristales de aleación
sólida α (sólido α con solubilidad parcial)
- En la zona L+β también hay dos fases, una de líquido y otra de cristales de
aleación sólida β (sólido β con solubilidad parcial)
- En la zona α, hay una fase sólida formada por cristales de aleación sólida α.
- En la zona β, hay una fase sólida formada por cristales de aleación sólida β.
- En la zona α+β hay un sólido formado por dos fases α y β, que son soluciones
sólidas con solubilidad parcial.
- En las aleaciones hipoeutécticas,
comienza la solidificación al alcanzar la línea
de liquidus, los cristales que solidifican en la
zona L+α son de sólido α, mientras que el
líquido que queda se va empobreciendo en A.
Al llegar a la temperatura T2 desaparece todo
el líquido y la aleación formada contiene
cristales de α (proeutécticos), más una
estructura compuesta de α+β ( composición
eutéctica ). Es la zona α+(α+β).
Por debajo de la temperatura T2,
disminuye la solubilidad de B en A, por lo que
la solución α pierde cristales de B.
- En aleaciones hipoeutécticass con
pequeñas cantidades de B, todo el sólido está
en forma de α y este sólido no sufre
transformaciones, todo es solución sólida α.
- En la aleación eutéctica sólo hay un punto de solidificación y toda la aleación pasa de
estado líquido a sólido α+β a la temperatura T2. Por debajo de esta temperatura
disminuye la solubilidad de A y B, por lo que la solución α pierde cristales de B y la
solución β pierde cristales de A.
- En las aleaciones hipereutécticas, comienza la solidificación al alcanzar la línea de
liquidus, los cristales que solidifican en la zona L+β son de sólido β, mientras que el
líquido que queda se va empobreciendo en B. Al llegar a la temperatura T2 desaparece
todo el líquido y la aleación formada contiene cristales de β (proeutécticos), más una
estructura compuesta de α+β (composición eutéctica). Es la zona β+(α+β) Por debajo de
la temperatura T2, disminuye la solubilidad de A y B, por lo que la solución α pierde
cristales de B y la solución β pierde cristales de A.
- En aleaciones hipereutécticas,con pequeñas cantidades de A, todo el sólido está en
forma de β y este sólido no sufre transformaciones, todo es solución sólida β.
Para calcular la composición de cada una de las fases se emplea la regla de la
horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca.
Javier Alijo Ramas 7
Diagramas de fases
Ejemplo: Aleación 60% A y 40% B:
- En el punto “a”:
• Numero de fases = 1 (liquido)
• Composición de cada fase: Líquido =60% A - 40 %B
▪ Cantidad o proporción de cada fase: Wlíquido = 100 %
- En el punto “b”:
• Numero de fases = 2 (liquido y sólido α)
• Composición de cada fase: se aplica la regla de la horizontal
Líquido = 50% B y 50% A
Sólido α = 3% B y 97% A
• Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los
segmentos inversos:
- En el punto “c”:
• Numero de fases = 2 (solido α y sólido β)
• Composición de cada fase: se aplica la regla de la horizontal
Sólido α = 5% B y 95% A
Sólido β = 92% B y 8% A
• Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los
segmentos inversos.
Vídeos diagrama de equilibrio en aleaciones totalmente solubles en estado líquido y
parcialmente solubles en estado sólido:
https://www.youtube.com/watch?v=n1z5rvuZUqo
Vídeos diagrama Fe-C:
https://www.youtube.com/watch?v=QvzcOncirMg
https://www.youtube.com/watch?v=CUAobP_DOYk&pbjreload=10
Javier Alijo Ramas 8
Diagramas de fases
GLOSARIO TÉCNICO
Aleación: Mezcla homogénea de dos o más elementos químicos. La aleación posee
carácter metálico y al menos uno de sus componentes debe ser un metal.
Componentes de una aleación: elementos químicos que intervienen en su formación.
Se simbolizan por su símbolo químico o genéricamente con letras mayúsculas: A, B, …
Composición de una aleación: tanto por ciento en peso de sus componentes.
Constituyentes: son los distintos componentes de los granos de una aleación. En
ocasiones los componentes químicos se agregan formando constituyentes definidos. Por
asociación de estos constituyentes se forman los granos de la aleación. Ejemplos son los
constituyentes de los aceros: ferrita, cementita, perlita, etc.
Fase: porción de un sistema material homogéneo con características físicas y químicas
uniformes, separado físicamente. Las fases pueden ser disoluciones líquidas
( simbolizadas como L) o disoluciones sólidas ( simbolizadas con letras griegas: α, β, …)
Sistema isomorfo: diagrama de fases donde sólo existe una fase sólida, esto es, hay
sólo una estructura en estado sólido. Sus componentes son solubles en estado líquido y
en estado sólido.
Líquidus: temperatura a la cual el líquido empieza a solidificar bajo las condiciones de
equilibrio.
Sólidus: temperatura durante la solidificación de una aleación a la cual el final de la fase
líquida solidifica.
Reacción eutéctica: transformación de fases en la cual toda la fase líquida se transforma
por enfriamiento en dos fases sólidas isotérmicamente.
Temperatura eutéctica: temperatura a la que se produce la reacción eutéctica.
Fase proeutéctica: la que se forma a una temperatura por encima de la eutéctica.
Reacción eutectoide: transformación de fases en la cual una fase sólida se transforma
por enfriamiento en dos fases sólidas distintas isotérmicamente.
SOLUCIONES BOLETÍN DIAGRAMAS DE FASES
1.-
a) E: Punto eutéctico.
α: Fase sólida del Cadmio.
β: Fase sólida del Bismuto.
αp : Fase α proeutéctica.
βp : Fase β proeutéctica.
αE+βE : Fases α y β
eutécticas.
b) Tis = 235 ºC;
Tfs = 143,3 ºC;
CL = 56%Cd;
CCd = 100% Cd;
WL =68,18%;
WCd = 31,82%
Javier Alijo Ramas 9
Diagramas de fases
2.- a)
b) Tis= 1398ºC; Tfs=1175ºC; CL= 79% Au; Cα=47% Au; WL=71,88%; Wα=28,12%
3.-
a) 425ºC: Una fase α; Cα= [25% Pb – 75% Mg]
Wα = 100%;
200ºC: Dos fases α+Mg2Pb; Cα= [5% Pb – 95% Mg]; CMg2Pb= [81% Pb – 19% Mg]
Wα =73,7%; WMg2Pb = 26,3%
b) Dos fases β+L; Cβ=[92% Ag – 8%Cu]; CL= [78% Ag – 22% Cu]
WL =50%; Wβ = 50%
c) Dos fases α+β; Cα=[4% Sn – 96%Pb]; Cβ= [100% Sn]
Wα =89%; Wβ = 11%
d) Una fase α; Cα= [8,19% Sn – 91,8% Pb]
Wα = 100%;
e) Dos fases α+L; Cα=[8% Ag – 92%Cu]; CL= [43% Ag – 57% Cu]
Wα =34,9%; WL = 65,1%
Javier Alijo Ramas 10
Diagramas de fases
4.- a) Wαprimaria =59,4%; Wαeutéctica = 65,1%; b) Gráfico de abajo:
5.- Wα(ferrita) =88,8%; WFe3C(Cementita) = 11,2%
6.-
a) Wpα(ferrita proeutectoide) =36,1%; Wγ(austenita) = 63,9%
b) Wα(ferrita proeutectoide + eutectoide) =92,84%;
WFe3C(Cementita) = 7,16%
c) Wpα(ferrita proeutectoide) =36,1%;
Wα(ferrita eutectoide) = 56,74%
d) Los mismos del apartado anterior.
7.-
a) WFe3C(Cementita proeutectoide) =7,25%; Wγ(austenita) = 92,75%
b) WFe3C(Cementita proeutectoide + eutectoide) =17,64%; Wα(ferrita) = 82,36%
c) WFe3C(Cementita proeutectoide) =7,25%; WFe3C(Cementita proeutectoide) = 10,39%
d) Los mismos del apartado anterior.
8.-
a) WFe3C(Cementita eutéctica) = 47,71%; Wγ(austenita) = 52,29%
b) WFe3C(Cementita proeutectoide) =11,82%; WFe3C(Cementita) = 59,53%; Wγ(austenita) = 40,47%
c) WFe3C(Cementita eutectoide) =4,53%; WFe3C(Cementita total) = 64,06%; Wα(ferrita) = 35,94%
9.-
a) % Fe (en peso) = 95,5; % C (en peso) = 4,5
% Fe (en volumen) = 85,69; % C (en volumen) = 14,31
b) Es una fundición hipereutéctica.
c) Vtotal = 0,566 dm³; ρAleación = 7,14 kg/dm3
d) WFe3C(Cementita proeutéctica) = 8,33%; WFe3C(Cementita eutéctica) = 43,74%
WFe3C(Cementita proeutectoide) =7,56%; Wγ(austenita) = 40,37%
10.- Justo por encima del eutectoide habrá: W pα(ferrita proeutectoide) = 36%; Wγ(austenita) = 64%.
En el punto eutectoide la austenita se convierte en ferrita eutectoide más cementita
eutectoide.
Wα(ferrita proeutectoide + eutectoide) =92,84%; WFe3C(Cementita) = 7,16%
Wα(ferrita eutectoide) = 56,74%. Los componentes justo por debajo del eutectoide son ferrita
proeutectoide, ferrita eutectoide más cementita eutectoide.
11.- Consideremos una aleación con 0,022%<%C<0,77% lo que conocemos como acero
hipoeutectoide.
Partiendo de la fase líquida si vamos enfriando esta fase líquida se convertirá en
fase sólida austenita, si seguimos enfriando parte de la austenita se convierte en ferrita,
con lo cual estaremos en una zona bifásica en la que tenemos austenita y ferrita
proeutectoide, debido a que se forma antes de la reacción eutectoide.
Si continuamos enfriando llegamos a la temperatura donde tiene lugar la reacción
eutectoide ( 727 ºC ) en la cual la austenita se transforma en perlita que es: cementita
( Fe3C ) más ferrita eutectoide. Así, nos encontramos en una región bifásica en la que
tenemos ferrita proeutectoide y perlita ( cementita más ferrita eutectoide ).
Javier Alijo Ramas 11
Diagramas de fases
12.- a)
Javier Alijo Ramas 12
Diagramas de fases
b) Wγ(austenita) = 98,96%; WFe3C(Cementita proeutectoide) =1,04%; Wα(ferrita eutectoide) = 85,76%
WFe3C(Cementita total) = 14,24%; WFe3C(Cementita eutectoide) =13,2%
13.-
a) Δt = 75 ºC
b) C = 63% Sn – 37% Pb; Aleación eutéctica. Tª constante e igual a 175 ºC.
c) Tª = 150 ºC: Dos fases α+β; Cα=[11% Sn – 89%Pb]; Cβ= [99% Sn – 1% Pb]
Wα = 72,73 %; Wβ = 27,27%
Tª = 150 ºC: Dos fases α+L; Cα=[12% Sn – 88%Pb]; CL= [39% Sn – 61% Pb]
Wα = 14,81 %; WL = 85,19%
14.-
a) V = 6,74∙10-29 m³
b) n.º de átomos = 4. Factor de empaquetamiento = 74,23 %.
c) Tiene los siguientes huecos:
Octaédricos: 4
Tetraédricos: 8
d) ρAg = 10,63 g/cm 3
Javier Alijo Ramas 13
También podría gustarte
- Exposicion Diagramas de FaseDocumento6 páginasExposicion Diagramas de FaseGustavo A. Sarache MillanAún no hay calificaciones
- PROBLEMAS MetafisicaDocumento13 páginasPROBLEMAS MetafisicaCarlos V. AlfredoAún no hay calificaciones
- 8C Transformaciones de FasesDocumento38 páginas8C Transformaciones de FasesDyllan BastidasAún no hay calificaciones
- Ejer-Diagr Fases (Resuelto)Documento11 páginasEjer-Diagr Fases (Resuelto)Samantha TabaniAún no hay calificaciones
- Clase 1 Diagrama de Fases Binario. Tipo 1.Documento5 páginasClase 1 Diagrama de Fases Binario. Tipo 1.Ricardo SorondoAún no hay calificaciones
- Diagrama de Fases - Clase Oficial PDFDocumento83 páginasDiagrama de Fases - Clase Oficial PDFWilliam ArévaloAún no hay calificaciones
- Taller MaterialesDocumento18 páginasTaller MaterialesJuan Diego BohrquezAún no hay calificaciones
- Diagrama de Equilibrio Clase 9Documento23 páginasDiagrama de Equilibrio Clase 9mary vilcatomaAún no hay calificaciones
- Metalurgia 4 I y II Tipo de AleacionesDocumento10 páginasMetalurgia 4 I y II Tipo de AleacionesHugo Castillo AguilarAún no hay calificaciones
- Problemas de Equilibrio de Fases de Sistemas MulticomponentesDocumento10 páginasProblemas de Equilibrio de Fases de Sistemas Multicomponentescalloze88% (8)
- CLase 10-Diagramas de Fase Parte IIDocumento50 páginasCLase 10-Diagramas de Fase Parte IIjosselynraAún no hay calificaciones
- Problemas Aleaciones Clase 3Documento8 páginasProblemas Aleaciones Clase 3Albert CarrizalesAún no hay calificaciones
- Diagramas de Fase TernariosDocumento35 páginasDiagramas de Fase Ternariosfoxtrot1138100% (2)
- Aleaciones Diagrama de FasesDocumento42 páginasAleaciones Diagrama de FasesMuñoz GabrielAún no hay calificaciones
- Diagrama de Fases o Diagrama de Equilibrio 1 PDFDocumento16 páginasDiagrama de Fases o Diagrama de Equilibrio 1 PDFSylvia RodriguezAún no hay calificaciones
- Diagrama de Fases BinariosDocumento6 páginasDiagrama de Fases BinariosTeresa MantillaAún no hay calificaciones
- Ejercicios de Metalurgia Fisica IIDocumento7 páginasEjercicios de Metalurgia Fisica IIGelbert Pedro Alzamora ValleAún no hay calificaciones
- Regla de La PalancaDocumento10 páginasRegla de La PalancaCarlos RodriguezAún no hay calificaciones
- Serie 3 MateDocumento6 páginasSerie 3 MateLiz FernandoAún no hay calificaciones
- Fases de Transformaciones de Los MetalesDocumento25 páginasFases de Transformaciones de Los MetalesbryanAún no hay calificaciones
- Ejercicios Resueltos Diagrama de Fases COBREDocumento11 páginasEjercicios Resueltos Diagrama de Fases COBREDavid Zarate MansillaAún no hay calificaciones
- Diagramas de Fases Ing. MecanicaDocumento113 páginasDiagramas de Fases Ing. MecanicaFabricio BCAún no hay calificaciones
- Diagramas Ternarios y MulticomponentesDocumento18 páginasDiagramas Ternarios y MulticomponentesBart FrienderAún no hay calificaciones
- Fases BinariasDocumento5 páginasFases BinariasAnthony Paolo Montero VattuoneAún no hay calificaciones
- Aplicación Regla de Palanca y de La Composición de Las FasesDocumento6 páginasAplicación Regla de Palanca y de La Composición de Las FasesPaula Pineda de NavasAún no hay calificaciones
- Ejercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDocumento20 páginasEjercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDaniel Gomariz63% (8)
- Ejercicios Resueltos Diagrama de FasesDocumento20 páginasEjercicios Resueltos Diagrama de FasesJose Efren Rojas Almanza100% (1)
- Ejercicios Tema 2Documento26 páginasEjercicios Tema 2Alberto López Espínola100% (1)
- Problema 5Documento15 páginasProblema 5David CaalAún no hay calificaciones
- Ejercicios Resueltos Diagrama de FasesDocumento20 páginasEjercicios Resueltos Diagrama de FasesMarcelo OtoAún no hay calificaciones
- Ejercicios de diagramas de fases resueltosDocumento4 páginasEjercicios de diagramas de fases resueltosPaolaAún no hay calificaciones
- Labotatorio de Problemas de Quimica Fisica IiDocumento4 páginasLabotatorio de Problemas de Quimica Fisica IiAndrea JimenezAún no hay calificaciones
- EjerciciosresueltosdiagramadefasesDocumento23 páginasEjerciciosresueltosdiagramadefasesSergio QCAún no hay calificaciones
- Diagramas ternarios de fase en ingeniería mecánicaDocumento31 páginasDiagramas ternarios de fase en ingeniería mecánicaAirton Cuatrini Papavero100% (2)
- Unidad 3-Ejercicios Diag de FasesDocumento21 páginasUnidad 3-Ejercicios Diag de FasesRamsés Pilco ZavalaAún no hay calificaciones
- Diagrama de Fases3Documento14 páginasDiagrama de Fases3MaryjanemjeAún no hay calificaciones
- Tratamientos TérmicosDocumento33 páginasTratamientos TérmicosReyser TarquiAún no hay calificaciones
- Ejercicios de Teoria de Las Aleaciones.Documento16 páginasEjercicios de Teoria de Las Aleaciones.Eidan Enrique RodriguezAún no hay calificaciones
- EJERCICIOSDocumento6 páginasEJERCICIOSJoel NoriegaAún no hay calificaciones
- Materiales 1 UNCDocumento8 páginasMateriales 1 UNCSimon ReyesAún no hay calificaciones
- DIAGRAMAS DE FASES T-X Y P-XDocumento14 páginasDIAGRAMAS DE FASES T-X Y P-XChäz XdAún no hay calificaciones
- Guia Solido Liquido FDocumento5 páginasGuia Solido Liquido FAndres ColoccioniAún no hay calificaciones
- Grados libertad aleaciónDocumento9 páginasGrados libertad aleaciónArturo CollazosAún no hay calificaciones
- QF KJGHFJHFJDocumento6 páginasQF KJGHFJHFJKevinBcAún no hay calificaciones
- DIAGRAMA DE FASES Cobre-NiquelDocumento2 páginasDIAGRAMA DE FASES Cobre-NiquelangiesualraAún no hay calificaciones
- Sistema Isomorfo Binario y Regla de la PalancaDocumento3 páginasSistema Isomorfo Binario y Regla de la PalancaCarlos Abraham Paniahua Pérez100% (1)
- Regla de La PalancaDocumento8 páginasRegla de La PalancaFrancisco Javier CanoAún no hay calificaciones
- Diagrama de FasesDocumento32 páginasDiagrama de FaseslilisacasAún no hay calificaciones
- Unidad IV Diagramas de FaseDocumento23 páginasUnidad IV Diagramas de FaseJesus Santiago PabloAún no hay calificaciones
- Diagrama de FasesDocumento16 páginasDiagrama de FasesMiriam Cantón Reyes100% (1)
- Ejerciciosi Resueltos Diagrama de FasesDocumento21 páginasEjerciciosi Resueltos Diagrama de FasesBrian EchevarriaAún no hay calificaciones
- Ejercicios Resueltos Diagrama de Fases IES ValdehierroDocumento21 páginasEjercicios Resueltos Diagrama de Fases IES ValdehierroAnaAún no hay calificaciones
- T6 Fichas de TrabajoDocumento7 páginasT6 Fichas de TrabajoTherion Zoe Gil JuárezAún no hay calificaciones
- Ensayo Sobre Valores en La EducaciónDocumento2 páginasEnsayo Sobre Valores en La EducaciónHílder Inocencio Espinoza100% (1)
- Cubiertas o Losas de EntrepisoDocumento18 páginasCubiertas o Losas de EntrepisowalterAún no hay calificaciones
- Resumen Ejecutivo Areas VerdesDocumento21 páginasResumen Ejecutivo Areas VerdesDani Innocenti OlmosAún no hay calificaciones
- Reglamento de Organización y Funciones Municipalidad La BreaDocumento117 páginasReglamento de Organización y Funciones Municipalidad La BreaLuis Alberto Perez AlfaroAún no hay calificaciones
- 2.1 El Lenguaje y La Semiologia GraficaDocumento77 páginas2.1 El Lenguaje y La Semiologia GraficaRodrigo MartinezAún no hay calificaciones
- T2 - Tipologia de Actores (Presentación y Clasificación de Actores)Documento21 páginasT2 - Tipologia de Actores (Presentación y Clasificación de Actores)Daniel ZugastiAún no hay calificaciones
- Inspección equipos trabajo alturaDocumento3 páginasInspección equipos trabajo alturacamilo rodriguezAún no hay calificaciones
- Cuerpo Rigido WORDDocumento40 páginasCuerpo Rigido WORDJuan RojasAún no hay calificaciones
- Chimborazo MeryDocumento182 páginasChimborazo Meryjoffre azogueAún no hay calificaciones
- Guia Cadenas TroficasDocumento3 páginasGuia Cadenas TroficasNidia Espinosa OjedaAún no hay calificaciones
- Total de MaquinasçDocumento7 páginasTotal de MaquinasçGrober PumaAún no hay calificaciones
- Taller HidroituangoDocumento5 páginasTaller HidroituangoJhonatan LeonAún no hay calificaciones
- Z 3x1+x2 - MAX S.A. 3x1+2x2 0 x1, x2 Son EnterosDocumento3 páginasZ 3x1+x2 - MAX S.A. 3x1+2x2 0 x1, x2 Son EnterosLuis Pablo Capestany AlmarazAún no hay calificaciones
- S6 - Dip - 2021 - T3.2 - MD - Simbolos de Flujograma PDFDocumento1 páginaS6 - Dip - 2021 - T3.2 - MD - Simbolos de Flujograma PDFKevin GuzmanAún no hay calificaciones
- BioGenFarm2023Documento106 páginasBioGenFarm2023josé ledesmaAún no hay calificaciones
- Material de Apoyo Revisado para Realizar Un Trabajo MonográficoDocumento4 páginasMaterial de Apoyo Revisado para Realizar Un Trabajo MonográficoJose Ricardo PachecoAún no hay calificaciones
- Unidad Viii Carros Aguateros e ImprimadoresDocumento27 páginasUnidad Viii Carros Aguateros e Imprimadoresvideos uajmsAún no hay calificaciones
- Sem Investigacion Semana 10 2021-2 (Marisol)Documento20 páginasSem Investigacion Semana 10 2021-2 (Marisol)JOSHUA O BRYAN HURTADO VIVARAún no hay calificaciones
- Tarea N°1 A.C. IIDocumento3 páginasTarea N°1 A.C. IIAndres GomezAún no hay calificaciones
- Plan Clase TRDocumento7 páginasPlan Clase TRMarcelo VilemaAún no hay calificaciones
- El Clima Urbano y La Isla Termica, 2007Documento18 páginasEl Clima Urbano y La Isla Termica, 2007Miguel Ignacio ValeroAún no hay calificaciones
- Científicos miden el efecto umbral y apoyan un modelo de eventos de memoria humanaDocumento2 páginasCientíficos miden el efecto umbral y apoyan un modelo de eventos de memoria humanaCamilo churioAún no hay calificaciones
- Optimización y Control Del Proceso de Fritura PDFDocumento53 páginasOptimización y Control Del Proceso de Fritura PDFANA LUZ MAMANI QUISPEAún no hay calificaciones
- Vecto4 - 1.2.10 Momento Independiente Actividad IntegradoraDocumento2 páginasVecto4 - 1.2.10 Momento Independiente Actividad IntegradoraArgelio Arias SanchezAún no hay calificaciones
- ESPECIACIÓN (Autoguardado)Documento39 páginasESPECIACIÓN (Autoguardado)DEISY PALACIOSAún no hay calificaciones
- Estudio de Factibilidad Planta PVC para RefiDocumento204 páginasEstudio de Factibilidad Planta PVC para RefijosealvaroAún no hay calificaciones
- Evaluación y reflexión de las actividades implementadas en la IEDocumento12 páginasEvaluación y reflexión de las actividades implementadas en la IETeresa Sanchez SolanoAún no hay calificaciones
- Observación de células vegetales en catáfila de cebollaDocumento2 páginasObservación de células vegetales en catáfila de cebollaGerald ChalanAún no hay calificaciones
- Sistema Reticular y LímbicoDocumento1 páginaSistema Reticular y LímbicoandreaAún no hay calificaciones