0% encontró este documento útil (0 votos)
933 vistas6 páginasSerie 3 Mate
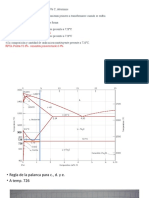
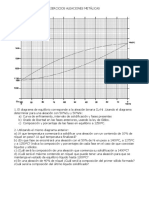
Este documento contiene información sobre diagramas de fases de aleaciones binarias. Explica cómo construir un diagrama de equilibrio a partir de datos de temperaturas de liquidus y solidus para diferentes composiciones. También describe las características clave de estos diagramas como las líneas de liquidus y solidus, y las zonas de una y dos fases. Por último, muestra cómo trazar curvas de enfriamiento a partir del diagrama de equilibrio.
Cargado por
Liz FernandoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
933 vistas6 páginasSerie 3 Mate
Este documento contiene información sobre diagramas de fases de aleaciones binarias. Explica cómo construir un diagrama de equilibrio a partir de datos de temperaturas de liquidus y solidus para diferentes composiciones. También describe las características clave de estos diagramas como las líneas de liquidus y solidus, y las zonas de una y dos fases. Por último, muestra cómo trazar curvas de enfriamiento a partir del diagrama de equilibrio.
Cargado por
Liz FernandoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd