0% encontró este documento útil (0 votos)
378 vistas7 páginasModelos Pseudo-Homogéneos en Reactores Químicos
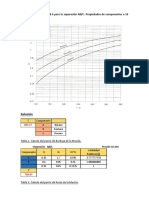
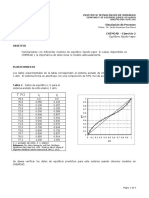
Este documento presenta 5 problemas relacionados con la modelación de reactores de lecho fijo. El primer problema pide describir las etapas elementales y evaluar constantes cinéticas para la reacción de Deacon. El segundo problema pide resolver analíticamente la ecuación de Ergun. El tercer problema compara la caída de presión para dos tipos de catalizadores. El cuarto problema calcula la conversión para una reacción en un reactor isotérmico. El quinto problema modela la oxidación catalítica del SO2 en un convertidor de varias camas.
Cargado por
Gab ArllenDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
378 vistas7 páginasModelos Pseudo-Homogéneos en Reactores Químicos
Este documento presenta 5 problemas relacionados con la modelación de reactores de lecho fijo. El primer problema pide describir las etapas elementales y evaluar constantes cinéticas para la reacción de Deacon. El segundo problema pide resolver analíticamente la ecuación de Ergun. El tercer problema compara la caída de presión para dos tipos de catalizadores. El cuarto problema calcula la conversión para una reacción en un reactor isotérmico. El quinto problema modela la oxidación catalítica del SO2 en un convertidor de varias camas.
Cargado por
Gab ArllenDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd