Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica 3 Laboratorio de Quimica General
Cargado por
Padilla Perea Violet ZoeTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica 3 Laboratorio de Quimica General
Cargado por
Padilla Perea Violet ZoeCopyright:
Formatos disponibles
lOMoARcPSD|21122867
Practica 3.- Laboratorio de química general
Química General (Instituto Politécnico Nacional)
Studocu is not sponsored or endorsed by any college or university
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
INSTITUTO POLITÉCNICO
NACIONAL
ESCUELA SUPERIOR DE
INGENIERÍA QUÍMICA E INDUSTRIAS EXTRACTIVAS
DEPARTAMENTO DE FORMACIÓN BÁSICA
ACADEMIA DE QUÍMICA
LABORATORIO DE QUÍMICA GENERAL
SESIÓN 3.- NOMENCLATURA
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
INSTITUTO POLITÉCNICO NACIONAL
ESCUELA SUPERIOR DE INGENIERÍA QUÍMICA E INDUSTRIAS
EXTRACTIVAS
DEPARTAMENTO DE FORMACIÓN BÁSICA
ACADEMIA DE QUÍMICA
LABORATORIO DE QUÍMICA GENERAL
Sesión No. 3 “NOMENCLATURA”
OBJETIVO GENERAL
• Captar la necesidad de aprender Nomenclatura Química, como una realidad
derivada de nombrar correctamente a las especies químicas y comprender la
necesidad de establecer y aceptar Normas Internacionales de Nomenclatura
(IUPAC), captando la dificultad que entraña dicho problema en el caso de ser unas
normas totalmente generales.
OBJETIVOS ESPECÍFICOS
• Conceptual: que los estudiantes logren interpretar y manejar conceptos elementales
de Química y el lenguaje propio de la disciplina, imprescindibles para la continuidad
de los aprendizajes de la misma.
• Procedimental: dotar a los estudiantes de herramientas para que estén en
condiciones de formular y nombrar correctamente cualquier sustancia inorgánica,
así como llevar a cabo la clasificación, identificación y representación de las
reacciones químicas
• Actitudinal: lograr una buena disposición hacia la incorporación de nuevos
conocimientos, actitud crítica y compromiso como estudiante en su propia formación
profesional.
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
INTRODUCCIÓN
Denominamos nomenclatura química a un sistema de reglas que permite dar
nombre a los diferentes compuestos químicos según el tipo y número de elementos que los
componen. La nomenclatura permite identificar, clasificar y organizar los compuestos
químicos. Su propósito es asignar a las sustancias químicas nombres y fórmulas, de
manera que sean fácilmente reconocibles y se pueda consolidar una convención.
Dentro de la nomenclatura química, se distinguen dos grandes grupos de
compuestos:
• Compuestos orgánicos, referidos a aquellos con presencia de carbono enlazado con
moléculas de hidrógeno, oxígeno, azufre, nitrógeno, boro y ciertos halógenos;
• Compuestos inorgánicos, que se refieren a todo el universo de compuestos
químicos que no incluyen moléculas de carbono.
La principal institución encargada de regular o establecer las convenciones es la Unión
Internacional de Química Pura y Aplicada o IUPAC por sus siglas en inglés (International
Union of Pure and Applied Chemistry).
La necesidad de un sistema general en la nomenclatura química, se hizo sentir de
manera muy notoria cuando el número de sustancias conocidas fue en aumento, así como
también las personas que trabajaban con ellas en las diferentes partes del mundo; de no
lograrse, era prácticamente imposible el entendimiento y el intercambio de conocimientos.
Bien podría darse el caso de personas hablando de un mismo compuesto, pero con distintos
nombres y por ello dar la sensación de referirse a algo diferente.
La nomenclatura ha logrado avances muy significativos, sin embargo, se puede apreciar
lo fuerte de las costumbres, con lo que se vuelve muy difícil erradicar algunos nombres
triviales que han debido ser aceptados. Por ejemplo, el Hidróxido de cobre (II), Hidróxido
cúprico; nombres que corresponden a la fórmula Cu(OH)2, ¿Dos nombres para una misma
fórmula? Ambos son aceptados; con cualquiera de los nombres se caracteriza al compuesto
por lo tanto puede considerarse como apropiado; este ejemplo puede servirnos para
mencionar el hecho de que bien podemos aceptar dos o más nombres para una misma
fórmula, pero jamás dos fórmulas corresponden a un mismo nombre.
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
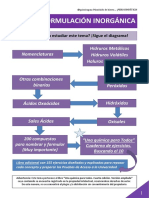
ACTIVIDAD PREVIA
1. Realizar una investigación bibliográfica sobre la nomenclatura de los siguientes
grupos funcionales: Hidruros, óxidos metálicos y no metálicos, hidróxidos, ácidos
hidrácidos y oxiácidos, sales binarias y oxisales.
HIDRUROS
Los hidruros son compuestos formados por átomos de hidrógenos y otro elemento químico,
metales o no metales.
• Hidruros metálicos
Los hidruros metálicos son combinaciones del hidrógeno con un metal, en donde el
hidrógeno actúa con valencia -1 y los metales actúan con valencia positiva. La fórmula de
los hidruros es del tipo: MHn Donde M es el elemento metálico y n es la valencia del
elemento metálico.
Nomenclatura tradicional: se nombra con la palabra hidruro seguido del elemento
metálico.
Número de Sufijos y prefijos Número de Sufijos y prefijos
valencias valencias
Una valencia Hidruro… -ico Tres valencias Hidruro… Hipo-… -oso
Dos valencias Hidruro… -oso Hidruro… -oso
Hidruro… -ico -ico
Cuatro Hidruro…Hipo-… -oso
Ejemplo: valencias Hidruro… -oso
NaH→ Hidruro sódico Hidruro… -ico
NiH2 → Hidruro de niqueloso Hidruro… Per-… -ico
Nomenclatura de stock: se realiza indicando el número de valencia del elemento metálico
entre paréntesis y en números romanos, precedido por la expresión “hidruro de” + elemento
metálico (NR).
*No es necesario indicar la valencia de aquellos elementos metálicos que sólo actúan con
una.
Ejemplo:
NaH → Hidruro de sodio
NiH2 → Hidruro de Níquel (II)
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
Nomenclatura sistemática: se indica mediante un prefijo el número de átomos de cada
elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono Ejemplo:
2 átomos: Di NaH → MonoHidruro de sodio
3 átomos: Tri NiH2 → DiHidruro de Níquel
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
• Hidruros no metálicos
Se trata de aquellos compuestos en los que el hidrógeno se combina con un elemento
más electronegativo que él. En este caso la valencia del hidrógeno es +1.
De este modo, dentro de este tipo de hidruros en donde el hidrógeno queda unido a
un no metal tenemos por un lado los denominados hidruros volátiles. Estos están generados
por la combinación del hidrógeno con elementos tales como: N, P, As, Sb, C, Si y B. Estos
hidruros se suelen denominar mediante nomenclatura tradicional.
Por otro lado, tenemos los hidruros constituidos por el hidrógeno unido a algún
halógeno o con anfígeno (menos el O), en este caso este tipo de hidruros de denominan
hidrácidos (debido a su carácter ácido). En este tipo de compuestos los halógenos actúan
con valencia -1 y los anfígenos con valencia -2.
Estos compuestos no se nombran mediante nomenclatura de stock.
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
OXIDOS METÁLICOS
Los óxidos metálicos están formados por un elemento metálico más oxígeno. Se trata de
compuestos binarios cuya fórmula M2On (donde M es el elemento metálico y O es oxígeno).
En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte
electronegativa del compuesto y se denominaría “óxido”. La lectura de los compuestos se
realiza nombrando el óxido seguido del elemento que le precede.
Nomenclatura tradicional: se nombra con la palabra óxido seguida del elemento metálico
(teniendo en cuenta la valencia del elemento metálico).
Número de Sufijos y prefijos Número de Sufijos y prefijos
valencias valencias
Una valencia Óxido… -ico Tres valencias Óxido … Hipo-… -oso
Dos valencias Óxido … -oso Óxido …-oso
Óxido… -ico Óxido …-ico
Cuatro Óxido …Hipo-… -oso
valencias Óxido … -oso
Óxido … -ico
Óxido … Per-… -ico
* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación.
Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no
incluirlos.
Nomenclatura de stock: indicando el estado de oxidación del elemento metálico en
número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» +
elemento metálico.
*No es necesario indicar la valencia de aquellos elementos metálicos que sólo actúan con
una.
Nomenclatura sistemática: se indica mediante un prefijo el número de átomos de cada
elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
OXIDOS NO METÁLICOS
Los anhídridos son compuestos formados por un elemento no metálico más
oxígeno. La fórmula de los anhídridos es del tipo NM2On (donde NM es un elemento no
metálico y O es oxígeno). En estos compuestos el oxígeno también presenta un estado de
oxidación -2.
Nomenclatura tradicional: se nombra con la palabra anhídrido seguida del elemento
metálico (teniendo en cuenta la valencia del elemento metálico).
Número de Sufijos y prefijos Número de Sufijos y prefijos
valencias valencias
Una valencia Anhídrido… -ico Tres valencias Anhídrido … Hipo-… -oso
Dos valencias Anhídrido … -oso Anhídrido …-oso
Anhídrido … -ico Anhídrido …-ico
Cuatro Anhídrido …Hipo-… -oso
valencias Anhídrido … -oso
Anhídrido … -ico
Anhídrido … Per-… -ico
Nomenclatura de stock: indicando el estado de oxidación del elemento metálico en
número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» +
elemento metálico.
Nomenclatura sistemática: se indica mediante un prefijo el número de átomos de cada
elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
HIDRÓXIDOS
Los hidróxidos son compuestos constituidos por un elemento metálico (o grupo
catiónico) y el grupo hidróxido (o anión OH–). La fórmula general de los hidróxidos es del
tipo: M(OH)n
Siendo M cualquier elemento metálico o grupo catiónico. El OH- es un anión
poliatómico cuya carga global es de -1.
Nomenclatura tradicional: esta nomenclatura comienza con la palabra hidróxido
seguido del elemento, siempre teniendo en cuenta la valencia con la que actúa.
Número de Sufijos y prefijos Número de Sufijos y prefijos
valencias valencias
Una valencia Hidróxido… -ico Tres valencias Hidróxido … Hipo-… -oso
Dos valencias Hidróxido … -oso Hidróxido …-oso
Hidróxido … -ico Hidróxido …-ico
Cuatro Hidróxido …Hipo-… -oso
valencias Hidróxido … -oso
Hidróxido … -ico
Hidróxido … Per-… -ico
Nomenclatura de stock: en esta nomenclatura se comienza con la palabra hidróxido
seguido del elemento metálico, en donde la valencia del mismo se expresará en números
romanos y entre paréntesis.
Nomenclatura sistemática: se anteponen los prefijos numéricos a la palabra hidróxido.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri
4 átomos: Tetra
5 átomos: Penta
6 átomos: Hexa
7 átomos: Hepta
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
ÁCIDOS HIDRÁCIDOS
Los ácidos hidrácidos son compuestos binarios (contienen dos elementos) que se
forman al reaccionar un no metal con el hidrógeno, de acuerdo a la siguiente reacción:
H2 + No metal → Hidrácido
Formula General: HxN
N: No metal
x: Valencia del no metal. (su menor valencia)
Nomenclatura tradicional: esta nomenclatura comienza con la palabra Ácido seguido de
la raíz griega del nombre del no metal + hídrico
Nomenclatura Stock: en esta nomenclatura se comienza con el nombre del anión seguido
de “de hidrógeno”, en donde la valencia del mismo se expresará en números romanos y
entre paréntesis.
OXIÁCIDOS
Los ácidos oxácidos son compuestos ternarios que se forman cuando se hace
reaccionar un óxido ácido con agua, según la siguiente ecuación química:
Óxido ácido + H2O → Ácido Oxácido
Formula General: HaNbOc
H: Hidrógeno
N: No metal
O: Oxígeno
Para nombrar estos compuestos usaremos la nomenclatura tradicional, que es la más
común para nombrar los ácidos oxácidos
Nomenclatura tradicional
Ácido (Hipo, Per) Nombre del anión (OSO, ICO)
Es importante resaltar que la terminación “ato o ito” del nombre del anión debe ser
reemplazado por “ico u oso”, tal como se muestra en los siguientes ejemplos:
Fórmula del compuesto Anión Nombre del ácido
(fórmula y nombre)
H2SO4 SO4 -2 : Sulfato Ácido Sulfúrico
HClO2 ClO2 - : Clorito Ácido Cloroso
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
SALES BINARIAS
Metal + No Metal
Estos compuestos se pueden considerar como derivados de los hidrácidos
(contenido que podemos obtener el apartado dedicado a hidruros), en los cuales el
hidrógeno ha sido sustituido por un elemento metálico. Este tipo de compuestos se
denomina también sales neutras.
La formulación sigue modelo: MaNb
Donde:
• M: elemento metálico.
• N: elemento no metálico.
• a: valencia del elemento no metálico.
• b: valencia del elemento metálico.
Hay que tener en cuenta que los elementos no metálicos tendrán las siguientes
valencias:
Nomenclatura tradicional: Se realiza nombrando el elemento no metálico terminado en –
uro seguido del elemento metálico. Se debe de tener en cuenta la valencia del elemento
metálico.
Número de Sufijos y prefijos Número de Sufijos y prefijos
valencias valencias
Una valencia …-uro … -ico Tres valencias …-uro … Hipo-… -oso
Dos valencias …-uro … -oso …-uro …-oso
…-uro … -ico …-uro …-ico
Cuatro …-uro …Hipo-… -oso
valencias …-uro … -oso
…-uro … -ico
…-uro … Per-… -ico
Nomenclatura de stock: Se realiza indicando el número de valencia del elemento metálico
entre paréntesis y en números romanos, precedido por la expresión “…-uro de” + elemento
metálico. No es necesario indicar la valencia de aquellos elementos metálicos que sólo
actúan con una.
Nomenclatura sistemática: Se indica mediante un prefijo el número de átomos de cada
elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
1 átomo: Mono
2 átomos: Di
3 átomos: Tri …
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
OXISALES
Las oxosales u oxisales son el producto derivado de la substitución de los hidrógenos de
los oxoácidos por metales o grupos catiónicos.
Nomenclatura tradicional: Se nombran de manera similar a los oxoácidos, salvo por el
hecho de que las terminaciones varían según sean:
Nomenclatura de stock: se nombra de forma similar a la nomenclatura tradicional seguido
del elemento metálico indicando entre paréntesis la valencia con la que actúa en números
romanos.
Nomenclatura sistemática: se nombra con el nombre del anión seguido por el nombre del
catión y seguido por el prefijo que indica el número de átomos del elemento metálico. Forma
similar a como se formulaban las oxosales.
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
BIBLIOGRAFÍA
• "Nomenclatura química". En: Significados.com. Disponible en:
https://www.significados.com/nomenclatura-quimica/ Consultado: 14 de septiembre
de 2021
• GUIA DE ESTUDIO DEL PROPEDÉUTICO DE QUÍMICA. (s. f.). Recuperado 15 de
septiembre de 2021, de
http://www.ucv.ve/fileadmin/user_upload/facultad_agronomia/Propedeutico/2014/G
uIa_de_Estudio_PropedEutico_QuImica.pdf
• Hidróxidos | Formulación inorgánica. (2020, 29 marzo). Recuperado 15 de
septiembre de 2021, de https://yosoytuprofe.20minutos.es/2016/11/22/formulacion-
inorganica-hidroxidos/
• Hidruros | Formulación inorgánica. (2020, 29 marzo). Recuperado 15 de septiembre
de 2021, de https://yosoytuprofe.20minutos.es/2016/11/09/formulacion-inorganica-
hidruros/
• Óxidos y anhídridos | Formulación inorgánica. (2020, 29 marzo). Recuperado 15 de
septiembre de 2021, de https://yosoytuprofe.20minutos.es/2016/10/26/formulacion-
inorganica-oxidos-y-anhidridos/
• Sales binarias | Formulación inorgánica. (2020, 29 marzo). Recuperado 15 de
septiembre de 2021, de https://yosoytuprofe.20minutos.es/2016/11/18/formulacion-
inorganica-sales-binarias/
• Oxosales | Formulación inorgánica. (2018, 13 agosto). Recuperado 15 de
septiembre de 2021, de https://yosoytuprofe.20minutos.es/2016/12/14/formulacion-
inorganica-oxosales/
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
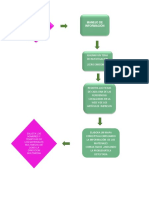
DIAGRAMAS DE BLOQUES
Actividad 1
El profesor hará una exposición magistral de Reglas Generales de Nomenclatura
Actividad 2.-
Profesor hace entrega
En la hoja enmicada Sobre esa gota agregar
de hoja enmicada y kid
agregar gota de una gota de cada catión
de aniones y cationes
cada anión
Actividad 3.-
1.-
Tomar un pedacito de Colocarlo en el Retirarlo hasta que
cinta de magnesio con mechero adquiera color rojo
las pinzas
2.-
Colocar el residuo en Adiciona 5 mL de Adiciona 5 gotas Observa si existe
un vaso de agua destilada de fenolftaleina cambio de color
precipitado de 10 mL
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
3.-
En el tubo de ensayo Agrega dos o tres gotas Agrega dos o tres gotas
coloca 3 mL de agua de solución de ácido de permanganato de
oxigenada sulfúrico potasio
Observa los cambios
que ocurre
4.
Coloca en un tubo de Agregar 0.5 mL de Observar
ensaye 0.5 g de Zn ácido clorhídrico
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
BITÁCORA
Escribir la fórmula y el nombre de los compuestos que resultan de la
experimentación en la actividad 1
Pb2+ Ag+
Pb(OH)2 Ag(OH)
Stock: Hidróxido de plomo (II) Stock: Hidróxido de plata
OH-
Tradicional: Hidróxido plumboso Tradicional: Hidróxido argéntico
Color obtenido: Blanco Color obtenido: Marrón
PbCl2 AgCl
Stock: Cloruro de plomo (II) Stock: Cloruro de plata
Cl-
Tradicional: Cloruro plumboso Tradicional: Cloruro argéntico
Color obtenido: Incoloro Color obtenido: Blanco
PbI2 AgI
Stock: Yoduro de plomo (II) Stock: Yoduro de plata
I-
Tradicional: Yoduro plumboso Tradicional: Yoduro argéntico
Color obtenido: Naranja Color obtenido: Blanco
Pb2S2 Ag2S
Stock: Sulfuro de plomo (II) Stock: Sulfuro de plata
S2-
Tradicional: Sulfuro plumboso Tradicional: Sulfuro argéntico
Color obtenido: Blanco Color obtenido: Marrón
Pb2(CrO4)2 Ag2(CrO4)
Stock: Cromato de plomo (II) Stock: Cromato de plata
CrO42-
Tradicional: Cromato plumboso Tradicional: Cromato argéntico
Color obtenido: Amarillo Color obtenido: Marrón rojizo
Pb2(SO4)2 Ag2(SO4)
Stock: Sulfato de plomo (II) Stock: Sulfato de plata
SO42-
Tradicional: Sulfato plumboso Tradicional: Sulfato argéntico
Color obtenido: Incoloro Color obtenido: Incoloro
Pb(SCN)2 Ag(SCN)
Stock: Tiocianato de plomo (II) Stock: Tiocianato de plata
SCN-
Tradicional: Tiocianato plumboso Tradicional: Tiocianato argéntico
Color obtenido: Incoloro Color obtenido: Incoloro
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
Hg2+ Cu2+
Hg(OH)2 Cu(OH)2
Stock: Hidróxido de mercurio (II) Stock: Hidróxido de cobre (II)
OH-
Tradicional: Hidróxido mercúrico Tradicional: Hidróxido cúprico
Color obtenido: Naranja/Amarillo Color obtenido: Azul bajo
HgCl2 CuCl2
Stock: Cloruro de mercurio (II) Stock: Cloruro de cobre (II)
Cl-
Tradicional: Cloruro mercúrico Tradicional: Cloruro cúprico
Color obtenido: Incoloro Color obtenido: Incoloro
HgI2 CuI2
Stock: Yoduro de mercurio (II) Stock: Yoduro de cobre (II)
I-
Tradicional: Yoduro mercúrico Tradicional: Yoduro cúprico
Color obtenido: Fucsia Color obtenido: amarillo
Hg2S2 Cu2S2
Stock: Sulfuro de mercurio (II) Stock: Sulfuro de cobre (II)
S2-
Tradicional: Sulfuro mercúrico Tradicional: Sulfuro cúprico
Color obtenido: Amarillo Color obtenido: Azul
Hg2(CrO4)2 Cu2(CrO4)2
Stock: Cromato de mercurio (II) Stock: Cromato de cobre (II)
CrO42-
Tradicional: Cromato mercúrico Tradicional: Cromato cúprico
Color obtenido: Amarillo Color obtenido: Amarillo/naranja
Hg2(SO4)2 Cu2(SO4)2
Stock: Sulfato de mercurio (II) Stock: Sulfato de cobre (II)
SO42-
Tradicional: Sulfato mercúrico Tradicional: Sulfato cúprico
Color obtenido: Incoloro Color obtenido: Incoloro
Hg(SCN)2 Cu(SCN)2
Stock: Tiocianato de mercurio (II) Stock: Tiocianato de cobre (II)
SCN-
Tradicional: Tiocianato mercúrico Tradicional: Tiocianato cúprico
Color obtenido: Incoloro Color obtenido: Amarillo
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
Fe3+ Zn2+
Fe(OH)3 Zn(OH)2
Stock: Hidróxido de hierro (III) Stock: Hidróxido de zinc
OH-
Tradicional: Hidróxido férrico Tradicional: Hidróxido zincico
Color obtenido: Naranja Color obtenido: Incoloro
FeCl3 Cl2
Stock: Cloruro de hierro (III) Stock: Cloruro de zinc
Cl-
Tradicional: Cloruro férrico Tradicional: Cloruro zincico
Color obtenido: Amarillo Color obtenido: Incoloro
FeI3 I2
Stock: Yoduro de hierro (III) Stock: Yoduro de zinc
I-
Tradicional: Yoduro férrico Tradicional: Yoduro zincico
Color obtenido: naranja Color obtenido: Incoloro
Fe2S3 2S2
Stock: Sulfuro de hierro (III) Stock: Sulfuro de zinc
S2-
Tradicional: Sulfuro férrico Tradicional: Sulfuro zincico
Color obtenido: Naranja/miel Color obtenido: Incoloro
Fe2(CrO4)3 2(CrO4)2
Stock: Cromato de hierro (III) Stock: Cromato de zinc
CrO42-
Tradicional: Cromato férrico Tradicional: Cromato zincico
Color obtenido: Amarillo/naranja Color obtenido: Amarillo
Fe2(SO4)3 2(SO4)2
Stock: Sulfato de hierro (III) Stock: Sulfato de zinc
SO42-
Tradicional: Sulfato férrico Tradicional: Sulfato zincico
Color obtenido: Incoloro Color obtenido: Incoloro
Fe(SCN)3 (SCN)2
Stock: Tiocianato de hierro (III) Stock: Tiocianato de zinc
SCN-
Tradicional: Tiocianato férrico Tradicional: Tiocianato zincico
Color obtenido: Marrón rojizo Color obtenido: Incoloro
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
Ba2+ Cd2+
Ba(OH)2 Cd(OH)2
Stock: Hidróxido de bario Stock: Hidróxido de cadmio
OH-
Tradicional: Hidróxido bárico Tradicional: Hidróxido cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
BaCl2 CdCl2
Stock: Cloruro de bario Stock: Cloruro de cadmio
Cl-
Tradicional: Cloruro bárico Tradicional: Cloruro cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
BaI2 CdI2
Stock: Yoduro de bario Stock: Yoduro de cadmio
I-
Tradicional: Yoduro bárico Tradicional: Yoduro cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
Ba2S2 Cd2S2
Stock: Sulfuro de bario Stock: Sulfuro de cadmio
S2-
Tradicional: Sulfuro bárico Tradicional: Sulfuro cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
Ba2(CrO4)2 Cd2(CrO4)2
Stock: Cromato de bario Stock: Cromato de cadmio
CrO42-
Tradicional: Cromato bárico Tradicional: Cromato cádmico
Color obtenido: Amarillo Color obtenido: Amarillo
Ba2(SO4)2 Cd2(SO4)2
Stock: Sulfato de bario Stock: Sulfato de cadmio
SO42-
Tradicional: Sulfato bárico Tradicional: Sulfato cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
Ba(SCN)2 Cd(SCN)2
Stock: Tiocianato de bario Stock: Tiocianato de cadmio
SCN-
Tradicional: Tiocianato bárico Tradicional: Tiocianato cádmico
Color obtenido: Incoloro Color obtenido: Incoloro
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
Ni2+
Ni(OH)2
Stock: Hidróxido de níquel (II)
OH-
Tradicional: Hidróxido niqueloso
Color obtenido: Incoloro
NiCl2
Stock: Cloruro de níquel (II)
Cl-
Tradicional: Cloruro niqueloso
Color obtenido: Incoloro
NiI2
Stock: Yoduro de níquel (II)
I-
Tradicional: Yoduro niqueloso
Color obtenido: Incoloro
Ni2S2
Stock: Sulfuro de níquel (II)
S2-
Tradicional: Sulfuro niqueloso
Color obtenido: Incoloro
Ni2(CrO4)2
Stock: Cromato de níquel (II)
CrO42-
Tradicional: Cromato niqueloso
Color obtenido: Amarillo
Ni2(SO4)2
Stock: Sulfato de níquel (II)
SO42-
Tradicional: Sulfato niqueloso
Color obtenido: Incoloro
Ni(SCN)2
Stock: Tiocianato de níquel (II)
SCN-
Tradicional: Tiocianato niqueloso
Color obtenido: Incoloro
Escribe el nombre y la función química de los productos obtenidos escribiéndolos
en la tabla siguiente
Mg (s) + O2 (g) → MgO (s)
Reactivo 1 Reactivo 2 Producto 1
Mg O2 MgO2
Magnesio Oxígeno Óxido de magnesio
F. Q. Elemento F. Q. Elemento F. Q: Óxido metálico
Observaciones: En la combustión del magnesio se puede observar que emite
una llama característica, de igual manera suelta humo y finalmente se forma un
polvo blanco que es el MgO
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
MgO2 (s) + H2O (l) → Mg(OH)2 (s)
Reactivo 1 Reactivo 2 Producto 1
Mg H2O Mg(OH)2
Óxido de magnesio Agua Hidróxido de magnesio
F. Q: Óxido metálico F. Q: Trivial F. Q: Hidróxido
Observaciones: Se puede comentar que al agregar agua a nuestro MgO se
convierte en hidróxido y esto se comprobó con la Fenolftaleína, pues al
agregarla su coloración se volvió rosa, indicando que es un hidróxido
H2O2 (l) + H2SO4 (l) + KMnO4 (l) → H2O (l) +O2 (g) + K2SO4 (s) + MnSO4 (s)
Reactivo 1 Reactivo 2 Reactivo 3 Producto 1 Producto 2 Producto 3 Producto 4
H2O2 H2SO4 KMnO4 H2O O2 K2SO4 MnSO4
Agua Ácido Permangan Agua Oxígeno Sulfato de Sulfato de
oxigenada sulfúrico ato de Potasio manganeso
potasio
F. Q: Óxido F. Q: Ácido F. Q: Sal F. Q: Trivial Elemento F.Q: Sal F.Q: Sal
metálico oxigenado oxigenada oxigenada oxigenada
Observaciones: Se pudo observar que el producto queda con un color cristalino a pesar que el
permanganato de potasio tiene una coloración morada
Zn (s) + HCl (aq) → H2 (g) + ZnCl2 (aq)
Reactivo 1 Reactivo 2 Producto 1 Producto 2
Zn HCl H2 ZnCl2
Zinc Ácido clorhídrico Hidrógeno Cloruro de zinc
Elemento F.Q.: Hidrácido Elemento F.Q.: Sal binaria
Observaciones: La reacción libera un gas y su temperatura aumenta
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
lOMoARcPSD|21122867
CONCLUSIÓN
Durante el desarrollo de nuestra práctica se logró captar la necesidad de aprender
Nomenclatura química y aceptar las Normas Internacionales de Nomenclatura (IUPAC)
pues de esta manera se tendrán las herramientas necesarias para estar en condiciones de
formular y nombrar correctamente cualquier sustancia inorgánica, así como llevar a cabo la
clasificación, identificación y representación de las reacciones químicas.
Este trabajo me lleva a ampliar mi conocimiento sobre el tema de nomenclatura,
donde podemos encontrar las tres diferentes formas de nombrar un compuesto:
• Tradicional
• Stock
• Sistemática
La diferencia de estas tres está en que en las primeras dos mencionadas se menciona
la valencia del elemento y en la sistemática se menciona el número de átomos del
compuesto. En la tradicional se hace referencia a estas valencias utilizando los prefijos y
sufijos -oso -iso, etc. Sin embargo, en el stock indicamos la valencia del elemento con el
uso de números romanos; a diferencia de la sistemática que se utilizan los prefijos mono,
di, tri, tetra, etc., dependiendo del número de átomos que posee cada elemento en el
compuesto.
De la misma forma que comprendí que los compuestos inorgánicos se clasifican según
su grupo funcional, dentro de las cuales podemos encontrar a los hidruros, óxidos metálicos
y no metálicos, hidróxidos, ácidos hidrácidos y oxiácidos, sales binarias y oxisales. En
conclusión, es importante conocer las reglas de nomenclatura para referirnos a los distintas
sustancias y compuestos que son formados, ya que de esta manera podremos relacionar
el cómo están formados y la relación de esto con su nombre.
Downloaded by violet zoe (violet.zoe.smich@gmail.com)
También podría gustarte
- Scribd Investigación de Operaciones 2Documento6 páginasScribd Investigación de Operaciones 2Carlos AlbertoAún no hay calificaciones
- La tabla periódica de los elementos químicosDe EverandLa tabla periódica de los elementos químicosCalificación: 1 de 5 estrellas1/5 (1)
- Compuestos Binarios y TernariosDocumento57 páginasCompuestos Binarios y TernariosKelly Cayo100% (1)
- Marco Teórico Funciones InorganicasDocumento4 páginasMarco Teórico Funciones InorganicasDiego Castro100% (1)
- Clase 7 y Peso Molecular NOMENCLATURA BINARIADocumento39 páginasClase 7 y Peso Molecular NOMENCLATURA BINARIARikiAún no hay calificaciones
- Química de los compuestos de coordinaciónDe EverandQuímica de los compuestos de coordinaciónAún no hay calificaciones
- Operaciones básicas del proceso, mezclas y disoluciones. QUIE0108De EverandOperaciones básicas del proceso, mezclas y disoluciones. QUIE0108Aún no hay calificaciones
- Practica 3 Laboratorio de Quimica GeneralDocumento22 páginasPractica 3 Laboratorio de Quimica GeneralDaniela NajeraAún no hay calificaciones
- Practica 2 QuimicaDocumento14 páginasPractica 2 QuimicaPadilla Perea Violet ZoeAún no hay calificaciones
- Practica Numero 3 Quimica General - Esiqie - IpnDocumento18 páginasPractica Numero 3 Quimica General - Esiqie - IpnDaniel GarcíaAún no hay calificaciones
- Funciones QuimicasDocumento13 páginasFunciones Quimicasgrecia cortijoAún no hay calificaciones
- 1PM12 23 1 E1 S3previos Rraa Rrej RPSDocumento13 páginas1PM12 23 1 E1 S3previos Rraa Rrej RPSSebastian Resillas PérezAún no hay calificaciones
- Tipos de NomenclaturaDocumento3 páginasTipos de NomenclaturaAna LagunaAún no hay calificaciones
- PaospsDocumento11 páginasPaospsUzui TengenAún no hay calificaciones
- UNIDAD 1 Elementos Químicos - FormulaciónDocumento10 páginasUNIDAD 1 Elementos Químicos - FormulaciónSilvana VázquezAún no hay calificaciones
- Investigacion No.2 Compuestos Binarios''Documento9 páginasInvestigacion No.2 Compuestos Binarios''Fernando BarillasAún no hay calificaciones
- Teopractica 8 Quc3admica Nomenclatura Inorganica Intermedio Ingenieria PDFDocumento97 páginasTeopractica 8 Quc3admica Nomenclatura Inorganica Intermedio Ingenieria PDFAlexander SaenzAún no hay calificaciones
- Guía Pedagógica 2 Química 4to Año CorregidoDocumento15 páginasGuía Pedagógica 2 Química 4to Año CorregidoYauli SanchezAún no hay calificaciones
- Formulación QuímicaDocumento22 páginasFormulación QuímicaAngel GelochoAún no hay calificaciones
- Nomenclatura QuimicaDocumento9 páginasNomenclatura QuimicaYaritza PéreaAún no hay calificaciones
- APUNTES Qumica G NomenclaturaDocumento22 páginasAPUNTES Qumica G NomenclaturaNicolas Cruz SwaneckAún no hay calificaciones
- Guía Didáctica Sobre La Nomenclatura de Compuestos InorgánicosDocumento10 páginasGuía Didáctica Sobre La Nomenclatura de Compuestos InorgánicosyuliaAún no hay calificaciones
- Guia Nomenclatura Quimica CICLO VIDocumento7 páginasGuia Nomenclatura Quimica CICLO VIIdens CúcutaAún no hay calificaciones
- Qca InorganicaDocumento37 páginasQca InorganicaIzeckAún no hay calificaciones
- Nomenclatura y Formulación InorgánicaDocumento15 páginasNomenclatura y Formulación InorgánicaGema NavarroAún no hay calificaciones
- TrabajoDocumento34 páginasTrabajoGandy BolilloAún no hay calificaciones
- Ayuda Uce 3Documento50 páginasAyuda Uce 3Michael BedonAún no hay calificaciones
- NOMENCLATURADocumento13 páginasNOMENCLATURAeduardodeqoAún no hay calificaciones
- Clase Teorica-Práctica 4-2023 DefDocumento10 páginasClase Teorica-Práctica 4-2023 Defcarcamocamila125Aún no hay calificaciones
- Nomenclatura de ÓxidosDocumento71 páginasNomenclatura de ÓxidosNicol ArteagaAún no hay calificaciones
- Nomenclatura de Óxidos Básicos e HidróxidosDocumento16 páginasNomenclatura de Óxidos Básicos e HidróxidosElizabeth AguirreAún no hay calificaciones
- Sesión 3 Química GeneralDocumento12 páginasSesión 3 Química GeneralMonserrat Gomez RodriguezAún no hay calificaciones
- Ultimo LabDocumento44 páginasUltimo LabBrandon EMAún no hay calificaciones
- QUIMICA2020IIDocumento51 páginasQUIMICA2020IINasira Hade Ccopa CabreraAún no hay calificaciones
- Compuestos InorgánicosDocumento10 páginasCompuestos InorgánicosJaneth VenegasAún no hay calificaciones
- 01-Nomenclatura Química InorgánicaDocumento30 páginas01-Nomenclatura Química InorgánicaJhari MeléndezAún no hay calificaciones
- Práctica 05 - Química 2Documento10 páginasPráctica 05 - Química 2Marko Senty Perez100% (1)
- Tema 1. Formulación Inorgánica Principal PDFDocumento16 páginasTema 1. Formulación Inorgánica Principal PDFJorge Martos GaldeanoAún no hay calificaciones
- Compuestos InorganicosDocumento21 páginasCompuestos InorganicosWilder Chavez MemenzaAún no hay calificaciones
- Óxidos MetálicosDocumento11 páginasÓxidos MetálicosCesar FierroAún no hay calificaciones
- 03 - Nomenclatura.Documento4 páginas03 - Nomenclatura.Julian Andres Contreras SantiagoAún no hay calificaciones
- Oxoacidos AnfoterosDocumento29 páginasOxoacidos Anfoterosraul lipa50% (2)
- Ae2 Introduccion A Los Compuestos Binarios .Estados de OxidacionDocumento29 páginasAe2 Introduccion A Los Compuestos Binarios .Estados de OxidacionIsrael MirandaAún no hay calificaciones
- Instituto Politécnico Nacional. 2Documento22 páginasInstituto Politécnico Nacional. 2Andrés HernándezAún no hay calificaciones
- Guia Integradora de Aprendizaje No4 - Química - Grado 10° - Periodo 2Documento8 páginasGuia Integradora de Aprendizaje No4 - Química - Grado 10° - Periodo 2Juan OlaAún no hay calificaciones
- Sem 9 Moléculas Iones NOMENCLATURADocumento55 páginasSem 9 Moléculas Iones NOMENCLATURA73741977Aún no hay calificaciones
- QUIMICA INORGANICA - NomenclaturaDocumento11 páginasQUIMICA INORGANICA - NomenclaturagladysgbAún no hay calificaciones
- Nomenclatura de Quimica InorganicaDocumento20 páginasNomenclatura de Quimica Inorganicaioreza4386Aún no hay calificaciones
- Deber de QuimicaDocumento3 páginasDeber de QuimicagmsoftAún no hay calificaciones
- NOMENCLATURADocumento39 páginasNOMENCLATURALEIDY LIZBETH SAAVEDRA ROSASAún no hay calificaciones
- Tallaer de QuimicaDocumento12 páginasTallaer de Quimicaayacucho01Aún no hay calificaciones
- Taller Nivelación Nomenclatura-InorganicaDocumento13 páginasTaller Nivelación Nomenclatura-InorganicaSantiago Mera PazAún no hay calificaciones
- QuímicaDocumento12 páginasQuímicaLucila GiorginiAún no hay calificaciones
- Nomenclatura Inorgnica 1220136874960646 9Documento29 páginasNomenclatura Inorgnica 1220136874960646 9Vanee Rojas TapiaAún no hay calificaciones
- Unidad 5. Nomenclatura Química Inorgánica.Documento65 páginasUnidad 5. Nomenclatura Química Inorgánica.andy loraAún no hay calificaciones
- Quimica InorganicaDocumento48 páginasQuimica InorganicaJaime Olazo MolloAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Practica 4 QuimicaDocumento4 páginasPractica 4 QuimicaPadilla Perea Violet ZoeAún no hay calificaciones
- Diagrama de BloquesDocumento5 páginasDiagrama de BloquesPadilla Perea Violet ZoeAún no hay calificaciones
- Sesion 2 Quimica General-1Documento16 páginasSesion 2 Quimica General-1Padilla Perea Violet ZoeAún no hay calificaciones
- 1999 Laura Rocio Ortiz EsquivelDocumento178 páginas1999 Laura Rocio Ortiz EsquivelPadilla Perea Violet ZoeAún no hay calificaciones
- Practica 4 QuimicaDocumento4 páginasPractica 4 QuimicaPadilla Perea Violet ZoeAún no hay calificaciones
- Instituto Politécnico NacionalDocumento21 páginasInstituto Politécnico NacionalPadilla Perea Violet ZoeAún no hay calificaciones
- Comunicación Formal e Informal y Niveles de ComunicaciónDocumento1 páginaComunicación Formal e Informal y Niveles de ComunicaciónPadilla Perea Violet ZoeAún no hay calificaciones
- Qué Es La GravedadDocumento4 páginasQué Es La GravedadPadilla Perea Violet ZoeAún no hay calificaciones
- DIAGRAMADocumento1 páginaDIAGRAMAPadilla Perea Violet ZoeAún no hay calificaciones
- MecanicaDocumento21 páginasMecanicaPadilla Perea Violet ZoeAún no hay calificaciones
- GERUNDIODocumento1 páginaGERUNDIOPadilla Perea Violet ZoeAún no hay calificaciones
- Material de LaboratorioDocumento7 páginasMaterial de LaboratorioPadilla Perea Violet ZoeAún no hay calificaciones
- Trabajo QuimicaDocumento7 páginasTrabajo QuimicaSaul MedinaAún no hay calificaciones
- Slucion 1 QuimicaDocumento9 páginasSlucion 1 Quimicajose angel urueta perezAún no hay calificaciones
- Tarea 3 FlorDocumento19 páginasTarea 3 Florcesar urbanoAún no hay calificaciones
- Taller Quimica ++Documento24 páginasTaller Quimica ++Harvey Galeano De La RosaAún no hay calificaciones
- Ejercicios para Quimica InorganicaDocumento5 páginasEjercicios para Quimica InorganicaINDIRAAún no hay calificaciones
- 3 - Clasificaci N Peri DicaDocumento12 páginas3 - Clasificaci N Peri DicaCesar ValenzuelaAún no hay calificaciones
- Preguntas Resueltas - EXAMEN FINALDocumento1 páginaPreguntas Resueltas - EXAMEN FINALVictoria Damián LópezAún no hay calificaciones
- EQUILIBRIO QUÍMICO Y PRINCIPIO DE Le CHATELIERDocumento5 páginasEQUILIBRIO QUÍMICO Y PRINCIPIO DE Le CHATELIEREstefania Rico LozadaAún no hay calificaciones
- TP5 Titulación Por PrecipitaciónDocumento2 páginasTP5 Titulación Por PrecipitaciónALEJANDROAún no hay calificaciones
- Soda CáusticaDocumento4 páginasSoda CáusticaEdy Ticahuanca AnccoAún no hay calificaciones
- Evaluacion Practica L. CaseiDocumento25 páginasEvaluacion Practica L. Caseimaria jose rodriguezAún no hay calificaciones
- Tema 5 Enlace Iónico 2018Documento6 páginasTema 5 Enlace Iónico 2018Claudia Alvarez GonzalezAún no hay calificaciones
- Analisis Cuantitativo de Fibras TextilesDocumento4 páginasAnalisis Cuantitativo de Fibras TextilesMirian Danidtza Fernandez cayoAún no hay calificaciones
- PRACTICA 8 .Materia Orgánica FinalDocumento3 páginasPRACTICA 8 .Materia Orgánica FinalLEYDY IORYELIZ CAPIA APAZAAún no hay calificaciones
- TALLER 2 Solucionario de Sexto g2Documento25 páginasTALLER 2 Solucionario de Sexto g2JOSE HUMBERTO RUEDA CAMPOAún no hay calificaciones
- Wuolah Free IsomeriaDocumento2 páginasWuolah Free IsomeriavioletacreoAún no hay calificaciones
- Informe 1 Reacc - de Alcoholes-PracticaDocumento18 páginasInforme 1 Reacc - de Alcoholes-PracticaDesly ChinguelAún no hay calificaciones
- PDF 20230705 192136 0000Documento10 páginasPDF 20230705 192136 0000ESMERALDAS ERAZO JOEL JOSUEAún no hay calificaciones
- Reforzamiento QuímicaDocumento33 páginasReforzamiento QuímicaEduardo GonzalezAún no hay calificaciones
- Biomoléculas OrgánicasDocumento4 páginasBiomoléculas OrgánicasAlex Villa OrtegaAún no hay calificaciones
- Catalizadores HeterogeneosDocumento3 páginasCatalizadores HeterogeneosNick Alejandro López100% (1)
- El Cuerpo Humano y Sus FuncionesDocumento51 páginasEl Cuerpo Humano y Sus FuncionesMARIA LUISA ANDRADE BERRIOAún no hay calificaciones
- T 4 y 5 PCYT Imprimir 2Documento9 páginasT 4 y 5 PCYT Imprimir 2anonimo282093Aún no hay calificaciones
- Reacciones de Oxido-ReducciónDocumento25 páginasReacciones de Oxido-ReducciónMauriAún no hay calificaciones
- Cuestionario Heterosidos CianogeneticosDocumento6 páginasCuestionario Heterosidos CianogeneticosJesika LemosAún no hay calificaciones
- Nomenclaturas BioquimicaDocumento3 páginasNomenclaturas BioquimicaangelAún no hay calificaciones
- Actividad Previa 2 - Romero ArellanoDocumento4 páginasActividad Previa 2 - Romero ArellanoRomero Arellano César IgnacioAún no hay calificaciones
- Cartel 02. - Rombos de TransporteDocumento1 páginaCartel 02. - Rombos de Transportedemis genaroAún no hay calificaciones
- Sustitución Nlucleófilica Sn2Documento1 páginaSustitución Nlucleófilica Sn2Denis Garcia GarciaAún no hay calificaciones