0% encontró este documento útil (0 votos)
1K vistas6 páginasBalance de Materia en Combustión de Gases
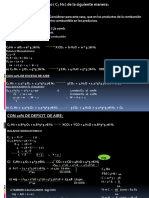
El documento presenta 6 problemas de balance de materia con reacciones químicas. El primer problema involucra la combustión de propano y determina el porcentaje de aire en exceso. El segundo problema analiza la combustión de una mezcla de etano y oxígeno y calcula la cantidad de aire en exceso por cada 100 moles del gas. El tercer problema determina la cantidad de metano, oxígeno, nitrógeno y productos de la combustión de metano con aire en exceso.
Cargado por
Jesus De Josue Ibarra DelgadoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOC, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas6 páginasBalance de Materia en Combustión de Gases
El documento presenta 6 problemas de balance de materia con reacciones químicas. El primer problema involucra la combustión de propano y determina el porcentaje de aire en exceso. El segundo problema analiza la combustión de una mezcla de etano y oxígeno y calcula la cantidad de aire en exceso por cada 100 moles del gas. El tercer problema determina la cantidad de metano, oxígeno, nitrógeno y productos de la combustión de metano con aire en exceso.
Cargado por
Jesus De Josue Ibarra DelgadoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOC, PDF, TXT o lee en línea desde Scribd