Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tautomería Ceto-Enol e Imina-Enamina
Cargado por
Guadalupe García SilvaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tautomería Ceto-Enol e Imina-Enamina
Cargado por
Guadalupe García SilvaCopyright:
Formatos disponibles
García Silva Guadalupe 5FM2
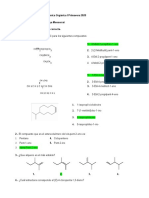
TAUTOMERÍA
CETO-ENOL
Generalmente se describe como el equilibrio con predominio de la forma ceto, aunque la cantidad de cada forma
depende de la estabilidad relativa de ambos tautómeros, ésta es afectada por la capacidad de formación de puentes
de hidrógeno por parte del disolvente, una posible conjugación de los dobles enlaces o la formación de un puente de
hidrógeno intramolecular como en el caso de la acetilacetona que desplaza el equilibrio hacia la forma enólica. Esta
tautomerización puede ser catalizada tanto en medio ácido como en medio alcalino.
En medio alcalino, la base extrae un hidrógeno alfa de la forma cetónica formando un anión enolato; la
deslocalización de la carga y posterior protonación del anión lleva a la forma enólica (Fig. 1).
En medio ácido, se protona el oxígeno del grupo carbonilo. La deprotonación de un carbono alfa, da la forma enólica
(Fig. 2).
IMINA-ENAMINA
Las iminas son el producto de condensación del amoniaco o amina primaria con una cetona o un aldehído. De forma
análoga el doble enlace de los alquenos, las iminas pueden presentar isomería Z/E. Las iminas son análogos
nitrogenados de cetonas y aldehídos. La tautomería imina-enamina tiene predominio de la prima (la imina). Véase
las figuras 3 y 4
Vollhardt, K.P. Schore, N. Química Orgánica. 3.ª edición. Barcelona. Omega. 2000. pp 784 y ss. ISBN 84-282-1172-8.
Antonov, L (editor). Tautomerism: Methods and Theories. Wiley-VCH, 2013. ISBN 978-3-527-33294-6
McMurry, John. Química Orgánica. 6a edición. México DF. Thomson. 2004. pp 820 y ss. ISBN 970-686-354-0
IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific
Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.T06252
También podría gustarte
- Sustitución Nucleofílica AromáticaDocumento5 páginasSustitución Nucleofílica AromáticaSaulPizarrosoAlvarezAún no hay calificaciones
- Practica 7 Coordi ÚltimaDocumento12 páginasPractica 7 Coordi ÚltimaCristhian D EchevesteAún no hay calificaciones
- Cuantificacion de Hierro en EspinacaDocumento8 páginasCuantificacion de Hierro en EspinacaVladimir Quintero LeónAún no hay calificaciones
- Práctica 1 Química Orgánica ENCBDocumento3 páginasPráctica 1 Química Orgánica ENCBEmriel9650% (2)
- Taller de Destilacion Fraccionada y Cromatografia en Capa FinaDocumento7 páginasTaller de Destilacion Fraccionada y Cromatografia en Capa FinaDANIELA CORDERO LOPEZAún no hay calificaciones
- Practica Compuestos de CoordinacionDocumento2 páginasPractica Compuestos de CoordinacionEva Mariana Torres0% (1)
- Examen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Documento9 páginasExamen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Marisol CGAún no hay calificaciones
- Química Orgánica IDocumento7 páginasQuímica Orgánica IKatya Monserrat Cocolepsi FortizAún no hay calificaciones
- Practica 3Documento6 páginasPractica 3Janni PolicromaticaAún no hay calificaciones
- Práctica 6: Fundamentos de EspectrofotometríaDocumento8 páginasPráctica 6: Fundamentos de EspectrofotometríaEduardo Gonzalez Cervantes0% (1)
- Dismutacion Del Cloro en AguaDocumento1 páginaDismutacion Del Cloro en AguaJuan Carlos0% (1)
- Experimental 1 Practica 2Documento3 páginasExperimental 1 Practica 2Gerardo RiveraAún no hay calificaciones
- Previo Practica 2Documento4 páginasPrevio Practica 2Luis Enrique Vaz1uez FloresAún no hay calificaciones
- PRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Documento11 páginasPRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Oscar UrielAún no hay calificaciones
- PR Ctica 5 Determinacion de Al y MG en Anti CidosDocumento7 páginasPR Ctica 5 Determinacion de Al y MG en Anti CidosDaniel RodriguezAún no hay calificaciones
- Aplicaciones de Los Cristales LíquidosDocumento2 páginasAplicaciones de Los Cristales LíquidosFiorella Ortiz RamosAún no hay calificaciones
- Previo Práctica 7 Lab EquilibrioDocumento4 páginasPrevio Práctica 7 Lab EquilibrioNatzi Monsalvo0% (1)
- Practica 4. IR y AE de Complejos de CuX y MDMSODocumento7 páginasPractica 4. IR y AE de Complejos de CuX y MDMSODavid MstAún no hay calificaciones
- Practica IRDocumento5 páginasPractica IRMelissa Fragoso RodríguezAún no hay calificaciones
- Espectro Infrarrojo Del Ciclohexanol y FenolDocumento15 páginasEspectro Infrarrojo Del Ciclohexanol y FenolMarilyn Arias67% (3)
- Previo de Propiedades ColigativasDocumento2 páginasPrevio de Propiedades ColigativasAlejandro Monroy Guerrero100% (1)
- Analitica Experimental Oxido ReducciónDocumento22 páginasAnalitica Experimental Oxido ReducciónKarina GFAún no hay calificaciones
- Práctica 3 Laboratorio de Equilibrio y CineticaDocumento4 páginasPráctica 3 Laboratorio de Equilibrio y CineticaDany PandaAún no hay calificaciones
- Conductividad eléctrica en disolución: análisis de electrolitosDocumento4 páginasConductividad eléctrica en disolución: análisis de electrolitosmiguelito perezAún no hay calificaciones
- Quimica Analitica Preparacion y Valoracion de Diluciones PatronDocumento11 páginasQuimica Analitica Preparacion y Valoracion de Diluciones PatronAlvaro ArancibiaAún no hay calificaciones
- INFORME 6. UV-VisDocumento8 páginasINFORME 6. UV-VisDany PandaAún no hay calificaciones
- Síntesis de P-Nitro AnilinaDocumento5 páginasSíntesis de P-Nitro AnilinaGreciaFabiolaAún no hay calificaciones
- OXIRANOSDocumento4 páginasOXIRANOSSandra OzAún no hay calificaciones
- Practica 7 ComplejosDocumento7 páginasPractica 7 ComplejosMarianellaTellezLazaroAún no hay calificaciones
- Análisis de Ácido Ascórbico en Una Muestra ComercialDocumento21 páginasAnálisis de Ácido Ascórbico en Una Muestra Comercialemilio osunaAún no hay calificaciones
- Practica 3 FisicoquímicaDocumento10 páginasPractica 3 FisicoquímicaRocha Valdovinos Aurelio NicolásAún no hay calificaciones
- Práctica 7Documento4 páginasPráctica 7Briand VallejoAún no hay calificaciones
- Tarea 1 PDFDocumento1 páginaTarea 1 PDFEdith GaytánAún no hay calificaciones
- Síntesis dibenzalacetonaDocumento5 páginasSíntesis dibenzalacetonaLuis RomeroAún no hay calificaciones
- Isomería geométrica cis-transDocumento4 páginasIsomería geométrica cis-transElusaAún no hay calificaciones
- Practica Obtencion de IminasDocumento4 páginasPractica Obtencion de IminasDaniel HernándezAún no hay calificaciones
- Laboratorio de Química Analítica IDocumento8 páginasLaboratorio de Química Analítica ISara VenturaAún no hay calificaciones
- Cuestionario Previo Curvas Calibracion 35407Documento1 páginaCuestionario Previo Curvas Calibracion 35407Abdiel QuiyuchAún no hay calificaciones
- Reparto de Yodo FinalDocumento6 páginasReparto de Yodo FinalHernandez David0% (1)
- Diagrama Liquido VaporDocumento57 páginasDiagrama Liquido VaporshlainnAún no hay calificaciones
- Cuestionario No. 7 Síntesis A Micro Escala de Ácido Fumárico.Documento4 páginasCuestionario No. 7 Síntesis A Micro Escala de Ácido Fumárico.Pablo CruzAún no hay calificaciones
- L. A - Practica #7Documento11 páginasL. A - Practica #7CarmenAún no hay calificaciones
- Comentario Del Capitulo El Segundo Secreto de La Vida.Documento1 páginaComentario Del Capitulo El Segundo Secreto de La Vida.Jomara GonzálezAún no hay calificaciones
- Práctica 6 y 7. Sintesis de SulfanilanidaDocumento5 páginasPráctica 6 y 7. Sintesis de SulfanilanidaBrandon Antonio Morales PalaciosAún no hay calificaciones
- Reacciones de Edman determinan secuencia proteínasDocumento6 páginasReacciones de Edman determinan secuencia proteínasJorge Andres Espinoza100% (1)
- PRÁCTICA 2 Complejos Metálicos de DimetilsulfóxidoDocumento6 páginasPRÁCTICA 2 Complejos Metálicos de DimetilsulfóxidoKATHERINE ARANZA DE LUNA MORENO100% (1)
- Practica 1 Reacciones de Sustitucion Nucleofilica Alifatica AutoguardadoDocumento9 páginasPractica 1 Reacciones de Sustitucion Nucleofilica Alifatica AutoguardadoDeniseFabelaAún no hay calificaciones
- R2 QuimicaCoordinacionDocumento4 páginasR2 QuimicaCoordinacionGabriel VázquezAún no hay calificaciones
- PrecipitacionDocumento17 páginasPrecipitacionKarina Caudillo GamezAún no hay calificaciones
- Farmacologia Practica 1Documento1 páginaFarmacologia Practica 1Nicholas's BarretoAún no hay calificaciones
- Estructura cristalina y propiedades de los sólidosDocumento10 páginasEstructura cristalina y propiedades de los sólidosMauricio PlataAún no hay calificaciones
- Informe de P TerburilfenolDocumento10 páginasInforme de P TerburilfenolOlmer TrujilloAún no hay calificaciones
- Oxidacion de Alcoholes PrimariosDocumento5 páginasOxidacion de Alcoholes PrimariosDanielCastroAún no hay calificaciones
- Deshidratación de alcoholes para obtener alquenosDocumento1 páginaDeshidratación de alcoholes para obtener alquenosDaiana CruzAún no hay calificaciones
- Reporte 5 LSCOHDocumento4 páginasReporte 5 LSCOHErnesto FloresAún no hay calificaciones
- Parcial 2 FQDocumento4 páginasParcial 2 FQNicole KesslerAún no hay calificaciones
- Cromatografía Ascendente de AminoácidosDocumento5 páginasCromatografía Ascendente de AminoácidosLiz SalazarAún no hay calificaciones
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDe EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaCalificación: 5 de 5 estrellas5/5 (1)
- Tarea 19 Equilibrio Ceto EnolDocumento1 páginaTarea 19 Equilibrio Ceto Enoldaniela.yeol12Aún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Reflexiones Sobre Discriminación y SaludDocumento34 páginasReflexiones Sobre Discriminación y SaludGuadalupe García SilvaAún no hay calificaciones
- Diagrama de Flujo P2 - Extracción en Fase Sólida. Separación de Colorantes SintéticosDocumento2 páginasDiagrama de Flujo P2 - Extracción en Fase Sólida. Separación de Colorantes SintéticosGuadalupe García SilvaAún no hay calificaciones
- GGS - Diagrama de Flujo Determinación Del Coeficiente de Absorción Molar de KMnO4 Por Espectroscopía VisibleDocumento3 páginasGGS - Diagrama de Flujo Determinación Del Coeficiente de Absorción Molar de KMnO4 Por Espectroscopía VisibleGuadalupe García SilvaAún no hay calificaciones
- Prestaciones laborales y derechos del trabajadorDocumento6 páginasPrestaciones laborales y derechos del trabajadorGuadalupe García SilvaAún no hay calificaciones
- Analgesia Endógena - TareaDocumento1 páginaAnalgesia Endógena - TareaGuadalupe García SilvaAún no hay calificaciones
- Diagrama de Flujo - Determinación de GuaifenesinaDocumento3 páginasDiagrama de Flujo - Determinación de GuaifenesinaGuadalupe García SilvaAún no hay calificaciones
- Reporte p1 - FurfuralDocumento4 páginasReporte p1 - FurfuralGuadalupe García SilvaAún no hay calificaciones
- PictogramasDocumento1 páginaPictogramasGuadalupe García SilvaAún no hay calificaciones
- Anatomía Del Sistema Inmunológico - SeminarioDocumento19 páginasAnatomía Del Sistema Inmunológico - SeminarioGuadalupe García SilvaAún no hay calificaciones