Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diagrama de Bloques PROYECTO
Cargado por
AGAARTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Diagrama de Bloques PROYECTO
Cargado por
AGAARCopyright:
Formatos disponibles
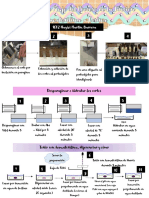
SIEMBRA DE LA BACTERIA Rhizobium
Dejar raíz con
tierra Raíces sin tierra
Trébol con Extracción de Transportar al Lavar las
nódulos raíces laboratorio raíces
Colocar los nódulos Separar los
Repetir el Lavar los nódulos en un tubo de
lavado 6 veces desinfectados nódulos
ensaye
Con agua Añadirle 4 ml Con bisturí
Transportar los estéril de NaClO y/o navaja
nódulos a cajas Petri
Agregar 5 Tomarlo con Con la flama del
gotas de agua un asa mechero Fisher
Colocar la mezcla en un
Mezclar Dejar secar Sellar el frotis
portaobjetos (frotis)
TINCION DE GRAM
Realizar tinción de
Gram al frotis
Puente de vidrio Colocar en una tarja
y el frotis
Añadir cristal Cubrir completamente
violeta portaobjetos
Añadir Lugol
Eliminar exceso del Cubrir completamente Eliminar exceso
Agua destilada colorante portaobjetos del colorante
Safranina de 30 a Acetona de 5
Agua destilada
60 segundos a 10 gotas
Eliminar exceso Enjuagar
Colocar colorante Colocar alcohol
de colorante inmediatamente
Secado Observar al
microscopio a 100x
Aceite de
inmersión
SIEMBRA DE LA BACTERIA Rhizobium
Preparación de los nódulos para la obtención de la bacteria Rhizobium
1. Extraer una pequeña parte del trébol cuidando que las raíces contengan bastante
tierra.
2. Lavar cuidadosamente las raíces del trébol con abundante agua hasta que no queden
residuos de tierra.
3. Separar cuidadosamente con un bisturí y/o navaja, los nódulos de las raíces y
colocarlos en el tubo de ensayo de 13 X 100.
4. Cubrir los nódulos con 4 ml de hipoclorito de sodio (5%), dejar actuar de 1-3
minutos.
5. Lavar los nódulos desinfectados con agua estéril, repetir el lavado mínimo de 6
veces.
6. Transferir los nódulos, en condiciones de sepsis a una caja de Petri estéril y agregar
5 gotas de agua.
7. Mezclar el nódulo con el agua, tomar un asa y colocar esta mezcla en un
portaobjetos (frotis).
8. Dejar secar el frotis, sellar el frotis con la flama del mechero Fisher pasándolo
rápidamente por la flama.
9. Realizar tinción de Gram al frotis.
TINCION DE GRAM
a) Colocar en la tarja un puente de vidrio y colocar el frotis.
b) Colocar cristal violeta hasta cubrir completamente el portaobjetos y dejar actuar 1
minuto.
c) Eliminar el exceso del colorante con agua destilada.
d) Colocar Lugol hasta cubrir completamente el portaobjetos y dejar actuar durante 1
minuto.
e) Eliminar el exceso del colorante con agua destilada.
f) Colocar Alcohol – acetona de 5 – 10 gotas y enjuagar inmediatamente.
g) Colocar colorante Safranina de 30-60 segundos.
h) Eliminar el exceso del colorante con agua destilada
i) Dejar secar cerca del mechero Fisher.
j) Observar al microscopio a 100x con aceite de inmersión.
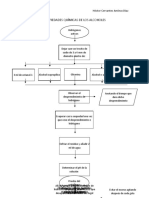
PREPARACION DE LOS MEDIOS DE CULTIVO
gr de Agar sal manitol 500 ml de gr de ASM
con rojo Congo agua
Pesar en balanza Verter en
Añadir al Homogenizar
granataria matraz
matraz hasta disolver
graduado
Esperar Esterilizar Agregar 500
Taparlo ml
enfriamiento autoclave
15 min a 120 °C Gorro de papel de Agua
estraza y cinta
Sacar y dejar enfriar
Por cada
vaciado Medio de siembra
Esperar a que
Encender Flamear boca del matraz Vaciar a cajas
solidifique
mechero Petri
Poner en
refrigeración
PREPARACION DE LOS MEDIOS DE CULTIVO
1. En una balanza granataria pesar gr de Agar sal manitol con rojo Congo.
2. En un matraz graduado agregar 500 ml de agua, añadir el gr de Agar y homogenizar
hasta que se disuelva perfectamente.
3. Agregar los otros 500 ml de agua, taparlo con un tapón de gasa.
4. Tapar con un gorro hecho de papel estraza con cinta indicadora.
5. Esterilizar en el autoclave 15 min a 120°C
6. Posterior al tiempo de esterilizado sacar y dejar enfriar solo un poco.
7. Prender el mechero, para poder vaciar en las cajas Petri. Para el vaciado es
importante flamear la boa del matraz cada vez que se vaya a vaciar en las cajas
Petri.
8. Dejar enfriar hasta que se hagan sólidas.
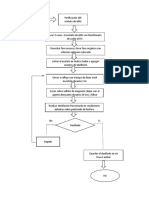
SEMBRADO EN LOS MEDIOS DE CULTIVO
Con bisturí y/o
9. Almacenar para posteriormente sembrar en ellas. navaja
Raiz con tierra del Abundante
trébol agua
Transportar a Separar
Extracción Lavar Raíz
laboratorio nódulos
Agua esteril
Lavar nódulos Colocar en tubo
Dejar actuar Cubrir nódulos de ensaye
desinfectados
6 veces
4 ml de hipoclorito de Tubo de 13
1 a 3 minutos
sodio al 5% x 100
Repetir lavado
Agregar 5 Por estriado en
gotas de agua Asa disolución
bacteriológica
Sembrar en caja
Transferir Caja Petri esteril Tomar muestra Petri
nódulos
En condiciones de A 28 °C Incubar
sepsis por 7 dias
Aplicar nuevamente Seleccionar Observar
Prepara frotis
tinción gram colonias desarrollo
Blancas y mucosas
Observar en Presencia de Gram
microoscopio Negativos bacilos cortos
SEMBRADO EN LOS MEDIOS DE CULTIVO
1. Extraer una pequeña parte del trébol cuidando que las raíces contengan bastante
tierra.
2. Lavar cuidadosamente las raíces del trébol con abundante agua hasta que no queden
residuos de tierra.
3. Separar cuidadosamente con un bisturí y/o navaja, los nódulos de las raíces y
colocarlos en el tubo de ensayo de 13 X 100.
4. Cubrir los nódulos con 4 ml de hipoclorito de sodio (5%), dejar actuar de 1-3
minutos.
5. Lavar los nódulos desinfectados con agua estéril, repetir el lavado mínimo de 6
veces
6. Transferir los nódulos, en condiciones de sepsis a una caja de Petri estéril y agregar
5 gotas de agua.
7. Con un asa bacteriológica tomar un poco de esta mezcla y sembrar en la caja Petri
por estriado en dilución.
8. Incubar a 28 °C de 3 a 7 días.
9. Observar el desarrollo de la bacteria en el medio de cultivo, seleccionar colonias
aisladas blancas y mucosas (Ver Anexo…)
10. A partir de una de las colonias típicas seleccionadas, preparar un frotis, y aplicar
nuevamente una tinción de Gram y observar al microscopio, al observar deben
existir la presencia de Gram Negativos bacilos cortos (ver anexo…)
También podría gustarte
- Diagrama ColoracionesDocumento4 páginasDiagrama Coloracionesmiguel angel uribe ardilaAún no hay calificaciones
- Diagrama MicropropagacionDocumento2 páginasDiagrama MicropropagacionMartha Aleida DelAún no hay calificaciones
- Procedimiento Marcado de CrisolDocumento4 páginasProcedimiento Marcado de Crisoldennise ochoaAún no hay calificaciones
- Elaboracion de Un Medio de CultivoDocumento1 páginaElaboracion de Un Medio de CultivoMarioV15Aún no hay calificaciones
- Tincion de GramDocumento1 páginaTincion de GramAshley Naomi Adame SandovalAún no hay calificaciones
- Diagrama de Bloques de Cristalización y SublimaciónDocumento1 páginaDiagrama de Bloques de Cristalización y SublimaciónErika SolísAún no hay calificaciones
- Informe FurfuralDocumento9 páginasInforme FurfuralPaola Serena Galean AyardeAún no hay calificaciones
- Practica DesarrolloDocumento2 páginasPractica DesarrolloCRIOLLO MONTOYA MELISA GABRIELAAún no hay calificaciones
- Dominguez Gamero Alejandro Actividad Si 2.2.Documento7 páginasDominguez Gamero Alejandro Actividad Si 2.2.ALEJANDRO DOMINGUEZ GAMEROAún no hay calificaciones
- Pre-Informe 2 y 3Documento3 páginasPre-Informe 2 y 3Jose Luis PeinadoAún no hay calificaciones
- PreInforme Cristalizacion y Puntos de FusionDocumento8 páginasPreInforme Cristalizacion y Puntos de FusionEliezer PosgradoAún no hay calificaciones
- Formulas para Productos de Hogar y CosmeticosDocumento59 páginasFormulas para Productos de Hogar y CosmeticosHarrison caicedo asprillaAún no hay calificaciones
- Recristalizacion y Puntos de FusionDocumento10 páginasRecristalizacion y Puntos de FusionCASILLA CHOQUE ROCIOAún no hay calificaciones
- Cultivo y Estudio de BacteriasDocumento4 páginasCultivo y Estudio de BacteriasCarolina IglesiasAún no hay calificaciones
- Práctica #2 BioquímicaDocumento5 páginasPráctica #2 BioquímicaDenisse Villegas SánchezAún no hay calificaciones
- Documento Practicas BioquímicaDocumento6 páginasDocumento Practicas BioquímicaDenisse Villegas SánchezAún no hay calificaciones
- Flujo Grama de CromatografiaDocumento1 páginaFlujo Grama de CromatografiaJonh CampellAún no hay calificaciones
- Informe 2Documento14 páginasInforme 2rene catacoraAún no hay calificaciones
- Práctica 1 - Leyes de Mendel y Herencia Ligada Al SexoDocumento17 páginasPráctica 1 - Leyes de Mendel y Herencia Ligada Al SexoIsisAún no hay calificaciones
- Diagrama de Flujo Del Proceso de La Tinción Hematoxilina - Eosina - NAYIVI MARTIN BARRERADocumento2 páginasDiagrama de Flujo Del Proceso de La Tinción Hematoxilina - Eosina - NAYIVI MARTIN BARRERANayivi Martin BarreraAún no hay calificaciones
- Biología CelularDocumento2 páginasBiología CelularArlys Hoyos BasilioAún no hay calificaciones
- DiagramaDocumento2 páginasDiagramaGerardo MejíaAún no hay calificaciones
- M - Ppa1 - Metodología CultivosDocumento1 páginaM - Ppa1 - Metodología CultivosArlen NavaAún no hay calificaciones
- Taller Organica 3Documento5 páginasTaller Organica 3Elizabeth ChavanaAún no hay calificaciones
- SIPOCDocumento1 páginaSIPOCAlan Gonzalez CervantesAún no hay calificaciones
- Práctica 4 - Cromatina SexualDocumento9 páginasPráctica 4 - Cromatina SexualIsisAún no hay calificaciones
- FlujogramasDocumento9 páginasFlujogramasdiana riosAún no hay calificaciones
- Informe de LaboratorioDocumento9 páginasInforme de LaboratorioDaniel Ulloa AquijeAún no hay calificaciones
- Mezclas y CompuestosDocumento3 páginasMezclas y CompuestosAntonio SolanesAún no hay calificaciones
- Coloración de Gram y Ziehl NeelsenDocumento27 páginasColoración de Gram y Ziehl NeelsenStevensAún no hay calificaciones
- Bitacora 14 Aislamineto de DNADocumento4 páginasBitacora 14 Aislamineto de DNAVale CarBoAún no hay calificaciones
- Reporte P2 PDFDocumento10 páginasReporte P2 PDFMarco Antonio DueñasAún no hay calificaciones
- Determinacion de FibraDocumento2 páginasDeterminacion de FibraLenin samuel Alarcon prietoAún no hay calificaciones
- Diagramas de Flujo 3Documento1 páginaDiagramas de Flujo 3noniAún no hay calificaciones
- Tecnicas de Concentracion en El Examen CoproparasitologicoDocumento10 páginasTecnicas de Concentracion en El Examen CoproparasitologicoCarla Yelixa Garnica MenecesAún no hay calificaciones
- Ls-Pureba para La DetecciÓn de Semen en RopaDocumento2 páginasLs-Pureba para La DetecciÓn de Semen en RopaQUIMICO CLINICO WILLIANS SANCHEZAún no hay calificaciones
- Cromatografia en Capa Fina y Columna para Pigmentos Del Chile GuajilloDocumento9 páginasCromatografia en Capa Fina y Columna para Pigmentos Del Chile GuajilloYahir Michael KleinAún no hay calificaciones
- Practica N°9 SaponificacionDocumento8 páginasPractica N°9 SaponificacionJhasminQuispeVelasqueAún no hay calificaciones
- Purificacion Del Acetato de EtiloDocumento2 páginasPurificacion Del Acetato de EtiloFernando MezaAún no hay calificaciones
- Tinciones EspecialesDocumento25 páginasTinciones EspecialesCasandra Lobato DomínguezAún no hay calificaciones
- Tecnologia Domestica Champu para RopaDocumento1 páginaTecnologia Domestica Champu para RopaAbigail CastilloAún no hay calificaciones
- Diagrama de Flujo Practica 3 Organica 1Documento1 páginaDiagrama de Flujo Practica 3 Organica 1Yoali Asiain LeconaAún no hay calificaciones
- Beige Modern Business Organization Chart GraphDocumento2 páginasBeige Modern Business Organization Chart GraphSOSA HERNANDEZ YAHAIRA NAOMIAún no hay calificaciones
- Practica 3 Separación de Mezclas Por Cambios FísicosDocumento13 páginasPractica 3 Separación de Mezclas Por Cambios FísicosAriadna IruretagoyenaAún no hay calificaciones
- Bioquimica de AlimentosDocumento23 páginasBioquimica de AlimentosKevin David AlvarezAún no hay calificaciones
- Portafolio de Protesis Parcial RemovibleDocumento37 páginasPortafolio de Protesis Parcial RemovibleRaquel PAún no hay calificaciones
- Tecnica de Flotacion Por SaturacionDocumento1 páginaTecnica de Flotacion Por SaturacionElizabet ArceoAún no hay calificaciones
- Flojograma Biologia Lab 4Documento2 páginasFlojograma Biologia Lab 4lilianaAún no hay calificaciones
- Lab#1 QMC 200Documento10 páginasLab#1 QMC 200Rocio Andrea CasillaAún no hay calificaciones
- Diagrama de Bloques, Práctica TinciónDocumento4 páginasDiagrama de Bloques, Práctica TinciónVILCHIS RIOS ANGEL GABRIELAún no hay calificaciones
- Coloraciones Bacterianas.Documento4 páginasColoraciones Bacterianas.MarisolAún no hay calificaciones
- Preinforme GavinometriaDocumento1 páginaPreinforme GavinometriaMoises PratoAún no hay calificaciones
- Bitacoras MicrobiologiaDocumento13 páginasBitacoras MicrobiologiakelyAún no hay calificaciones
- Obtención de La TrimiristinaDocumento9 páginasObtención de La TrimiristinaFernando ArroyoAún no hay calificaciones
- TECNOLOGIA DOMESTICA Limpiador MultiusosDocumento1 páginaTECNOLOGIA DOMESTICA Limpiador MultiusosCarina MtzAún no hay calificaciones
- .-Ova Practica - Sem 09 - T-2023-IiDocumento29 páginas.-Ova Practica - Sem 09 - T-2023-IiJhon Kevin GarciaAún no hay calificaciones
- Diagramas de Flujo Diels AlderDocumento2 páginasDiagramas de Flujo Diels AlderAnnBukowskiAún no hay calificaciones
- Determinación de TexturaDocumento6 páginasDeterminación de TexturaEzmyytha CaZtiillo ReyynaAún no hay calificaciones
- Preparación y uso de MACERADOS, INFUSIONES, DECOCCIONESDe EverandPreparación y uso de MACERADOS, INFUSIONES, DECOCCIONESCalificación: 4 de 5 estrellas4/5 (4)
- CTRL Horas ComplementariasDocumento1 páginaCTRL Horas ComplementariasAGAARAún no hay calificaciones
- LABORATORIO (Reporte)Documento1 páginaLABORATORIO (Reporte)AGAARAún no hay calificaciones
- Demanda Materias PrimasDocumento2 páginasDemanda Materias PrimasAGAARAún no hay calificaciones
- Speaking ConversacionDocumento2 páginasSpeaking ConversacionAGAARAún no hay calificaciones
- Lo SientoDocumento1 páginaLo SientoAGAARAún no hay calificaciones
- Bioquimica Proceso AnaliticoDocumento2 páginasBioquimica Proceso AnaliticoAGAARAún no hay calificaciones
- Justificante MedicoDocumento1 páginaJustificante MedicoAGAARAún no hay calificaciones
- 1°programación de ActividadesDocumento1 página1°programación de ActividadesAGAARAún no hay calificaciones
- 064-Pa0007 TDS EsDocumento2 páginas064-Pa0007 TDS EsAGAARAún no hay calificaciones
- TABLADocumento1 páginaTABLAAGAARAún no hay calificaciones
- Cronogr CorregDocumento1 páginaCronogr CorregAGAARAún no hay calificaciones
- Ecs Dif 6cDocumento2 páginasEcs Dif 6cAGAARAún no hay calificaciones
- TEMADocumento2 páginasTEMAAGAARAún no hay calificaciones
- ACT Unidad 5Documento2 páginasACT Unidad 5AGAARAún no hay calificaciones
- 5° B Plan de ActividadesDocumento13 páginas5° B Plan de ActividadesAGAARAún no hay calificaciones
- Por Ejemplo: Avenida Insurgentes Sur, Boulevard Ávila Camacho, Calzada, Corredor, Etc.Documento4 páginasPor Ejemplo: Avenida Insurgentes Sur, Boulevard Ávila Camacho, Calzada, Corredor, Etc.Miguel Alvarado RuizAún no hay calificaciones
- Sopa de LetrasDocumento1 páginaSopa de LetrasAGAARAún no hay calificaciones
- Lec 02 4 PDFDocumento5 páginasLec 02 4 PDFPaula AndreaAún no hay calificaciones
- Aplicacion de La Metodologia de Superficie de Respuesta para Evaluar Concentracion de Azucar y de Cultivos Iniciadores ComercialesDocumento13 páginasAplicacion de La Metodologia de Superficie de Respuesta para Evaluar Concentracion de Azucar y de Cultivos Iniciadores ComercialesFernanda GonzalezAún no hay calificaciones
- Redox 2001Documento60 páginasRedox 2001AGAARAún no hay calificaciones
- tAOfkDTe2D5jOSSVcZ9f 2Documento21 páginastAOfkDTe2D5jOSSVcZ9f 2AGAARAún no hay calificaciones
- Actividad Unidad 5 Exp RespDocumento2 páginasActividad Unidad 5 Exp RespAGAARAún no hay calificaciones
- Clase 2-2 Rodrigez-Bernal 2004 FICHA DE YogurtDocumento1 páginaClase 2-2 Rodrigez-Bernal 2004 FICHA DE YogurtAGAARAún no hay calificaciones
- Aplicacion de La Metodologia de Superficie de Respuesta para Evaluar Concentracion de Azucar y de Cultivos Iniciadores ComercialesDocumento13 páginasAplicacion de La Metodologia de Superficie de Respuesta para Evaluar Concentracion de Azucar y de Cultivos Iniciadores ComercialesFernanda GonzalezAún no hay calificaciones
- Escala NuméricaDocumento2 páginasEscala NuméricaAGAARAún no hay calificaciones
- Parra HuertaDocumento7 páginasParra HuertaAGAARAún no hay calificaciones
- Dialnet LaMotivacionPilarBasicoDeTodoTipoDeEsfuerzo 209932Documento21 páginasDialnet LaMotivacionPilarBasicoDeTodoTipoDeEsfuerzo 209932Xerach GHAún no hay calificaciones
- Problemario Números RealesDocumento1 páginaProblemario Números RealesAGAARAún no hay calificaciones
- DocumentoDocumento4 páginasDocumentoAGAARAún no hay calificaciones
- HAKERS (Positivo, Negativo, Interesante)Documento1 páginaHAKERS (Positivo, Negativo, Interesante)Gómez Aguilar Ana100% (1)
- Geografia Física de AméricaDocumento8 páginasGeografia Física de AméricaFrancisca ValdiviaAún no hay calificaciones
- Usos Del Iroke Ifá, Rezos y Como Invocar A Ò̧rúnmìlá Con El IrokeDocumento1 páginaUsos Del Iroke Ifá, Rezos y Como Invocar A Ò̧rúnmìlá Con El IrokeLandyAún no hay calificaciones
- EL LIDER Y L CONCENTRACION EN EL TRABAJO UltimoDocumento9 páginasEL LIDER Y L CONCENTRACION EN EL TRABAJO UltimoAdrielito Granados CerrónAún no hay calificaciones
- Fotosintesis FocoDocumento6 páginasFotosintesis FocoMitzie Ramirez VenegasAún no hay calificaciones
- El Inculpado y AbogadoDocumento25 páginasEl Inculpado y AbogadoDike NazarioAún no hay calificaciones
- Administracion 2 Tarea 5yenifer Lopez 09005823Documento9 páginasAdministracion 2 Tarea 5yenifer Lopez 09005823Yenifer LopezAún no hay calificaciones
- Rd5548425a en 3475091 685646 2613 PDFDocumento2 páginasRd5548425a en 3475091 685646 2613 PDFSergio MoralesAún no hay calificaciones
- XSA Manual TransportistasDocumento19 páginasXSA Manual TransportistasLili MendozaAún no hay calificaciones
- Actividad Evaluativa Eje 1 - ALGEBRA LINEAL - 202160-6B - 071Documento12 páginasActividad Evaluativa Eje 1 - ALGEBRA LINEAL - 202160-6B - 071Paul RinconAún no hay calificaciones
- FUENTEDocumento3 páginasFUENTEErika JojoaAún no hay calificaciones
- Vdocuments - MX - Juanita y El Conejo Perdido PDFDocumento6 páginasVdocuments - MX - Juanita y El Conejo Perdido PDFEMILY ZARETH CARDONA SABOGALAún no hay calificaciones
- U2 - S5 - Ejercicios para Actividad VirtualDocumento6 páginasU2 - S5 - Ejercicios para Actividad VirtualRayAún no hay calificaciones
- Fideicomiso en El Ecosistema InmobiliarioDocumento7 páginasFideicomiso en El Ecosistema InmobiliarioGiannina RojasAún no hay calificaciones
- Lista de ChequeoDocumento3 páginasLista de ChequeopaolaAún no hay calificaciones
- Taller 2 de Conjuntos - CardinalidadDocumento4 páginasTaller 2 de Conjuntos - CardinalidadVALERIA BOTINA ASTUDILLOAún no hay calificaciones
- Boletín Agroecología #23Documento13 páginasBoletín Agroecología #23Johana MonfardiniAún no hay calificaciones
- EK201830935023Documento3 páginasEK201830935023Francisco RiascosAún no hay calificaciones
- MFH II Semana 5. Orientac Estudio IndependienteDocumento7 páginasMFH II Semana 5. Orientac Estudio IndependienteCarlosAún no hay calificaciones
- Ensayo Trabajo InfantilDocumento3 páginasEnsayo Trabajo InfantilmayorgarodrAún no hay calificaciones
- Vicios Del LenguajeDocumento3 páginasVicios Del LenguajeJOWIDUPAAún no hay calificaciones
- Cirugia Del Sector Femoro Popliteo PDFDocumento210 páginasCirugia Del Sector Femoro Popliteo PDFLeonardoQuintero100% (1)
- Enfermeria Como Agente de CambioDocumento27 páginasEnfermeria Como Agente de Cambioalejandra0% (1)
- Sri Sai Rudram Traducción Completa PDFDocumento2 páginasSri Sai Rudram Traducción Completa PDFAngel Ernesto Coraspe LeónAún no hay calificaciones
- Punto de EquilibrioDocumento27 páginasPunto de EquilibrioArfot Silva SilvestreAún no hay calificaciones
- Grupo 5 - Informe Ley de CharlesDocumento32 páginasGrupo 5 - Informe Ley de CharlesCAICAY OTOYA LUIS EDUARDOAún no hay calificaciones
- Ensayo FilosofiaDocumento13 páginasEnsayo FilosofiaSteven Highlights69Aún no hay calificaciones
- Raul Zurita Escribir Es Suspender La VidaDocumento19 páginasRaul Zurita Escribir Es Suspender La Vidadedaluxsalvaje100% (1)
- Mariana MartinDocumento52 páginasMariana MartinSandra PedrazaAún no hay calificaciones
- Carta de NicholsDocumento17 páginasCarta de Nicholssinchy50% (2)