Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Materia
Cargado por
Gamaniel Henry Asto FloresTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Materia
Cargado por
Gamaniel Henry Asto FloresCopyright:
Formatos disponibles
I.E.
“GABRIEL MORENO” QUÍMICA
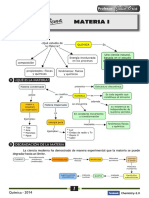
I. LA MATERIA 3.1. Propiedades físicas:
Son aquellas propiedades que se manifiestan sin alterar la estructura o composición de
la sustancia. Pueden ser:
1. ¿QUÉ ES LA MATERIA? 3.1.1. Propiedades extensivas (generales): Cuando la magnitud de dicha propiedad
depende de la cantidad de sustancia presente. Ejemplo: Masa, volumen, etc.
Es todo aquello que constituye el universo; tiene masa y extensión y su existencia es 3.1.2. Propiedades intensivas (específicas): Cuando la magnitud de dicha propiedad
independiente de nuestros sentidos. Ejemplo: Agua, sal de mesa, aire, alcohol, azúcar, es independiente de la cantidad de sustancia presente. Ejemplo: Densidad,
etc. temperatura, color, dureza, etc.
2. CLASIFICACIÓN DE LA MATERIA: 3.2. Propiedades químicas:
Son aquellas propiedades que se manifiestan alterando la estructura o composición de la
sustancia por acción de otra(s) o de un agente energético. Las propiedades químicas
MATERIA están referidas fundamentalmente a la reactividad química de las sustancias. Ejemplo:
El hierro (Fe) se oxida con el oxígeno (O2) del aire, mientras que el oro (Au) no se oxida.
4. FASES DE LA MATERIA:
SUSTANCIA MEZCLA
La materia se representa en el universo en 4 fases: sólido, líquido, gaseoso y plasmático.
Elemento Compuesto Homogénea Heterogénea FASE SÓLIDA FA
FA
FA>FR
2.1. Sustancia: F F
Es todo cuerpo o materia homogénea con composición química definida (posee fórmula Fierro (Fe) R R
o representación simbólica). - Tiene volumen y forma definidos.
2.1.1. Elementos o sustancia simple: Es la materia conformada por átomos del mismo - Las partículas sólo experimentan movimiento vibratorio.
tipo. Ejemplo: Na, C, S, Sal, Ag, H2, O2, etc. - Los sólidos son incompresibles.
2.1.2. Compuesto o sustancia compuesta: Es la materia conformada por átomos de
diferentes elementos. Ejemplo: H2O, NaCl, NaOH, H2SO4, etc.
2.2. Mezcla:
Es la reunión de dos o más sustancias puras para formar otra si que pierdan sus FASE LÍQUIDA
características particulares iniciales. Pueden ser de dos tipos:
2.2.1. Mezcla homogénea o solución: Es la unión de dos o más sustancias puras, las FA=FR
cuales conforman una sola fase. Ejemplo: Agua salada (H2O + NaCl), bronce (Cu + F FA FA F
Sn), aire (N2, O2, H2, CO2, etc). R R
2.2.2. Mezcla heterogénea: Es la unión de dos o más sustancias puras las cuales
conforman varias fases. Ejemplo: Agua + cocoa, humo, arena + sal de mesa, etc. Agua Líquida (H2O)
- Tiene volumen definido y forma variable.
3. PROPIEDADES DE LA MATERIA:
- Las partículas experimentan movimientos vibratorios y de traslación.
Son aquellas que caracterizan a cada sustancia y permiten su diferenciación e
identificación con relación de otras sustancias. - Los líquidos son incompresibles.
20 3º SECUNDARIA – I PERIODO - 2022
I.E. “GABRIEL MORENO” QUÍMICA
6. FENÓMENO:
FASE GASEOSA Es todo cambio o transformación que ocurre en la naturaleza.
6.1. Fenómeno físico: El cambio ocurre sólo en la apariencia de la materia pero no en la
estructura interna de ella. Ejemplo: Cambio de estado del agua, ruptura de la madera.
F R > FA 6.2. Fenómeno químico: Se origina un cambio en la estructura interna de la materia, es
F F F F un proceso irreversible. Ejemplo: Quemar un papel, las reacciones químicas.
R A A R
6.3. Fenómeno alotrópico: Se presenta en ciertos elementos que al encontrarse en el
Oxígeno gaseoso (O2) mismo estado físico tienen dos o más formas con distintas propiedades. Ejemplo:
- Tiene volumen y forma variable. Alótropos
- Las partículas tiene mayor separación que en los líquidos debido a la FR
- Oxígeno (O2) Ozono (O3)
predominante, y experimentan un movimiento caótico.
Alótropos
- Los gases tiene alta comprensibilidad. - Carbón (C) Diamante (Cn)
- Fósforo blanco (P2) Alótropos Fósforo rojo (P4)
FASE PLASMÁTICA
Es la fase que requiere de altas temperaturas (superiores a 20 000°C) PRÁCTICA DIRIGIDA N° 04
por lo que se constituye en el estado más energético que los anteriores.
Está conformado de una mezcla de moléculas y átomos ionizados, así
como también de electrones. I. Relaciona: ( ¼ Pto. c/u)
La fase plasmática es habitual en el sol y demás estrellas, así como 1)
también en la formación de los volcanes.
a) cobre ( ) Compuesto
b) sal común ( ) Mezcla heterogénea
NOTAS:
c) agua de mar ( ) elemento
FA = Fuerza de atracción intermolecular.
d) aire ( ) mezcla homogénea
FR = Fuerza de repulsión intermolecular.
Las fases sólida, líquida y gaseosa son las más comunes a
condiciones ambientales y por lo tanto de mayor importancia. 2)
a) sólido ( ) Aire
b) gaseoso ( ) sol
5. CAMBIOS DE FASE: c) líquido ( ) piedra
La materia por efecto de variación de temperatura y presión puede cambiar de fase. d) plasma ( ) mercurio (t = 25°C)
SUBLIMACIÓN
3)
a) gelatina ( d ) oxidación
Fusión Vaporización
b) agua más azúcar ( b ) mezcla heterogenia
SÓLIDO LÍQUIDO GAS
c) aire +CO2 ( a ) coloide
Solidificación Licuación d) fierro +O2 ( c ) mezcla homogénea
DEPOSICIÓN O SUBLIMACIÓN INVERSA
21 3º SECUNDARIA – I PERIODO - 2022
I.E. “GABRIEL MORENO” QUÍMICA
II. Completa los siguientes mapas conceptuales: ( ¼ c/u) 4).- Señala la proposición que no implica un fenómeno químico:
I. Oxidación de un clavo.
MATERIA II. Fundición del hierro.
III. Digestión de los alimentos.
Se clasifica en
a) Sólo I b) Sólo II c) Sólo III d) I y II e) I y III
SUSTANCIA MEZCLAS 5).- La naftalina con el transcurrir del tiempo disminuye su tamaño, debido a que
experimenta:
Puede ser Puede ser a) Fusión b) Evaporación c) Condensación
d) Sublimación e) Solidificación
ELEMENTOS COMPUESTOS HOMOGENEAS HETEROGENEAS
6).- Son mezclas homogéneas:
I. Agua potable. II. Gasolina III. Humo. IV. Arena.
se encuentra en forma de
a) Sólo I b) Sólo II c) I y II d) I, II y III e) Todas
FISICAS QUIMICAS
7).- Son sustancias puras:
a) Aquellas que presentan una sola fase.
b) Las mezclas homogéneas.
ESTADOS DE LA MATERIA c) Aquellas conformadas por el mismo tipo de átomos.
d) Sólo los elementos químicos.
e) aquellas de composición química definida.
Son
8).- Indica cuántos de los siguientes procesos implican un cambio físico:
- Descomposición de la leche.
SOLIDO LIQUIDO GASEOSO PLASMATICO - Combustión de la gasolina.
- Derretimiento del hielo.
Su volumen es Su forma es Su densidad es Ejemplo: - Ruptura del vidrio
DEFINIDO VARIABLE VARIABLE ENERGETICO a) 0 b) 1 c) 2 d) 3 e) 4
IV. Desarrolla en tu cuaderno lo siguiente:
III. Subraya la alternativa correcta: ( ¼ pt. c/u)
1. Escribe 4 ejemplos de cada uno de los estados de la materia. Dibuja 2 de cada
1).- No son sustancias químicas puras: estado. (3 pts: ½ c/u)
2. Explica y dibuja 2 ejemplos cada una de las propiedades físicas y químicas de la
I. Agua oxigenada II. Leche magnesia III. Bronce IV. Aire.
materia. (2 pts: ¼ c/u)
a) Sólo IV b) Sólo III c) I y II d) I, II y IV e) Todas 3. Escribe 10 ejemplos de mezcla y dibuja 4 de ellas. (3,5 pts: ¼ c/u)
2).- Señala las especies químicas que no son elementos: 4. Vocabulario (1 pto c/u): oxidación, combustión, propiedad, vaporización,
I. Acero II. Diamante III. Sacarosa IV. Platino sublimación, licuación, ebullición, fenómeno.
a) Sólo I b) Sólo II c) II y IV d) I y III e) I, II y III
3).- No es una propiedad intensa de la materia:
a) Densidad b) T° de fusión c) Color d) Calor e) T° de ebullición
22 3º SECUNDARIA – I PERIODO - 2022
I.E. “GABRIEL MORENO” QUÍMICA
23 3º SECUNDARIA – I PERIODO - 2022
También podría gustarte
- Materia EjerciciosDocumento4 páginasMateria EjerciciosGamaniel Henry Asto FloresAún no hay calificaciones
- Separata La MateriaDocumento2 páginasSeparata La MateriaKamyla TorresAún no hay calificaciones
- QUIMICA-SEMANA XDDocumento3 páginasQUIMICA-SEMANA XDMaicol Harrinson O̲̲̅̅f̲̲̅̅ı̲̲̅̅c̲̲̅̅ı̲̲̅̅a̲̲̅̅l̲̲̅̅Aún no hay calificaciones
- QuímicaDocumento11 páginasQuímicaLuis Fernando RiveraAún no hay calificaciones
- La Materia 1° SecDocumento4 páginasLa Materia 1° SecDANIEL GONZALES DAVILAAún no hay calificaciones
- Introduccion A La Quimica, Materia, EnergiaDocumento6 páginasIntroduccion A La Quimica, Materia, EnergiaAlex Alfaro TorresAún no hay calificaciones
- Materia y Energia-PresnmDocumento6 páginasMateria y Energia-PresnmJorge Cesar Rojas RamosAún no hay calificaciones
- 1 MateriaDocumento7 páginas1 MateriaKarla Nicole Mendez RamosAún no hay calificaciones
- QUÍMICADocumento20 páginasQUÍMICALatex666Aún no hay calificaciones
- La MateriaDocumento7 páginasLa MateriaLinaMariaAriAún no hay calificaciones
- Guia N°1 Prequimica Noveno GradoDocumento2 páginasGuia N°1 Prequimica Noveno GradoAsistentequiposcc Colpatria100% (1)
- Capitulo 01 - Materia IDocumento15 páginasCapitulo 01 - Materia ICristhian Alexander Rafael BaylònAún no hay calificaciones
- Nivelación 01 - QuímicaDocumento6 páginasNivelación 01 - QuímicaCarla RodríguezAún no hay calificaciones
- QUÍMICADocumento7 páginasQUÍMICAYeshi ChAún no hay calificaciones
- El Mecanismo de La PrecipitacionDocumento6 páginasEl Mecanismo de La PrecipitacionJenifer MoraAún no hay calificaciones
- QUIM - 5to. Año - Guia #1 - La MateriaDocumento7 páginasQUIM - 5to. Año - Guia #1 - La MateriaCristopher Alama ZegarraAún no hay calificaciones
- Cta LatinoDocumento23 páginasCta LatinoJUAN FRANCISCO REATEGUI HERRERAAún no hay calificaciones
- La Materia 2do de SecundariaDocumento6 páginasLa Materia 2do de SecundariaAnonymous wQ4ReuHAún no hay calificaciones
- Quimica 1Documento7 páginasQuimica 1Luis PiscoyaAún no hay calificaciones
- Materiayme 1676143351Documento3 páginasMateriayme 1676143351scarAún no hay calificaciones
- Química Semana 2Documento5 páginasQuímica Semana 2Manuel Vega MaldonadoAún no hay calificaciones
- MONOGRAFIADocumento21 páginasMONOGRAFIATedi NoseAún no hay calificaciones
- MateriaDocumento5 páginasMateriamomamanihuAún no hay calificaciones
- La MateriaDocumento4 páginasLa Materiaemely guzmanAún no hay calificaciones
- Quimica CepruuDocumento109 páginasQuimica CepruuGermán Huaycho Grx100% (1)
- 3 Química C Y T 3ra ClaseDocumento5 páginas3 Química C Y T 3ra ClaseJuanAún no hay calificaciones
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaALFREDO PIMENTELAún no hay calificaciones
- Química Area ADocumento109 páginasQuímica Area ABlanquita La PazAún no hay calificaciones
- MateriaDocumento9 páginasMateriaLinaMariaAriAún no hay calificaciones
- 1 La MateriaDocumento6 páginas1 La MateriaJose H FariasAún no hay calificaciones
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaYulisa Zuniga BellidoAún no hay calificaciones
- Raimondi 1Documento18 páginasRaimondi 1Danerit huayllaniAún no hay calificaciones
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaMarcos ZuñigaAún no hay calificaciones
- Tema 2 QuimDocumento5 páginasTema 2 QuimAlexia Brilly Ascona AguilarAún no hay calificaciones
- QuimicaDocumento49 páginasQuimicaAnonymous OLB7Q3I80% (10)
- Clase de Quimica 2020Documento127 páginasClase de Quimica 2020Nielsen Aron Rodríguez sanez0% (1)
- QUIMICAAET2Documento4 páginasQUIMICAAET2TOCAS MALCA VICTOR ANDREAún no hay calificaciones
- S01 La MateriaDocumento4 páginasS01 La MateriaKarol Muñoz SAún no hay calificaciones
- Clase Modelo N°02 - QuímicaDocumento5 páginasClase Modelo N°02 - QuímicaJESUS MORALES ESPINOAún no hay calificaciones
- Cuaderno de Trabajo de Química-Preparación IDocumento29 páginasCuaderno de Trabajo de Química-Preparación Ijhoselyn zuñigaAún no hay calificaciones
- Cap. 2 - Propiedades MateriaDocumento10 páginasCap. 2 - Propiedades MateriaNELLY NICOLE PELAEZ RODRIGUEZAún no hay calificaciones
- QUIMICADocumento19 páginasQUIMICAAlberth Aguilar VilcaAún no hay calificaciones
- Sesion 01 Quimica Psicologia EstudiantesDocumento3 páginasSesion 01 Quimica Psicologia Estudiantesyadirapaucar266Aún no hay calificaciones
- RepasoquimicaDocumento27 páginasRepasoquimicaCristian Bradt Laborde NuñezAún no hay calificaciones
- Quimica y Biologia 2º AñoDocumento165 páginasQuimica y Biologia 2º AñoJose Elmo Via MalpartidaAún no hay calificaciones
- Clase 1 Química General 2022Documento6 páginasClase 1 Química General 2022ANGELL DANIEL MANTILLA SANCHEZAún no hay calificaciones
- FICHA DE MATERIA MEZCLA Ordenada ALUMNOSDocumento4 páginasFICHA DE MATERIA MEZCLA Ordenada ALUMNOSMilagritos Del Rosario Mija ParrillaAún no hay calificaciones
- Practica N°01 Química - Con ClavesDocumento7 páginasPractica N°01 Química - Con ClavesRaiza Romero FloresAún no hay calificaciones
- 10 Quimica 2023-IDocumento5 páginas10 Quimica 2023-Ialexmartinhuamanbarboza2Aún no hay calificaciones
- QUIMICATEODocumento161 páginasQUIMICATEOluis albertoAún no hay calificaciones
- 1) Materia y EnergiaDocumento5 páginas1) Materia y EnergiaPROF. DANNY CHAVEZAún no hay calificaciones
- Unidad I - Quimica GeneralDocumento9 páginasUnidad I - Quimica GeneralMilagros LeonAún no hay calificaciones
- Química - Selectos, Sem01Documento20 páginasQuímica - Selectos, Sem01구름CloudAún no hay calificaciones
- Taller Area QumicaDocumento5 páginasTaller Area QumicaJeffrie AlbaAún no hay calificaciones
- MateriaDocumento9 páginasMateriaGuillermo Hector Pascual100% (1)
- QUIMICADocumento110 páginasQUIMICAMAún no hay calificaciones
- I BIM Guía #5 - Tabla PeriódicaDocumento3 páginasI BIM Guía #5 - Tabla PeriódicaGamaniel Henry Asto FloresAún no hay calificaciones
- 2 S GenomaDocumento5 páginas2 S GenomaEli Q-lAún no hay calificaciones
- 4año C.E PropiedadesDocumento2 páginas4año C.E PropiedadesGamaniel Henry Asto FloresAún no hay calificaciones
- Trabajo de FuerzaDocumento2 páginasTrabajo de FuerzaGamaniel Henry Asto FloresAún no hay calificaciones
- Movimieto ParabolicoDocumento7 páginasMovimieto ParabolicosandraAún no hay calificaciones
- Dinamica 3b ProfesorDocumento3 páginasDinamica 3b ProfesorGamaniel Henry Asto FloresAún no hay calificaciones
- Estatica 1Documento3 páginasEstatica 1Gamaniel Henry Asto FloresAún no hay calificaciones
- POLEASDocumento3 páginasPOLEASGamaniel Henry Asto FloresAún no hay calificaciones
- Estatica IiDocumento2 páginasEstatica IiGamaniel Henry Asto FloresAún no hay calificaciones
- Fisi - Guía #5 - Movimiento Vertical de Caída Li Trabajo en GruposDocumento4 páginasFisi - Guía #5 - Movimiento Vertical de Caída Li Trabajo en GruposGamaniel Henry Asto FloresAún no hay calificaciones
- Josefina Zoraida Vázquez - Historia de MexicoDocumento10 páginasJosefina Zoraida Vázquez - Historia de MexicoDianaBonetti100% (1)
- Reevaluacion Cartografica Del Anticlinal de La CañadaDocumento19 páginasReevaluacion Cartografica Del Anticlinal de La CañadaJohn Mauricio Rico BautistaAún no hay calificaciones
- Inerrancia de La Escritura ¿Un Concepto Reformado?Documento6 páginasInerrancia de La Escritura ¿Un Concepto Reformado?Jorge JaramilloAún no hay calificaciones
- Desarrollo Histórico de La Seguridad IndustrialDocumento8 páginasDesarrollo Histórico de La Seguridad IndustrialEdi HernándezAún no hay calificaciones
- Formato PasantiasDocumento25 páginasFormato PasantiasLibrosCristianosAún no hay calificaciones
- Insuficiencia RespiratoriaDocumento23 páginasInsuficiencia RespiratoriaMiguel Angel Ramirez RamirezAún no hay calificaciones
- Semiología de La Piel y Anexos CutáneosDocumento88 páginasSemiología de La Piel y Anexos CutáneosSharon_n-AnnyeongAún no hay calificaciones
- Hemorragia CerebralDocumento29 páginasHemorragia CerebralRuth Aseret Gallegos PerroniAún no hay calificaciones
- Gran Memorial Del Conde Duque de OlivaresDocumento4 páginasGran Memorial Del Conde Duque de Olivaresrapevar100% (1)
- Estructura Seguimiento Integrada UP 2020Documento119 páginasEstructura Seguimiento Integrada UP 2020Alex Duque Ortega OrtizAún no hay calificaciones
- Clase 4 Normas APADocumento114 páginasClase 4 Normas APAfranciscaAún no hay calificaciones
- Tesis Impresion CeramicaDocumento92 páginasTesis Impresion CeramicaVictor TufinioAún no hay calificaciones
- Desarrollo de Una Aplicación Móvil Multiplataforma de Mensajería Instantanea para Agentes EmpresarialesDocumento103 páginasDesarrollo de Una Aplicación Móvil Multiplataforma de Mensajería Instantanea para Agentes EmpresarialesJose FranciscoAún no hay calificaciones
- Biometría HemáticaDocumento31 páginasBiometría HemáticaKarli Phanita67% (3)
- 50 Ejemplos de Asombro, Duda y Situaciones LímiteDocumento6 páginas50 Ejemplos de Asombro, Duda y Situaciones LímiteValeria Romina GalarzaAún no hay calificaciones
- Reflexion de La LuzDocumento5 páginasReflexion de La LuzEcology100% (1)
- Actividad 4Documento4 páginasActividad 4Angie Valentina TRUJILLO CABALLEROAún no hay calificaciones
- Didáctica de La Lengua y La Literatura en Educación InfantilDocumento305 páginasDidáctica de La Lengua y La Literatura en Educación InfantilMelany Toranzo100% (4)
- Plantillas de Rocas - BernardoVásquezDocumento47 páginasPlantillas de Rocas - BernardoVásquezBernardo Santiago VasquezAún no hay calificaciones
- Gille, Bertrand - Introduccion A La Historia de Las Tecnicas-1Documento103 páginasGille, Bertrand - Introduccion A La Historia de Las Tecnicas-1perebausa100% (1)
- Arte de BeberDocumento186 páginasArte de Beberalvarodominguez100% (1)
- Ebook La Risa en Las Experiencias de AprendizajeDocumento10 páginasEbook La Risa en Las Experiencias de AprendizajebarazarteernestoAún no hay calificaciones
- Expedición de Copias Certificadas de Documentos Agrarios en - Gob - MXDocumento2 páginasExpedición de Copias Certificadas de Documentos Agrarios en - Gob - MXComercializadora MayaAún no hay calificaciones
- La Fotografía en Diseño Gráfico (1) 2Documento72 páginasLa Fotografía en Diseño Gráfico (1) 2kip100% (1)
- Mecanismos HorizontalDocumento7 páginasMecanismos HorizontalCarlos RoblesAún no hay calificaciones
- Taller VivencialDocumento11 páginasTaller VivencialGriselda Torres PaivaAún no hay calificaciones
- Laboratorio Gel para CabelloDocumento2 páginasLaboratorio Gel para CabelloMauricio Quintero100% (1)
- La Misión de La UniversidadDocumento2 páginasLa Misión de La UniversidadWilmer Enrique Mejia MendezAún no hay calificaciones
- Guía 4 2023Documento3 páginasGuía 4 2023Liz MerlyAún no hay calificaciones
- Bienes CelestialesDocumento3 páginasBienes CelestialesJaguarPoe100% (1)