Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Separata La Materia
Cargado por
Kamyla TorresTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Separata La Materia
Cargado por
Kamyla TorresCopyright:
Formatos disponibles
ESCUELA PROFESIONAL DE EDUCACIÓN FÍSICA QUÍMICA
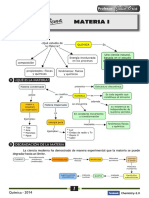
I. LA MATERIA 3.1. Propiedades físicas:
Son aquellas propiedades que se manifiestan sin alterar la estructura o composición de
la sustancia. Pueden ser:
1. ¿QUÉ ES LA MATERIA? 3.1.1. Propiedades extensivas (generales): Cuando la magnitud de dicha propiedad
depende de la cantidad de sustancia presente. Ejemplo: Masa, volumen, etc.
Es todo aquello que constituye el universo; tiene masa y extensión y su existencia es 3.1.2. Propiedades intensivas (específicas): Cuando la magnitud de dicha propiedad
independiente de nuestros sentidos. Ejemplo: Agua, sal de mesa, aire, alcohol, azúcar, es independiente de la cantidad de sustancia presente. Ejemplo: Densidad,
etc. temperatura, color, dureza, etc.
2. CLASIFICACIÓN DE LA MATERIA: 3.2. Propiedades químicas:
Son aquellas propiedades que se manifiestan alterando la estructura o composición de la
sustancia por acción de otra(s) o de un agente energético. Las propiedades químicas
MATERIA están referidas fundamentalmente a la reactividad química de las sustancias. Ejemplo:
El hierro (Fe) se oxida con el oxígeno (O2) del aire, mientras que el oro (Au) no se oxida.
4. FASES DE LA MATERIA:
SUSTANCIA MEZCLA
La materia se representa en el universo en 4 fases: sólido, líquido, gaseoso y plasmático.
Elemento Compuesto Homogénea Heterogénea FASE SÓLIDA FA
FA
FA>FR
2.1. Sustancia: F F
Fierro (Fe) R R
Es todo cuerpo o materia homogénea con composición química definida (posee fórmula
o representación simbólica). - Tiene volumen y forma definidos.
2.1.1. Elementos o sustancia simple: Es la materia conformada por átomos del mismo - Las partículas sólo experimentan movimiento vibratorio.
tipo. Ejemplo: Na, C, S, Sal, Ag, H2, O2, etc. - Los sólidos son incompresibles.
2.1.2. Compuesto o sustancia compuesta: Es la materia conformada por átomos de
diferentes elementos. Ejemplo: H2O, NaCl, NaOH, H2SO4, etc.
2.2. Mezcla:
Es la reunión de dos o más sustancias puras para formar otra si que pierdan sus FASE LÍQUIDA
características particulares iniciales. Pueden ser de dos tipos:
2.2.1. Mezcla homogénea o solución: Es la unión de dos o más sustancias puras, las FA=FR
cuales conforman una sola fase. Ejemplo: Agua salada (H2O + NaCl), bronce (Cu + F FA FA F
Sn), aire (N2, O2, H2, CO2, etc). R R
2.2.2. Mezcla heterogénea: Es la unión de dos o más sustancias puras las cuales
conforman varias fases. Ejemplo: Agua + cocoa, humo, arena + sal de mesa, etc. Agua Líquida (H2O)
- Tiene volumen definido y forma variable.
3. PROPIEDADES DE LA MATERIA:
- Las partículas experimentan movimientos vibratorios y de traslación.
Son aquellas que caracterizan a cada sustancia y permiten su diferenciación e
identificación con relación de otras sustancias. - Los líquidos son incompresibles.
20 MG. NORKA YAIPÈN VALDERRAMA
ESCUELA PROFESIONAL DE EDUCACIÓN FÍSICA QUÍMICA
6. FENÓMENO:
FASE GASEOSA Es todo cambio o transformación que ocurre en la naturaleza.
6.1. Fenómeno físico: El cambio ocurre sólo en la apariencia de la materia pero no en la
estructura interna de ella. Ejemplo: Cambio de estado del agua, ruptura de la madera.
F R > FA 6.2. Fenómeno químico: Se origina un cambio en la estructura interna de la materia, es
F F F F un proceso irreversible. Ejemplo: Quemar un papel, las reacciones químicas.
R A A R
6.3. Fenómeno alotrópico: Se presenta en ciertos elementos que al encontrarse en el
Oxígeno gaseoso (O2) mismo estado físico tienen dos o más formas con distintas propiedades. Ejemplo:
- Tiene volumen y forma variable. Alótropos
- Oxígeno (O2) Ozono (O3)
- Las partículas tiene mayor separación que en los líquidos debido a la FR
predominante, y experimentan un movimiento caótico.
Alótropos
- Los gases tiene alta comprensibilidad. - Carbón (C) Diamante (Cn)
- Fósforo blanco (P2) Alótropos Fósforo rojo (P4)
FASE PLASMÁTICA
❑ Es la fase que requiere de altas temperaturas (superiores a 20 000°C)
por lo que se constituye en el estado más energético que los anteriores.
❑ Está conformado de una mezcla de moléculas y átomos ionizados, así
como también de electrones.
❑ La fase plasmática es habitual en el sol y demás estrellas, así como
también en la formación de los volcanes.
NOTAS:
➢ FA = Fuerza de atracción intermolecular.
➢ FR = Fuerza de repulsión intermolecular.
➢ Las fases sólida, líquida y gaseosa son las más comunes a
condiciones ambientales y por lo tanto de mayor importancia.
5. CAMBIOS DE FASE:
La materia por efecto de variación de temperatura y presión puede cambiar de fase.
SUBLIMACIÓN
Fusión Vaporización
SÓLIDO LÍQUIDO GAS
Solidificación Licuación
DEPOSICIÓN O SUBLIMACIÓN INVERSA
21 MG. NORKA YAIPÈN VALDERRAMA
También podría gustarte
- Materia EjerciciosDocumento4 páginasMateria EjerciciosGamaniel Henry Asto FloresAún no hay calificaciones
- Informe 1 Codigo HuffmanDocumento11 páginasInforme 1 Codigo HuffmanMiguel RodriguezAún no hay calificaciones
- MateriaDocumento4 páginasMateriaGamaniel Henry Asto FloresAún no hay calificaciones
- QuímicaDocumento11 páginasQuímicaLuis Fernando RiveraAún no hay calificaciones
- QUIMICA-SEMANA XDDocumento3 páginasQUIMICA-SEMANA XDMaicol Harrinson O̲̲̅̅f̲̲̅̅ı̲̲̅̅c̲̲̅̅ı̲̲̅̅a̲̲̅̅l̲̲̅̅Aún no hay calificaciones
- Guia N°1 Prequimica Noveno GradoDocumento2 páginasGuia N°1 Prequimica Noveno GradoAsistentequiposcc Colpatria100% (1)
- La Materia 1° SecDocumento4 páginasLa Materia 1° SecDANIEL GONZALES DAVILAAún no hay calificaciones
- Química Semana 2Documento5 páginasQuímica Semana 2Manuel Vega MaldonadoAún no hay calificaciones
- QUÍMICADocumento20 páginasQUÍMICALatex666Aún no hay calificaciones
- 1 La MateriaDocumento6 páginas1 La MateriaJose H FariasAún no hay calificaciones
- Quimica 1Documento7 páginasQuimica 1Luis PiscoyaAún no hay calificaciones
- QUÍMICADocumento37 páginasQUÍMICAErnesto HuillcaAún no hay calificaciones
- Materiayme 1676143351Documento3 páginasMateriayme 1676143351scarAún no hay calificaciones
- La Materia 2do de SecundariaDocumento6 páginasLa Materia 2do de SecundariaAnonymous wQ4ReuHAún no hay calificaciones
- QUÍMICADocumento7 páginasQUÍMICAYeshi ChAún no hay calificaciones
- FICHA DE MATERIA MEZCLA Ordenada ALUMNOSDocumento4 páginasFICHA DE MATERIA MEZCLA Ordenada ALUMNOSMilagritos Del Rosario Mija ParrillaAún no hay calificaciones
- Cuaderno de Trabajo de Química-Preparación IDocumento29 páginasCuaderno de Trabajo de Química-Preparación Ijhoselyn zuñigaAún no hay calificaciones
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaALFREDO PIMENTELAún no hay calificaciones
- Introduccion A La Quimica, Materia, EnergiaDocumento6 páginasIntroduccion A La Quimica, Materia, EnergiaAlex Alfaro TorresAún no hay calificaciones
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaYulisa Zuniga BellidoAún no hay calificaciones
- Raimondi 1Documento18 páginasRaimondi 1Danerit huayllaniAún no hay calificaciones
- 1192 - File - QUIMICA SESION 1 TERCER TRIMESTREDocumento10 páginas1192 - File - QUIMICA SESION 1 TERCER TRIMESTREdeynamy480Aún no hay calificaciones
- Quimia - Tarea 1Documento6 páginasQuimia - Tarea 1Sharif Huarancca LagunaAún no hay calificaciones
- Materia y Energia-PresnmDocumento6 páginasMateria y Energia-PresnmJorge Cesar Rojas RamosAún no hay calificaciones
- MateriaDocumento9 páginasMateriaGuillermo Hector Pascual100% (1)
- Definicion de La Materia para Segundo de SecundariaDocumento8 páginasDefinicion de La Materia para Segundo de SecundariaMarcos ZuñigaAún no hay calificaciones
- Quimica Pre Ii (1era Clase)Documento7 páginasQuimica Pre Ii (1era Clase)Stuart AlmondAún no hay calificaciones
- Nivelación 01 - QuímicaDocumento6 páginasNivelación 01 - QuímicaCarla RodríguezAún no hay calificaciones
- 1 MateriaDocumento7 páginas1 MateriaKarla Nicole Mendez RamosAún no hay calificaciones
- Tema 2 QuimDocumento5 páginasTema 2 QuimAlexia Brilly Ascona AguilarAún no hay calificaciones
- Practica N°01 Química - Con ClavesDocumento7 páginasPractica N°01 Química - Con ClavesRaiza Romero FloresAún no hay calificaciones
- La MateriaDocumento7 páginasLa MateriaLinaMariaAriAún no hay calificaciones
- Qui MicaDocumento20 páginasQui MicaRangel Aldape Daniel GiovanniAún no hay calificaciones
- Quimica 2y3 Sesion 1 VacDocumento7 páginasQuimica 2y3 Sesion 1 VacYanina Salazar VelardeAún no hay calificaciones
- Quimica y Biologia 2º AñoDocumento165 páginasQuimica y Biologia 2º AñoJose Elmo Via MalpartidaAún no hay calificaciones
- Cta LatinoDocumento23 páginasCta LatinoJUAN FRANCISCO REATEGUI HERRERAAún no hay calificaciones
- RepasoquimicaDocumento27 páginasRepasoquimicaCristian Bradt Laborde NuñezAún no hay calificaciones
- Quimica General 2Documento163 páginasQuimica General 2Altagracia UlloaAún no hay calificaciones
- QuimicaDocumento8 páginasQuimicaMaite ChucaAún no hay calificaciones
- Unidad I - Quimica GeneralDocumento9 páginasUnidad I - Quimica GeneralMilagros LeonAún no hay calificaciones
- Semana 01. MateriaDocumento9 páginasSemana 01. MateriaChristopper Vasquez CrispinAún no hay calificaciones
- 1) Materia y EnergiaDocumento5 páginas1) Materia y EnergiaPROF. DANNY CHAVEZAún no hay calificaciones
- 10 Quimica 2023-IDocumento5 páginas10 Quimica 2023-Ialexmartinhuamanbarboza2Aún no hay calificaciones
- Sesion 4 - 5 Horas-Características y Clases de MateriaDocumento31 páginasSesion 4 - 5 Horas-Características y Clases de MateriaIng Ronald PortalesAún no hay calificaciones
- Capitulo 01 - Materia IDocumento15 páginasCapitulo 01 - Materia ICristhian Alexander Rafael BaylònAún no hay calificaciones
- Clase 1 Química General 2022Documento6 páginasClase 1 Química General 2022ANGELL DANIEL MANTILLA SANCHEZAún no hay calificaciones
- 3 Química C Y T 3ra ClaseDocumento5 páginas3 Química C Y T 3ra ClaseJuanAún no hay calificaciones
- QUIM - 5to. Año - Guia #1 - La MateriaDocumento7 páginasQUIM - 5to. Año - Guia #1 - La MateriaCristopher Alama ZegarraAún no hay calificaciones
- Quimica y MateriaDocumento36 páginasQuimica y Materiaclaudia vaneAún no hay calificaciones
- Propiedades de La MateriaDocumento8 páginasPropiedades de La MateriaAlexander Rodrigo Pinedo CayoAún no hay calificaciones
- Química Area ADocumento109 páginasQuímica Area ABlanquita La PazAún no hay calificaciones
- MONOGRAFIADocumento21 páginasMONOGRAFIATedi NoseAún no hay calificaciones
- Quimica CepruuDocumento109 páginasQuimica CepruuGermán Huaycho Grx100% (1)
- Unidad 1 Sistemas MaterialesDocumento40 páginasUnidad 1 Sistemas MaterialesNatalia Barrios.Aún no hay calificaciones
- 1 - MateriaDocumento6 páginas1 - MateriaChumbes LizethAún no hay calificaciones
- Materia y ENERGÍADocumento34 páginasMateria y ENERGÍARuben AragonAún no hay calificaciones
- FICHA - Materia 1eroDocumento4 páginasFICHA - Materia 1eroMelissaAún no hay calificaciones
- Química Area BDocumento109 páginasQuímica Area BLenin GonzaloAún no hay calificaciones
- Cardiologia PreventivaDocumento5 páginasCardiologia PreventivaKamyla TorresAún no hay calificaciones
- Quien Creó La Normativa Del BienDocumento3 páginasQuien Creó La Normativa Del BienKamyla TorresAún no hay calificaciones
- Caracterización Del Perfil Antropométrico en Deportistas Juveniles de Halterofilia, Boxeo y Lucha Olímpica en Competencia Regional Año 2018 Del Urabá AntioqueñoDocumento10 páginasCaracterización Del Perfil Antropométrico en Deportistas Juveniles de Halterofilia, Boxeo y Lucha Olímpica en Competencia Regional Año 2018 Del Urabá AntioqueñoKamyla TorresAún no hay calificaciones
- Práctica Del Sistema NerviosoDocumento2 páginasPráctica Del Sistema NerviosoKamyla TorresAún no hay calificaciones
- Aparato Reproductor FemeninoDocumento2 páginasAparato Reproductor FemeninoKamyla TorresAún no hay calificaciones
- Codigo Deontologico de La ProfesionDocumento22 páginasCodigo Deontologico de La ProfesionKamyla TorresAún no hay calificaciones
- Entreglable 1Documento1 páginaEntreglable 1Kamyla TorresAún no hay calificaciones
- Declaración de Singapur 2010Documento2 páginasDeclaración de Singapur 2010Kamyla TorresAún no hay calificaciones
- Enfoque Pedagogico en El ContructivismoDocumento7 páginasEnfoque Pedagogico en El ContructivismoKamyla TorresAún no hay calificaciones
- Sistema NerviosoDocumento3 páginasSistema NerviosoKamyla TorresAún no hay calificaciones
- La Escuela FrancesaDocumento2 páginasLa Escuela FrancesaKamyla TorresAún no hay calificaciones
- Pract N°2 ConjuntosDocumento2 páginasPract N°2 ConjuntosKamyla TorresAún no hay calificaciones
- Wuolah Free Modelo Lineal GeneralDocumento5 páginasWuolah Free Modelo Lineal GeneralRoberto García AguilarAún no hay calificaciones
- 1 MatemáticasDocumento8 páginas1 MatemáticasYULYS CAROLINA FERNANDEZ CAICEDOAún no hay calificaciones
- ALFADocumento9 páginasALFAJorge OsorioAún no hay calificaciones
- If MNDocumento8 páginasIf MNKevin VegaAún no hay calificaciones
- Curriculum Junio-2022 PVADocumento8 páginasCurriculum Junio-2022 PVAmateoAún no hay calificaciones
- Propiedades de Los Minerales OpacosDocumento5 páginasPropiedades de Los Minerales OpacosMauricio Yangaly RamosAún no hay calificaciones
- Armaduras 2DDocumento16 páginasArmaduras 2DLuis A. Llantoy RojasAún no hay calificaciones
- Producción de Energía A Partir de Celdas de HidrogenoDocumento38 páginasProducción de Energía A Partir de Celdas de HidrogenoAldo Celaya TonchezAún no hay calificaciones
- Manual Sistema Suspension Direccion Frenos Partes Componentes Clasificacion MecanismoDocumento19 páginasManual Sistema Suspension Direccion Frenos Partes Componentes Clasificacion MecanismoCristhian CenturiónAún no hay calificaciones
- Taller 1 BiologíaDocumento7 páginasTaller 1 BiologíaLaura MajeAún no hay calificaciones
- La Geología Histórica Se Ocupa de La Reconstrucción Del Pasado de LaDocumento2 páginasLa Geología Histórica Se Ocupa de La Reconstrucción Del Pasado de LaLucía Cazalla De la BarreraAún no hay calificaciones
- Calderas Calculos VariosDocumento40 páginasCalderas Calculos VariosLUIS DAVID GUERRA ALVARADOAún no hay calificaciones
- Informe Técnico LumDocumento11 páginasInforme Técnico LumJavier AltamiranoAún no hay calificaciones
- Laboratorio 8 - Quimica Organica IiDocumento7 páginasLaboratorio 8 - Quimica Organica IiAndrea JimenezAún no hay calificaciones
- Algoritmo GeneticoDocumento46 páginasAlgoritmo GeneticoFrank AlvarezAún no hay calificaciones
- Automatización-Torre de EnfriamientoDocumento3 páginasAutomatización-Torre de EnfriamientoAldo MendozaAún no hay calificaciones
- Test HierroDocumento1 páginaTest HierroDiego Jose CortesAún no hay calificaciones
- BOURDIEU Espacio Social y La Genesis de Las ClasesDocumento29 páginasBOURDIEU Espacio Social y La Genesis de Las ClasesJuan FernandoAún no hay calificaciones
- Separata 2Documento9 páginasSeparata 2Eliazar Vigoria OyolaAún no hay calificaciones
- 1ºeso AlumnoDocumento100 páginas1ºeso AlumnoAlejandro vaquerizoAún no hay calificaciones
- Practica #2 Lineas de EquilibrioDocumento15 páginasPractica #2 Lineas de EquilibrioErikaCorderoLópezAún no hay calificaciones
- Articles-28141 Recurso Pauta PDFDocumento2 páginasArticles-28141 Recurso Pauta PDFrousesAún no hay calificaciones
- Diferencia de LatitudesDocumento3 páginasDiferencia de LatitudesJose Leonardo Vega OchoaAún no hay calificaciones
- Sistemas Egr y SCR en Motor Scania DieselDocumento25 páginasSistemas Egr y SCR en Motor Scania DieselJob Esp100% (1)
- BioestadísticaDocumento6 páginasBioestadísticaEl Amor De Tu Vida100% (3)
- Unidad Didactica 4 - 3Documento71 páginasUnidad Didactica 4 - 3Manuel Fit Wachalla RamirezAún no hay calificaciones
- Tema Los GasesDocumento23 páginasTema Los GasesSamir BenAún no hay calificaciones
- Fase 3Documento17 páginasFase 3Yilberth Jose Meza MuñozAún no hay calificaciones
- NCh-ISO 22117-2013-043 PDFDocumento41 páginasNCh-ISO 22117-2013-043 PDFSandra RamirezAún no hay calificaciones