UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
INTRODUCCION
Las titulaciones acido-base, y todas las que existan, son fundamentales, ya que nos permiten verificar la exactitud de las concentraciones de las muestras preparadas en laboratorio, y as obtener resultados perfectos en las investigaciones en las que utilizamos estos reactivos. La titulacin se basa en que en el punto de equilibrio, los equivalentes del estndar son iguales alos equivalentes del titulante, y en ese punto se detiene la titulacin. Pero que es lo que nos ayuda a visualizar ese punto de equilibrio entre el titulante y el estndar, ya que en la mayora de casos los dos son de colores indistintos y de comportamien diferentes. tos Para solucionar esto se utilizaran los INDICADORES, los cuales son sustancias coloreadas, que nos permiten visualizar el punto de equilibrio, ya que estos tienen comportamientos diferentes, si se encuentran en medio acido o en medio bsico, cambiando su coloracin segn estos casos. Los indicadores son especficos para ciertas reacciones y para ciertos estndares, ya que de cada uno de estos su rango de pH es diferente, y esto hace que no se puedan utilizarse en todas las reacciones. Los objetivos de la prctica se centran en determinar el rango de pH en un indicador especfico (rojo de metilo), determinar su comportamiento en los medios cidos y bsicos.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
MARCO TEORICO:
HISTORIA: En 1909, el qumico dans Sorensen defini el potencial hidrgeno (pH) como el logaritmo negativo de la concentracin molar (mas exactamente de la actividad molar) de los iones hidrgeno. Esto es:
pH = - log [H +]
Desde entonces, el trmino pH ha sido universalmente utilizado por la facilidad de su uso, evitando asi el manejo de cifras largas y complejas. Por ejemplo, una concentracin de [H +] = 1x10-8 M (0.00000001) es simplemente un pH de 8 ya que: pH= - log[10 -8] = 8. La relacin entre pH y concentracin de iones H se puede ver en la siguiente tabla, en la que se incluyen valores tpicos de algunas sustancias conocidas:
ALMACENAJE DE LA MUESTRA Las muestras para determinar pH, debern ser tomadas en recipientes de polipropileno y asegurndose que estn bien tapadas, se recomienda analizar el pH lo ms pronto posible y evitar la exposicin al aire, en especial las muestras de aguas alcalinas, ya que el CO 2 del aire, tiende a reaccionar con la alcalinidad de la muestra y variar su pH.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
CAMPO DE APLICACIN Este mtodo de prueba se utiliza para la determinacin rutinaria del pH en agua, a condiciones controladas de laboratorio. PRINCIPIOS La determinacin del pH en el agua es una medida de la tendencia de su acidez o de su alcalinidad. No mide el valor de la acidez o alcalinidad (vea el mtodo de determinacin de alcalinidad). Un pH menor de 7.0 indica una tendencia hacia la acidez, mientras que un valor mayor de 7.0 muestra una tendencia hacia lo alcalino. La mayora de las aguas naturales tienen un pH entre 4 y 9, aunque muchas de ellas tienen un pH ligeramente bsico debido a la presencia de carbonatos y bicarbonatos. Un pH muy cido o muy alcalino, puede ser indicio de una contaminacin industrial. El valor del pH en el agua, es utilizado tambin cuando nos interesa conocer su tendencia corrosiva o incrustante, y en las plantas de tratamiento de agua. Este mtodo determina el pH , midiendo el potencial generado ( en milivolts ) por un electrodo de vidrio que es sensible a la actividad del in H+ , este potencial es comparado contra un electrodo de referencia, que genera un potencial constante e independiente del pH. El electrodo de referencia que se utiliza es el de calomel saturado con cloruro de potasio, el cual sirve como puente salino que permite el paso de los milivolts generados hacia al circuito de medicin. La cadena electroqumica de este sistema d e medicin es :
Hg / Hg2Cl2-Sol Sat KCl // Vidrio/HCl 0.1N/Ag-AgCl
En el siguiente esquema se muestran los electrodos utilizados:
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
INTERFERENCIAS El electrodo de vidrio es relativamente inmune a las interferencias del color, turbidez, material coloidal, cloro libre, oxidantes y reductores. La medicin se afecta cuando la superficie de la membrana de vidrio esta sucia con grasa o material orgnico insoluble en agua, que le impide hacer contacto con la muestra, por lo anterior se recomienda la limpieza escrupulosa de los electrodos. En muestras de un pH mayor a 10 , se presenta el error del sodio, el cual puede ser reducido utilizando electrodos esp eciales de bajo error de sodio y haciendo las correcciones indicadas en el instructivo del electrodo. La temperatura tiene dos efectos de interferencia, el potencial de los electrodos y la ionizacin de la muestra varian. El primer efecto puede compensars e haciendo un ajuste en el botn de la " temperatura" que tienen todos los aparatos. El segundo efecto es inherente de la muestra y solo se toma en consideracin, anotando la temperatura de la muestra y su pH; para ms exactitud, se recomienda que la muestra est a 25 C, que es la temperatura de referencia para la medicin del pH. APARATOS Medidor de pH de laboratorio: La tabla siguiente, muestra las caractersticas tpicas ms importantes de cuatro tipos de aparatos. Cualquier aparato, junto con sus electrodos asociados (vidrio y referencia), pueden ser usados, la eleccin ser de acuerdo a la precisin deseada en la medicin,
TIPO I TIPO II Escala normal Escala expandida Divisin de la escala Exactitud Repetibilidad Correccin por Temp Manual o Automtica Intervalo en C Divisin menor C 0 a 14 . 0.1 0 a 14 0.01
TIPO III 0 a 14 0.01 +/- 0.007 +/- 0.002 . si 0 a 100 2 si
TIPO IV 0 a 14.000 0.001 +/- 0.002 +/- 0.002 . si 0 a 100 2 si
2 unidades de pH 1.4 unidades de pH .
+/- 0.05 +/- 0.01 +/- 0.02 +/- 0.005 . si 2 . si 2 si
0 a 100 0 a 100
Correccin - pendiente -
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
FABRICANTES y Material Material comn de laboratorio para contener la muestra y las soluciones para calibrar: Vasos de precipitado, probetas ya sean de vidrio o de plstico. y Reactivos Solucin amortiguadora de pH 4.00 a 25 C
Disolver 10.12 g de biftalato de potasio ( KHC4H4O6 ) en agua destilada y diluya a un litro. Solucin amortiguadora de pH 6.86 a 25 C Disolver 3.39 g de Fosfato mono potsico ( KH2PO4 ) y 3.53 g de Fosfato disdico anhidro ( Na 2HPO4) en agua destilada y diluya a un litro. Solucin amortiguadora de pH 9.18 a 25 C Disolver 3.80 g de Tetra borato de sodio decahidratado ( Na 3B4O7.10H2O ) en agua destilada y diluya a un litro. Estas soluciones deben prepararse con agua destilada y recin hervida durante 15 minutos y enfriada, lo anterior es para eliminar la contaminacin del CO 2 disuelto en el agua y evitar crecimientos microbianos.
Los fosfatos de sodio y potasio y el biftalato de potasio se deben secar a 110C durante 2 horas antes de pesarlas.
El tetraborato de sodio decahidratado ( Borax ) no debe ser secado a la estufa.
Las soluciones amortiguadoras preparadas, se deben guardar en frascos de vidrio o de polipropileno, bien tapadas y prepararse cada mes.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
Estandarizacin 1. Prenda el medidor de pH y permita que se caliente 2. Mida la temperatura de la solucin amortiguadora de pH 6.86 y ajuste el medidor con el botn de Temperatura 3. Inserte los electrodos en la solucin de pH 6.86 y ajuste el pH a este valor en el medidor con el botn de calibrar 4. Elevar y enjuagar los electrodo con agua destilada 5. Inserte los electrodos en la solucin de pH 4.00 y ajuste el pH a este valor en el medidor con el botn de Pendiente ( Slope ) 6. Elevar y enjuagar los electrodos con agua destilada.
Procedimiento Una vez calibrado el aparato de medicin de pH, se procede a la medicin de la muestra: 1. Mida la temperatura de la muestra y ajuste el medidor con el botn de Temperatura 2. Inserte los electrodos en la muestra y lea el pH correspondiente 3. Elevar y enjuagar los electrodo con agua destilada 4. Almacenar los electrodos en solucin amortiguadora de pH 7 o menor.
Clculos: Anotar el valor del pH con las cifras significativas de acuerdo a la precisin del medidor de pH que se est utilizando. Anotar tambin la tem peratura de la muestra al determinarle el pH.
Precisin: La precisin que se puede obtener con una cuidadosa calibracin del aparato y electrodos, ser de +/- 0.05 unidades de pH
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
MATERIALES Y METODOS:
MATERIALES:
02 fiolas de 50 ml.
04 matraces erlemenyer de 150 ml.
01 pizeta
Materiales de limpieza
04 pipetas graduadas de 1 ml o de 0.5 ml
01 gotero
02 vasos de precipitados de 150 ml.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
EQUIPOS:
pH metro
REACTIVOS:
Hidrxido de sodio 0.1 M
Cloruro de hidrgeno 0.1 M
Alcohol etlico
INDICADORES:
y y y y y y y y Fenolftalena Cristal violeta Verde de bromocresol Azul de bromotimos Rojo de fenol Rojo de metilo Curcumina Anaranjado de metilo
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
METODOS:
� � Cada grupo preparar 50 ml. de HCl 0.01 M y 50 Ml. de NaOH 0.1 M, trasvasar en un frasco y etiquetar. Igualmente, cada grupo, preparar 25 ml. de un indicador cido -base a una concentracin 0.1 % p/v, a excepcin de la fenolftalena que deber ser al 1 % p/v. � � Luego de pesar el indicador, trasvasar a la fiola y ag regar agua destilada aproximadamente hasta las terceras partes de la fiola, agitar. Si el indicador no se disuelve, agregar alcohol etlico hasta tres cuartas partes de la fiola y agitar hasta que se disuelva, luego enrasar con el alcohol o el agua. � Colocar en cada matraz erlenmeyer 10 ml, de HCl y en otro matraz 10 mL. de NaOH. Agregar a cada matraz erlenmeyer 2 gotas del indicador preparado por el grupo; a continuacin observar los colores que se forman en medio cido y bsico. � Con las pipetas de 5 ml. agregar cuidadosamente el otro reactivo, para que se lleve a cabo una reaccin cido -base. Agregar hasta el momento en que la primera gota comience a cambiar de color. � � � � Medir el pH(ser el primer lmite) Con las pipetas de 1 ml. agregar con bastante cui dado hasta que se defina un color estable. Medir el pH(ser el segundo lmite) Si no se puede determinar correctamente los pH, se puede agregar unas cuantas gotas del cido, si se quiere bajar el pH, o de la base se quiere subir el pH y se puede buscar nuevamente el cambio exacto de color para medir el PH. � Cada grupo colocar en la pizarra los rangos de pH determinados en la prctica, e indicar el color en la zona cida, en su zona alcalina y el color en el rango. � Luego el profesor entregar a cada grupo una solucin problema para que determinen el pH que tiene, para lo cual se utilizar los indicadores preparados por los diferentes grupos.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
RESULTADOS Y DISCUSIONES:
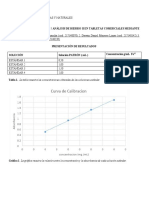
Resultados: 1) Al momento de echar las 2 gotas del indicador, rojo de metilo, a la solucin de NaOH 0,1 M observamos que tomo el color amarillo y cuando empezamos a titular con HCl se hizo rosado. 2) A la solucin de HCl le agregamos 2 gotas del mismo indicador y se hizo rosado y al agregar NaOH se hizo amarillo plido. Es decir fue todo lo contrario al primero. 3) Por ltimo medimos el pH de las soluciones y los resultados fueron: De la base: NaOH Ph= 3,7 Del acido: HCl ph = 10, 20 indicador Rojo de metilo rango 3,7- 10,20 acido amarillo base rosado
Discusiones: Medida de calidad de agua: el pH La calidad del agua y el pH son a menudo mencionados en la misma frase. El pH es un factor muy importante, porque determinados procesos qumicos solamente pueden tener lugar a un determinado pH. Por ejemplo, l as reacciones del cloro solo tienen lugar cuando el pH tiene un valor de entre 6,5 y 8. El pH es un indicador de la acidez de una sustancia. Est determinado por el nmero de iones libres de hidrgeno (H+) en una sustancia. La acidez es una de las propiedades ms importantes del agua. El agua disuelve casi todos los iones. El pH sirve como un indicador que compara algunos de los iones ms solubles en agua. El resultado de una medicin de pH viene determinado por una consideracin entre el nmero de protones (iones H +) y el nmero de iones hidroxilo (OH-). Cuando el nmero de protones iguala al nmero de iones hidroxilo, el agua es neutra. Tendr entonces un pH alrededor de 7. El pH del agua puede variar entr 0 y 14. Cuando el ph de una sustancia es mayor de 7, es una sustancia bsica. Cuando el pH de una sustancia est por debajo de 7, es una sustancia cida. Cuanto ms se aleje el pH por encima o por debajo de 7, ms bsica o cida ser la solucin. El pH es un factor logartmico; cuando una solucin se vuelve diez veces ms cida, el pH disminuir en una unidad. Cuando una solucin se vuelve cien veces ms cida, el pH disminuir en dos unidades. El trmino comn para referirse al pH es la alcalinidad.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
Mtodos de determinacin del pH Existen varios mtodos diferentes para medir el pH. Uno de estos es usando un trozo de papel indicador del pH. Cuando se introduce el papel en una solucin, cambiar de color. Cada color diferente indica un valor de pH diferente. Este mtodo no es muy preciso y no es apropiado para determinar valores de pH exactos. Es por eso que ahora hay tiras de test disponibles, que son capaces de determinar valores ms pequeos de pH, tales como 3.5 o 8.5. El mtodo ms preciso para determinar el pH es midiendo un cambio de color en un experimento qumico de laboratorio. Con este mtodo se pueden determinar valores de pH, tales como 5.07 and 2.03.Ninguno de estos mtodos es apropiado para determinar los cambios de pH con el tiempo. El electrodo de pH Un electrodo de pH es un tubo lo suficientemente pequeo como para poder ser introducido en un tarro normal. Est unido a un pH-metro por medio de un cable. Un tipo especial de fluido se coloca dentro del electrodo; este es normalmente cloruro de potasio 3M. Algunos electrodos contienen un gel que tiene las mismas propiedades que el fluido 3M. En el fluido hay cables de plata y platino. El sistema es bastante frgil, porque contiene una pequea membrana. Los iones H+ y OH- entrarn al electrodo a travs d e esta membrana. Los iones crearn una carga ligeramente positiva y ligeramente negativa en cada extremo del electrodo. El potencial de las cargas determina el nmero de iones H+ y OH- y cuando esto haya sido determinado el pH aparecer digitalmente en el pH-metro. El potencial depende de la temperatura de la solucin. Es por eso que el pH -metro tambin muestra la temperatura. cidos y bases Cuando los cidos entran en contacto con el agua, los iones se separan. Por ejemplo, el cloruro de hidrgeno se disociar en iones hidrgeno y cloro (HCL-- H++CL-). Las bases tambin se disocian en sus iones cuando entran en contacto con el agua. Cuando el hidrxido de sodio entra en el agua se separar en iones de sodio e hidroxilo (NaOH-- Na+ + OH- ).
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
Cuando una sustancia cida acaba en el agua, le ceder a sta un protn. El agua se volver entonces cida. El nmero de protones que el agua recibir determina el pH. Cuando una sustancia bsica entra en contacto con el agua captar protones. Esto bajar el pH del agua. Cuando una sustancia es fuertemente cida ceder ms protones al agua. Las bases fuertes cedern ms iones hidroxilo.
Se ha determinado que el rojo de metilo en un medio cido es de color rosado y en un medio bsico es de color amarillo, teniendo en cuenta que tiene un pka de 5.1 y el rango de pH es de 4.2-6.3; sin embargo en nuestras muestras de acido clorhdrico e hidrxido de sodio el rango de pH es de 3.70-10.20 lo cual significa que no paramos la titulacin en el momento exacto en el cual cambio de color. El rojo de metilo es un indicador de pH. (Frmula: C15H15N3O2) el rojo de metilo se prepara con 0,1 g de este reactivo en alcohol metlico y se diluye en 100 ml de metanol. Una reaccin positiva (ms o menos) indica que el microorganismo realiza una fermentacin acido lctica de la glucosa por la va cido -mixta. (Segn Palma, J.J. C. (2005) Qumica Analtica).
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
CONCLUSIONES:
� Podemos concluir que el rango de pH del rojo de metilo es de 4.2 - 6.3; tiene un pka de 5.1 y que ese indicador se debe disolver con alcohol. � Que a la solucin de acido clorhdrico cuando se le agrega el indicador que es el rojo de metilo toma un color rosa dbil y cuando se le agrega hidrxido de sodio es de color amarillo plido teniendo un pH de 10.20.lasolucion de hidrxido de sodio es de color amarillo, pero cuando se le agrega acido clorhdrico es de color rosado dbil teniendo un pH de 3.70.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
BIBLIOGRAFIA:
� Palma, J.J. C. (2005) Qumica Analtica). � Harris D. (2007) Anlisis Qumico Cuantitativo. Tercera edicin. � Palma, J.C. (2005) .Qumica Analtica. Ensayos de laboratorio . � Fritz, J. S. y Schenk, G. H. (1989) Qumica Analtica Cuantitativa. Tercera edicin.
DETERMINACIN DEL RANGO DE PH EN INDICADORES
�UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU
FAC. DE INGENIERA ALIMENTARIAS
EN
IND.
CUESTIONARIO:
I. LOS RESULTADOS OBTENIDOS POR SU GRUPO, COINCIDEN CON LOSQUE REPORTAN LOS LIBROS? JUSTIFIQUE.
El rango de pH obtenido por el grupo en el caso del rojo de metilo fue de 3.7 a 10.20, mientras que en los libr os este rango es de 4.2 a 6.3. El margen de error pudo ocurrir por varios factores, uno de ellos es que nuestro grupo no se encargo de preparar todas las soluciones, y pudo haber errores en la preparacin o en los clculos.
II. COMO SE PODRIA HALLAR EN LA PRACTICA EL pKa DEL INDICADOR.
Teniendo las concentraciones del indicador y conociendo en que situaciones este se disocia en iones. Sacando logaritmo a ambos miembros de la formula:
De esta frmula se despeja el Ka y as se podra obtener el pKa del indicador.
III. INDIQUE TODAS LAS CARACTERISTICAS DE IMPORTANCIA PARA LA PREPARACION DE UNA SOLUCION CON EL INDICADOR COMO LO HIZO EN LA PRACTICA.
Es importante saber preparar los indicadores, ya que, estos sirven para indicar el punto de equilibrio, y una m ala preparacin puede alterar el pH de la solucin a titular y cambiar totalmente los resultados en la titulacin.
DETERMINACIN DEL RANGO DE PH EN INDICADORES