Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cinética Química Gráficas 1
Cargado por
karencDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cinética Química Gráficas 1
Cargado por
karencCopyright:
Formatos disponibles
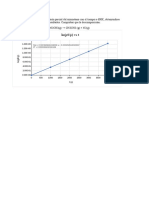
t(s) [H2O2] (M)
0 2.32 Cinética química t(s) vs (M)
400 1.72 2.6
800 1.3 2.4
[H2O2] (M)
2.2 f(x) = − 6.155303030303E-11 x³ + 4.90665584415583E-07 x² − 0.00161904761904762 x + 2.31136363636
1200 0.98 R² = 0.999789933611268
2
1600 0.73
1.8
2000 0.54
1.6
2400 0.39
1.4
2800 0.28 1.2
1
0.8
0.6
0.4
0.2
0
0 150 300 450 600 750 900 1050 1200 1350 1500 1650 1800 1950 2100 2250
t (s)
(a) Velocidad inicial
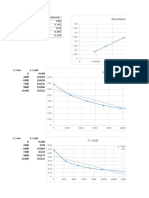
t(s) [H2O2] (M) t(s)
Punto 1 0 2.32 m = ∆y/∆x Punto 1 640
Punto 2 1390 0 1.669E-03 Ms -1
Punto 2 900
(b) Concentración para t=100s
1,669E-03Ms^(-1)=-∆[H_(2 ) O_(2 ) ]/100s →-(1,669E-03Ms^(-1) (100s))=∆[H_2 O_2 ]→
∆[H_2 O_2 ]=[H_2 O_2 ]_f -[H_2 O_2 ]_i=-0,1669M→[H_2 O_2 ]_f = -0,1669M+2,32M → [H_2 O_2
]_f =2,153M
Rapidez instantánea
[H_2 O_2 ]=-6x10^(-11) t^3+5x10^(-7) t^2-0,0016t+2,3114
d[H_2 O_2 ]/dt=-1,8x10^(-10) t^2+1x10^(-6) t-0,0016
r=-(-1,8x 〖 10 〗 ^(-10) t^2+1x 〖 10 〗 ^(-6) t-0,0016)
t(s) [H2O2] (M) [H2O2] (M) r (M/s)
0 2.32 2.32 0.0016 [H2O2] (M
400 1.72 1.72 0.0012288 0.0018
800 1.3 1.3 0.0009152 0.0016
f(x) = 0.00071265553265
r (M/s)
1200 0.98 0.98 0.0006592 0.0014 R² = 0.996660706776011
1600 0.73 0.73 0.0004608 0.0012
2000 0.54 0.54 0.00032 0.001
2400 0.39 0.39 0.0002368 0.0008
2800 0.28 0.28 0.0002112 0.0006
0.0004
0.0002
Constante de proporcionalidad (k)
0
k = 0,0007 Ms-1 0 0.5 1
0.0004
0.0002
0
0 0.5 1
a t(s) vs (M)
00161904761904762 x + 2.31136363636364
Velocidad promedio
Para t = 800s 0.001275 Ms-1
Para t = 1600s 0.00099375 Ms-1
500 1650 1800 1950 2100 2250 2400 2550 2700 2850 3000
(s)
Velocidad instantánea en dos puntos
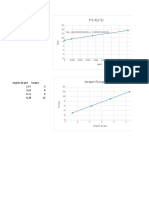
[H2O2] (M) t(s) [H2O2] (M)
1.44 m=∆y/∆x Punto 1 1498 0.77 m=∆y/∆x
1.2 9.231E-04 Ms -1
Punto 2 1670 0.69 4.651E-04 Ms-1
H_2 O_2 ]→
M → [H_2 O_2
[H2O2] (M) vs r(M/s)
18
16
f(x) = 0.000712655532655817 x − 3.18168374671311E-05
14 R² = 0.996660706776011
12
01
08
06
04
02
0
0 0.5 1 1.5 2 2.5
[H2O2] (M)
04
02
0
0 0.5 1 1.5 2 2.5
[H2O2] (M)
También podría gustarte
- Ley de HookeDocumento17 páginasLey de HookeeduardoadiazAún no hay calificaciones
- Práctica 4 CinéticaDocumento14 páginasPráctica 4 CinéticaCarolina Caballero MedinaAún no hay calificaciones
- Tarea Semana 4Documento7 páginasTarea Semana 4Milenka Lema BayasAún no hay calificaciones
- Examen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeDocumento7 páginasExamen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeAdrian QuispeAún no hay calificaciones
- Ahora Si PDocumento4 páginasAhora Si Psophia CaiAún no hay calificaciones
- Graficas LabDocumento15 páginasGraficas LabvaleriaAún no hay calificaciones
- Absorción IIDocumento5 páginasAbsorción IIMontseAún no hay calificaciones
- Orden de Reacción ExperimentalDocumento5 páginasOrden de Reacción ExperimentalRicardo AlcivarAún no hay calificaciones
- Problemas Secado Segundo DepartamentalDocumento5 páginasProblemas Secado Segundo DepartamentalLuis FabianAún no hay calificaciones
- $R4C0SC3Documento22 páginas$R4C0SC3yairAún no hay calificaciones
- Intercambio Ionico CálculosDocumento12 páginasIntercambio Ionico Cálculosrcuzco8Aún no hay calificaciones
- P3 TEQ TerminadaDocumento3 páginasP3 TEQ Terminadajuan pablo diaz loezaAún no hay calificaciones
- Analisis Problema 2 BrownDocumento8 páginasAnalisis Problema 2 BrownSamaraAún no hay calificaciones
- Taller IiiDocumento4 páginasTaller Iiiadamariscarrion66Aún no hay calificaciones
- Informe de Fisca II Laboratorio DosDocumento10 páginasInforme de Fisca II Laboratorio DosRoberto Ñaupa RicraAún no hay calificaciones
- Experimento 7 Caidas de PresiónDocumento11 páginasExperimento 7 Caidas de PresiónCarlos Cortes Aguirre100% (1)
- Practica3 19 09Documento13 páginasPractica3 19 09MAURICIO DANIEL ANDRÉ LÓPEZ AVENDAÑOAún no hay calificaciones
- Gráfica en ExcelDocumento2 páginasGráfica en ExcelMoises ClAún no hay calificaciones
- Monod PreliminarDocumento3 páginasMonod PreliminareejfAún no hay calificaciones
- Tarea Previa Al Examen DepartamentalDocumento8 páginasTarea Previa Al Examen DepartamentalGameplays Of Games PcAún no hay calificaciones
- Regresión LinealDocumento8 páginasRegresión LinealAlejandra Chan LopezAún no hay calificaciones
- Tarea 5-Rodriguez Lopez Pedro ArturoDocumento13 páginasTarea 5-Rodriguez Lopez Pedro ArturoMafer Mabel GalarzaAún no hay calificaciones
- Examen 3 Cinetica GeoDocumento10 páginasExamen 3 Cinetica GeoRicardo RondonAún no hay calificaciones
- Tareade REGRESIONDocumento5 páginasTareade REGRESIONRosa WuAún no hay calificaciones
- Benceno (1) HeptanoDocumento3 páginasBenceno (1) HeptanoLeonardo ReyesAún no hay calificaciones
- Examen Final de Labo de Fico 2Documento7 páginasExamen Final de Labo de Fico 2Adrian QuispeAún no hay calificaciones
- Venturi - OrificioDocumento8 páginasVenturi - OrificioLeandro BorjaAún no hay calificaciones
- Ejercicio AplicativoDocumento3 páginasEjercicio Aplicativomartin lopezAún no hay calificaciones
- CALIBRACION3Documento3 páginasCALIBRACION3Angel GarciaAún no hay calificaciones
- Práctica 5Documento7 páginasPráctica 5Estefania Barrientos SierraAún no hay calificaciones
- Deflexión Magnética de ElectronesDocumento5 páginasDeflexión Magnética de ElectronesVictor Hair Santacruz MuñozAún no hay calificaciones
- Ejercicio 1 CinéticaDocumento6 páginasEjercicio 1 CinéticaDiego GarridoAún no hay calificaciones
- Ejercicio 1 CinéticaDocumento6 páginasEjercicio 1 CinéticaDiego GarridoAún no hay calificaciones
- Tablas de Los 3 ExperimentosDocumento11 páginasTablas de Los 3 ExperimentosDanAún no hay calificaciones
- INSCT104 - Clase No. 42 - Julio 08 - SoluciónDocumento14 páginasINSCT104 - Clase No. 42 - Julio 08 - SoluciónDonIncognitoAún no hay calificaciones
- Tarea 3Documento3 páginasTarea 3BrendaAún no hay calificaciones
- Practica SISTEMA MULTIPLEDocumento5 páginasPractica SISTEMA MULTIPLEGoOfysS FLGAún no hay calificaciones
- Laboratorio 7 FisicaDocumento4 páginasLaboratorio 7 FisicaYovanny ReyesAún no hay calificaciones
- Lab RegresiónDocumento3 páginasLab RegresiónMonica GonzalezAún no hay calificaciones
- Trabajo Fisica 2Documento5 páginasTrabajo Fisica 2Jeferson RodriguezAún no hay calificaciones
- Seminario 1Documento4 páginasSeminario 1DogmasAún no hay calificaciones
- Ejemplo Espectro Estatico-ModalDocumento4 páginasEjemplo Espectro Estatico-ModalAlejandro HoenesAún no hay calificaciones
- Lab Destilación #6Documento18 páginasLab Destilación #6Valerie Cordoba TeranAún no hay calificaciones
- Informe 6 - Bombas CentrifugasDocumento8 páginasInforme 6 - Bombas CentrifugasANA CLAUDIA VELASQUEZ VARGASAún no hay calificaciones
- Modelo de Espectro E.030 Diseño Sismorresistente PDFDocumento2 páginasModelo de Espectro E.030 Diseño Sismorresistente PDFVeny Orlando Vilca Ticlia100% (1)
- Ejercicio de Cinetica Tabla 2Documento1 páginaEjercicio de Cinetica Tabla 2SnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 2Documento1 páginaEjercicio de Cinetica Tabla 2SnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 2Documento1 páginaEjercicio de Cinetica Tabla 2SnikeAún no hay calificaciones
- Pauta P8Documento3 páginasPauta P8Denilso GalvezAún no hay calificaciones
- Actividad 3Documento3 páginasActividad 3Eduardo SalazarAún no hay calificaciones
- Conductividad 2-4Documento15 páginasConductividad 2-4Adolfo GuerreroAún no hay calificaciones
- EXCEL LABORATORIO 3 ABSORCION GASEOSA RecoveredDocumento139 páginasEXCEL LABORATORIO 3 ABSORCION GASEOSA RecoveredPipo HernándezAún no hay calificaciones
- Calculo Error de Gravedad Por Analisis GráficoDocumento2 páginasCalculo Error de Gravedad Por Analisis Gráficojose angel lozanoAún no hay calificaciones
- Reactor Químico. Gonzalez Garcia Diana ItzelDocumento7 páginasReactor Químico. Gonzalez Garcia Diana ItzelHorus CastilloAún no hay calificaciones
- PAGINA2REVISARDocumento10 páginasPAGINA2REVISARmatias.cortese.qAún no hay calificaciones
- Exemplo 9.2 Fogler Quarta Ed ExcelDocumento2 páginasExemplo 9.2 Fogler Quarta Ed ExcelCaroline dos Santos DuarteAún no hay calificaciones
- ConductividadDocumento3 páginasConductividadVanesa AlvarezAún no hay calificaciones
- Práctica 2 de CinéticaDocumento6 páginasPráctica 2 de CinéticaCarolina Caballero MedinaAún no hay calificaciones
- Energia EspecificaDocumento5 páginasEnergia EspecificaKatia Huiza PerezAún no hay calificaciones
- Estudio de Suelos - La Jolla - Asia - Lima..Documento56 páginasEstudio de Suelos - La Jolla - Asia - Lima..Luis Alberto Quiche Surichaqui100% (1)
- Repaso, Apoyo y Evaluacion de Contenidos 4º ESO SANTILLANADocumento416 páginasRepaso, Apoyo y Evaluacion de Contenidos 4º ESO SANTILLANAManuel DRM83% (6)
- Narrativa Circo Maroma y TeatroDocumento4 páginasNarrativa Circo Maroma y TeatroMeliyel Aburto PortillaAún no hay calificaciones
- Aspinwall2020 PDFDocumento24 páginasAspinwall2020 PDFCristina Carbonell BetancourtAún no hay calificaciones
- Arrojar BasuraDocumento5 páginasArrojar Basurajuan carlos ramirez vargasAún no hay calificaciones
- TA1 Psicologia Del Desarrollo IIDocumento13 páginasTA1 Psicologia Del Desarrollo IIMARIA ALEXANDRA YEPEZ ZAPATAAún no hay calificaciones
- Practica 1 de Estadistica Aplicada Ho PDocumento4 páginasPractica 1 de Estadistica Aplicada Ho PAlbert Aguilar Saico0% (1)
- 20 Telecomunicacione 20 ENSITDocumento126 páginas20 Telecomunicacione 20 ENSIThumberto100% (1)
- Sesión 2. Angie Alejandra SandovalDocumento4 páginasSesión 2. Angie Alejandra Sandovalmaritza herreraAún no hay calificaciones
- Matematica Iii: Perez Rodrigo GeynerDocumento7 páginasMatematica Iii: Perez Rodrigo GeynerNataly QuispeAún no hay calificaciones
- Tarea 3 (Victor)Documento3 páginasTarea 3 (Victor)Anny RosarioAún no hay calificaciones
- Cronograma La HabanaDocumento4 páginasCronograma La HabanaChris SosaAún no hay calificaciones
- Guía No.02 Determinación de Densidad y Viscosidad QuimicaDocumento12 páginasGuía No.02 Determinación de Densidad y Viscosidad QuimicaNayeli QuinatoaAún no hay calificaciones
- Estadistica 9 PDFDocumento8 páginasEstadistica 9 PDFAndres AmaguaAún no hay calificaciones
- Malla Receptora - ConclusionesDocumento6 páginasMalla Receptora - ConclusionesLuis Carranza EsquivelAún no hay calificaciones
- Taller EspectroscopioDocumento6 páginasTaller EspectroscopioLAURA JULIANA GAMBOA RODRIGUEZAún no hay calificaciones
- U4 SanjurjoDocumento7 páginasU4 SanjurjoIaia RuizAún no hay calificaciones
- Geometria Analitica Primer ParcialDocumento4 páginasGeometria Analitica Primer ParcialIrving RdzAún no hay calificaciones
- PANECODocumento40 páginasPANECOmejiasj100% (1)
- Sesion 01Documento13 páginasSesion 01Anilup Romero ChancasAún no hay calificaciones
- Plan de Área de Ciencias Naturales 2018Documento11 páginasPlan de Área de Ciencias Naturales 2018Leonardo MuñozAún no hay calificaciones
- Cuadro Comparativo Psicologia Comunitaria1Documento1 páginaCuadro Comparativo Psicologia Comunitaria1juan PuenteAún no hay calificaciones
- Biomagnetismo Psicobiolo - GcioDocumento169 páginasBiomagnetismo Psicobiolo - GcioAna MartínAún no hay calificaciones
- Taxonomia Cobach Luis TRADUCIDODocumento19 páginasTaxonomia Cobach Luis TRADUCIDOYazmín OrdoñezAún no hay calificaciones
- Trabajo Dirección y GestiónDocumento94 páginasTrabajo Dirección y GestiónLaura Callejón CaroAún no hay calificaciones
- Introducción Al AyurvedaDocumento23 páginasIntroducción Al AyurvedaMuraMuralAún no hay calificaciones
- Temas PrimariaDocumento534 páginasTemas PrimariaElena CánovasAún no hay calificaciones
- Curso de Diseño de Proyectos Educativos Doña ModestaDocumento33 páginasCurso de Diseño de Proyectos Educativos Doña ModestaMaru ChanAún no hay calificaciones
- Los Mamiferos Silvestres de Michoacan Arturo Nunez GardunoDocumento429 páginasLos Mamiferos Silvestres de Michoacan Arturo Nunez GardunoCesar MirandaAún no hay calificaciones
- 5-Superficies EquipotencialesDocumento3 páginas5-Superficies EquipotencialesBraulio MolinaAún no hay calificaciones