Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicio de Cinetica Tabla 2
Cargado por
SnikeDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejercicio de Cinetica Tabla 2
Cargado por
SnikeCopyright:
Formatos disponibles
Para la reaccion siguiente:
+
𝐵𝑟2(𝑎𝑐) + 𝐻𝐶𝑂𝑂𝐻(𝑎𝑐) ⇒ 2𝐵𝑟(𝑎𝑐) + 2𝐻(𝑎𝑐) + 𝐶𝑂2(𝑔)
a) Grafique (Br2) versus el tiempo
Tiempo (s) Br2(Moles)
0 0.01200
50 0.0101
100 0.00846
150 0.00710
200 0.00596
250 0.00500
300 0.00420
350 0.00353
400 0.00296
b) Calcule la velocidad de reacción para cada intervalo de 50 segundos
Tiempo (s) Br2(Moles) Velocidad (Moles/s) K=(Velocidad /Br2)
0 0.01200 0.000 0.000
50 0.0101 -0.0000380 3.76E-03
100 0.00846 -0.0000328 3.88E-03
150 0.00710 -0.0000272 3.83E-03
200 0.00596 -0.0000228 3.83E-03
250 0.00500 -0.0000192 3.84E-03
300 0.00420 -0.0000160 3.81E-03
350 0.00353 -0.0000134 3.80E-03
400 0.00296 -0.0000114 3.85E-03
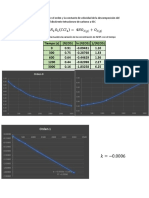
c) Graficar la velocidad de reacción versus la concentración de Br2 y determinar la constante k apartir de la gráfica. Compárela
con los valores calculados en la tabla
0.0000000
0.0000 0.0020 0.0040 0.0060 0.0080 0.0100 0.0120
-0.0000050
-0.0000100
Δ[𝐵𝑟2 ]
𝑉𝑒𝑙𝑜𝑐𝑖𝑑𝑎𝑑 = − = 𝑘 [𝐵𝑟2 ]
Δt
-0.0000150
Velocidad
-0.0000200
𝑘 = −0.0038 ⇒ 0.0038 𝑠 −1
-0.0000250
-0.0000300
-0.0000350 y = -0.0038x - 2E-07
R² = 0.9991
-0.0000400
Concentracion
También podría gustarte
- Ejercicio de Cinetica Tabla 2Documento1 páginaEjercicio de Cinetica Tabla 2SnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 2Documento1 páginaEjercicio de Cinetica Tabla 2SnikeAún no hay calificaciones
- Malagón RuízDocumento6 páginasMalagón RuízKARLA SOFÍA MALAGÓN RUÍZAún no hay calificaciones
- Cinetica BromuroDocumento7 páginasCinetica BromuroAxel SanHerAún no hay calificaciones
- Práctica 2 de Cinética QuímicaDocumento8 páginasPráctica 2 de Cinética QuímicaFrancisco Javier Cárdenas TorresAún no hay calificaciones
- Problema 6 y 7Documento22 páginasProblema 6 y 7Nino Alejandro Subieta VidelaAún no hay calificaciones
- Ejemplo Diagrama de MagnelDocumento2 páginasEjemplo Diagrama de MagnelPedro Angel Pary MamaniAún no hay calificaciones
- MRUV carrito física laboratorioDocumento3 páginasMRUV carrito física laboratorioBrayan AtiroAún no hay calificaciones
- Tarea 5-Rodriguez Lopez Pedro ArturoDocumento13 páginasTarea 5-Rodriguez Lopez Pedro ArturoMafer Mabel GalarzaAún no hay calificaciones
- Tarea 2Documento3 páginasTarea 2matasanchezangela08Aún no hay calificaciones
- Velocidad Instantanea-Cuarto EjercicioDocumento2 páginasVelocidad Instantanea-Cuarto EjercicioivanaAún no hay calificaciones
- Ejemplo de Tension PlanaDocumento21 páginasEjemplo de Tension Planajrcq9022Aún no hay calificaciones
- Ejercicios Semana 3 - Constante de Rapidez y Ley de RapidezDocumento6 páginasEjercicios Semana 3 - Constante de Rapidez y Ley de RapidezLuis Carlos benavidesAún no hay calificaciones
- Deformaciones y Esfuerzos - Vigas IsostáticasDocumento17 páginasDeformaciones y Esfuerzos - Vigas IsostáticasAnonymous bqktULniAún no hay calificaciones
- Metodo Beta de NewmarkDocumento19 páginasMetodo Beta de NewmarkJuanka Centeno50% (2)
- Informe tirosinasa II y IIIDocumento13 páginasInforme tirosinasa II y IIIKaren CardonaAún no hay calificaciones
- Clase InfiltracionDocumento4 páginasClase InfiltracionMARCO ANTONIO VALLADOLID JIMENEZAún no hay calificaciones
- Tarea 3.2 BiomaterialesDocumento5 páginasTarea 3.2 BiomaterialesVíctor Jesús Sagrero MoraAún no hay calificaciones
- WC31 MA466 L3 Espinoza Ortega JoFETDocumento4 páginasWC31 MA466 L3 Espinoza Ortega JoFETjofet espinoza ortegaAún no hay calificaciones
- Actividad 1Documento3 páginasActividad 1KARLA SOFÍA MALAGÓN RUÍZAún no hay calificaciones
- Análisis cinético de reacciones mediante métodos de Lineweaver-Burk, Eadie-Hofstee, Woolf-Augustinsson y HanesDocumento4 páginasAnálisis cinético de reacciones mediante métodos de Lineweaver-Burk, Eadie-Hofstee, Woolf-Augustinsson y Hanesaris bayonaAún no hay calificaciones
- Tarea 3 Vanessa MendozaDocumento9 páginasTarea 3 Vanessa Mendozayenifer paola camachoAún no hay calificaciones
- Momento de inercia laboratorio Física 1 (CE88Documento3 páginasMomento de inercia laboratorio Física 1 (CE88Raul JGarayAún no hay calificaciones
- Problemas Secado Segundo DepartamentalDocumento5 páginasProblemas Secado Segundo DepartamentalLuis FabianAún no hay calificaciones
- Ahora Si PDocumento4 páginasAhora Si Psophia CaiAún no hay calificaciones
- IG41 - MA466 - L1 - Quispe HuallpaDocumento3 páginasIG41 - MA466 - L1 - Quispe HuallpaGuillermo Quispe HuallpaAún no hay calificaciones
- Informe #2 Fcop+ FinalDocumento17 páginasInforme #2 Fcop+ FinalKarol FlorezAún no hay calificaciones
- Laboratorio Teorico - Esfuerzo Vs DeformacionDocumento9 páginasLaboratorio Teorico - Esfuerzo Vs DeformacionMonica PintoAún no hay calificaciones
- Reactores Quimicos Ramirez Castillo Jorge MiguelDocumento4 páginasReactores Quimicos Ramirez Castillo Jorge Miguelassadsaasds asdsadsaAún no hay calificaciones
- Tarea 1 Rubén Darío Álvarez Grupo 100404A 183Documento43 páginasTarea 1 Rubén Darío Álvarez Grupo 100404A 183rubendarioalvarezosorio29Aún no hay calificaciones
- Resolución práctica dirigida sobre temas de ingeniería hidráulicaDocumento6 páginasResolución práctica dirigida sobre temas de ingeniería hidráulicaKenyo Trucios CcantoAún no hay calificaciones
- Examen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeDocumento7 páginasExamen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeAdrian QuispeAún no hay calificaciones
- Practica3 19 09Documento13 páginasPractica3 19 09MAURICIO DANIEL ANDRÉ LÓPEZ AVENDAÑOAún no hay calificaciones
- Ley de HookeDocumento17 páginasLey de HookeeduardoadiazAún no hay calificaciones
- Determinación de Las Pérdidas Mecánicas Y Curvas Características de Velocidad de Un Motor E.Ch., Con CarburadorDocumento8 páginasDeterminación de Las Pérdidas Mecánicas Y Curvas Características de Velocidad de Un Motor E.Ch., Con CarburadorMiguelAún no hay calificaciones
- Martinez Alvarez Anahi Act1 U3Documento11 páginasMartinez Alvarez Anahi Act1 U3Anahi Martinez alvarezAún no hay calificaciones
- Metodo de Bigelow Completo Con WordDocumento18 páginasMetodo de Bigelow Completo Con WordFredy ParionaAún no hay calificaciones
- Tarea 6 Vargas Regalado JuanDocumento32 páginasTarea 6 Vargas Regalado Juan201400738Aún no hay calificaciones
- ESPECTRO SISMO NORMA E.030Documento2 páginasESPECTRO SISMO NORMA E.030Veny Orlando Vilca Ticlia100% (1)
- Capellino Godoy, Aaron Eduardo - U202113844 2. Ayala Majino, Zidane Cesar - U20211d613Documento3 páginasCapellino Godoy, Aaron Eduardo - U202113844 2. Ayala Majino, Zidane Cesar - U20211d613Aaron CapellinoAún no hay calificaciones
- Curva Ingenieril-RealDocumento5 páginasCurva Ingenieril-RealAndrea GuissepeAún no hay calificaciones
- Pérez Pacheco Moisés Practica 2Documento15 páginasPérez Pacheco Moisés Practica 2moises perezAún no hay calificaciones
- Raíz cúbica de 3 y 25 con método de bisecciónDocumento60 páginasRaíz cúbica de 3 y 25 con método de bisecciónEdgar VillaAún no hay calificaciones
- Deflexión Magnética de ElectronesDocumento5 páginasDeflexión Magnética de ElectronesVictor Hair Santacruz MuñozAún no hay calificaciones
- Ondas Estacionarias1Documento3 páginasOndas Estacionarias1Loza NayAún no hay calificaciones
- Modelo Estandarizado Usando CharmesDocumento3 páginasModelo Estandarizado Usando CharmesRonald Jaramillo MejiaAún no hay calificaciones
- Si Lo Abres Te MueresDocumento15 páginasSi Lo Abres Te MueresOscar Alejandro Trujillo GutiérrezAún no hay calificaciones
- Fabricación de tejidos y patrocinio de equipos deportivosDocumento4 páginasFabricación de tejidos y patrocinio de equipos deportivosViri Ysey91% (11)
- Ejercicio para Practicar MatlabDocumento4 páginasEjercicio para Practicar MatlabCarlos Gregorio Coello SanchezAún no hay calificaciones
- Cinética Química Gráficas 1Documento4 páginasCinética Química Gráficas 1karencAún no hay calificaciones
- Calculo de CunetasDocumento4 páginasCalculo de CunetaswalterleontitichocaAún no hay calificaciones
- TAREA #2 - Mecánica de Fluidos y Separación de FasesDocumento10 páginasTAREA #2 - Mecánica de Fluidos y Separación de FasesCriz Espinoza ChavezAún no hay calificaciones
- Actividad 1Documento3 páginasActividad 1KARLA SOFÍA MALAGÓN RUÍZAún no hay calificaciones
- Calculo Rejas y DesarenadorDocumento4 páginasCalculo Rejas y DesarenadorLuis CastilloAún no hay calificaciones
- Metodo Directo Por Tramos (Version 1)Documento26 páginasMetodo Directo Por Tramos (Version 1)Santiago Samaniego EguigurenAún no hay calificaciones
- Laboratorio 10, Campo Magnetico Solenoide, Carlos, Paula y OscarDocumento6 páginasLaboratorio 10, Campo Magnetico Solenoide, Carlos, Paula y OscarPAULA ANDREA PORTILLA CORREDORAún no hay calificaciones
- Mecánica de Fluidos y Separación de Fases: Cálculo de RendimientosDocumento10 páginasMecánica de Fluidos y Separación de Fases: Cálculo de RendimientosCriz Espinoza ChavezAún no hay calificaciones
- Diseño Cunetas TriangularesDocumento4 páginasDiseño Cunetas TriangulareswalterleontitichocaAún no hay calificaciones
- Interpretacion de Datos CinéticosDocumento28 páginasInterpretacion de Datos CinéticosJhon Paul SanchezAún no hay calificaciones
- Métodos Matriciales para ingenieros con MATLABDe EverandMétodos Matriciales para ingenieros con MATLABCalificación: 5 de 5 estrellas5/5 (1)
- Practica de FerrososDocumento4 páginasPractica de FerrososSnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 3Documento1 páginaEjercicio de Cinetica Tabla 3SnikeAún no hay calificaciones
- Qué Es La ElectrolisisDocumento1 páginaQué Es La ElectrolisisSnikeAún no hay calificaciones
- Resumen Videos UltimoDocumento6 páginasResumen Videos UltimoSnikeAún no hay calificaciones
- Ensayo de Cinetica 1Documento3 páginasEnsayo de Cinetica 1SnikeAún no hay calificaciones
- Tarea de CineticaDocumento1 páginaTarea de CineticaSnikeAún no hay calificaciones
- Practica de FerrososDocumento4 páginasPractica de FerrososSnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 3Documento1 páginaEjercicio de Cinetica Tabla 3SnikeAún no hay calificaciones
- Practica de LaboratorioDocumento2 páginasPractica de LaboratorioSnikeAún no hay calificaciones
- Practica 4Documento7 páginasPractica 4SnikeAún no hay calificaciones
- Practica 3 WDocumento10 páginasPractica 3 WSnikeAún no hay calificaciones
- Máquina Automática de Montaje de Muestras Metalográficas CMSMP-QZ1Documento3 páginasMáquina Automática de Montaje de Muestras Metalográficas CMSMP-QZ1SnikeAún no hay calificaciones
- Practica de FerrososDocumento4 páginasPractica de FerrososSnikeAún no hay calificaciones
- Practica 4Documento7 páginasPractica 4SnikeAún no hay calificaciones
- Ensayo de Cinetica 1Documento3 páginasEnsayo de Cinetica 1SnikeAún no hay calificaciones
- Caso de Estudio Ii Caso Lalo PerezDocumento2 páginasCaso de Estudio Ii Caso Lalo PerezSnikeAún no hay calificaciones
- 2 Parte Análisis Físico QuímicoDocumento2 páginas2 Parte Análisis Físico QuímicoSnikeAún no hay calificaciones
- Análisis FisicoquímicoDocumento3 páginasAnálisis FisicoquímicoSnikeAún no hay calificaciones
- Caratula Practica 2Documento1 páginaCaratula Practica 2SnikeAún no hay calificaciones
- Ejercicios de ExcelDocumento29 páginasEjercicios de ExcelSnikeAún no hay calificaciones
- Roca-Reporte-Practica1Documento9 páginasRoca-Reporte-Practica1SnikeAún no hay calificaciones
- Ejercicio de Cinetica Tabla 3Documento1 páginaEjercicio de Cinetica Tabla 3SnikeAún no hay calificaciones
- Programa de EsfuerzosDocumento13 páginasPrograma de EsfuerzosSnikeAún no hay calificaciones
- Ecuciacion HomogeneaDocumento1 páginaEcuciacion HomogeneaSnikeAún no hay calificaciones
- Materiales poliméricos: propiedades, clasificación y aplicacionesDocumento12 páginasMateriales poliméricos: propiedades, clasificación y aplicacionesSnikeAún no hay calificaciones
- 2022-01 Materiales-Polimericos 02Documento12 páginas2022-01 Materiales-Polimericos 02SnikeAún no hay calificaciones
- Reporte de LaboratorioDocumento3 páginasReporte de LaboratorioSnikeAún no hay calificaciones
- Cap. Iv. Relacion Entre Las Aguas Superficiales y Subterraneas.Documento44 páginasCap. Iv. Relacion Entre Las Aguas Superficiales y Subterraneas.PAUL JOEL MARINO IDME APAZAAún no hay calificaciones
- LAB 2 TransferenciaDocumento5 páginasLAB 2 TransferenciaMariana MadridAún no hay calificaciones
- Condensador VerticalDocumento14 páginasCondensador VerticalJose Kalvin Rojas100% (1)
- CineticaDocumento9 páginasCineticaALONDRA MIRANDA ZUÑIGAAún no hay calificaciones
- Guia ReynoldsDocumento5 páginasGuia ReynoldsAlejandro Millar FernándezAún no hay calificaciones
- Diagnostico de Sistema ExistenteDocumento17 páginasDiagnostico de Sistema ExistenteBruno MiesesAún no hay calificaciones
- DSC aplicaciones materialesDocumento8 páginasDSC aplicaciones materialescristianAún no hay calificaciones
- Cálculo de hidrogramas y caudales máximos mediante métodos hidrológicosDocumento11 páginasCálculo de hidrogramas y caudales máximos mediante métodos hidrológicosEstéfano ZárateAún no hay calificaciones
- Norma ASHRAE Refrigeración 1990Documento524 páginasNorma ASHRAE Refrigeración 1990diro_shox100% (6)
- Presupuesto ReferencialDocumento899 páginasPresupuesto ReferencialChristhian BenaventeAún no hay calificaciones
- Daitsu Monobloc 3D SmartDocumento2 páginasDaitsu Monobloc 3D SmartJose J Alijo BaenaAún no hay calificaciones
- Simulación YacimientosDocumento7 páginasSimulación YacimientosMarcosAún no hay calificaciones
- Practica 3 (Segunda Parte) - Segundo Parcial. Unapec. 2020.2. Termodinámica.Documento4 páginasPractica 3 (Segunda Parte) - Segundo Parcial. Unapec. 2020.2. Termodinámica.feliciano mendezAún no hay calificaciones
- Calor - 1-6Documento3 páginasCalor - 1-6Nataly Verastegui CastañedaAún no hay calificaciones
- Is - Grupo 3 - Incendio - 16-12Documento1 páginaIs - Grupo 3 - Incendio - 16-12api-520954620Aún no hay calificaciones
- Calor de Combustion PabloDocumento8 páginasCalor de Combustion PabloEsperanza VelazquezAún no hay calificaciones
- Pre Practica 7 Presion de Vapor de Un Líquido PuroDocumento4 páginasPre Practica 7 Presion de Vapor de Un Líquido PuroEstefaníaAún no hay calificaciones
- Estados materia prueba unidad Ciencias NaturalesDocumento3 páginasEstados materia prueba unidad Ciencias NaturalesMARLENE100% (3)
- AdblueDocumento2 páginasAdblueCristian DawkinsAún no hay calificaciones
- ECUACIÓN DE ENERGíA PARA FLUJO CONTINUO EN UN TUBERIADocumento11 páginasECUACIÓN DE ENERGíA PARA FLUJO CONTINUO EN UN TUBERIALuis Francisco MuroAún no hay calificaciones
- Expo SanitariaDocumento29 páginasExpo SanitariaMIGUELAún no hay calificaciones
- 01 Memoria Anteproyecto-Oquendo v2Documento17 páginas01 Memoria Anteproyecto-Oquendo v2mariev12Aún no hay calificaciones
- Laboratorio 1 Mecanica de FluidosDocumento7 páginasLaboratorio 1 Mecanica de Fluidosa2022110544Aún no hay calificaciones
- Lab Evaporador VacioDocumento2 páginasLab Evaporador VacioGuillermo Andres Velasco AlvarezAún no hay calificaciones
- Calculo de Caudales de Diseño Alcantarillado ClaseDocumento3 páginasCalculo de Caudales de Diseño Alcantarillado Clasejames alvaradoAún no hay calificaciones
- Prueba HidraulicaDocumento1 páginaPrueba HidraulicaEsmer Guevara FernandezAún no hay calificaciones
- Fluido NewtonianoDocumento4 páginasFluido NewtonianoByron Roberto JuarezAún no hay calificaciones
- PDF MateriaDocumento3 páginasPDF Materiacesar ayala canchariAún no hay calificaciones
- Fosa Septica 1Documento16 páginasFosa Septica 1curioso2000Aún no hay calificaciones