Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Potenciometría
Cargado por
ERIKA XIMENA SALAMANCA PEREZDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Potenciometría
Cargado por
ERIKA XIMENA SALAMANCA PEREZCopyright:
Formatos disponibles
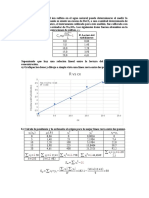
Volumen de pH Volumen Primera Volumen Segunda CURVA DE TITULACIÓN
NaOH (mL) Promedio (mL) Derivada Promedio (mL) Derivada
12.00
0 3.60
1 4.16 0.5 0.56 10.00
2 4.60 1.5 0.44 1.0 -0.12 8.00
3 5.00 2.5 0.4 2.0 -0.04
4 5.53 3.5 0.53 3.0 0.13 6.00
pH
5 9.91 4.5 4.38 4.0 3.85 4.00
6 10.87 5.5 0.96 5.0 -3.42
7 11.16 6.5 0.29 6.0 -0.67 2.00
8 11.28 7.5 0.12 7.0 -0.17 0.00
0 1 2 3 4 5 6 7 8 9
Pendiente de la Ecuación de la Recta Grafica Segunda Derivada
Volumen NaOH (mL)
Pendiente (m)==((−𝟑.𝟒𝟐−𝟑.𝟖𝟓))/((𝟓.𝟎𝟎−𝟒.𝟎𝟎))=−𝟕.𝟐𝟕
PRIMERA DERIVADA
Δ𝑦/Δ𝑥
5
4.5
Intercepto (b) de la Ecuación de la Recta Grafica Segunda Derivada
4
(y - 3.85) = -7.27 (x - 4.00) 3.5
Primera Derivada
3
(y - 3.85) = -7.27x - 29.08
2.5
y = -7.27x + 29.08 + 3.85
2
y = -7.27x + 32.93
1.5
b = 32.93 1
Igualación de Y a 0 (punto de corte eje X, volumen de equivalencia) 0.5
0
y = -7.27x + 32.93 0 1 2 3 4 5 6 7 8
0 = -7.27x + 32.93 Volumen Promedio NaOH (mL)
(-32.93) = (-7.27x)
(-32.93)/(-7.27) = x
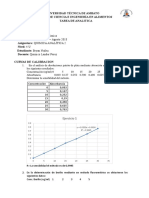
4.52 mL = x SEGUNDA DERIVADA
Valoración Potenciometrica Ácido Ácetico en Vinagre Comercial (Grupo 5
Yislein)
4
3
Segunda Derivada
2
1
0
Determinación del pKa del Ácido -1
0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0
Concentración molar del ácido ácetico: 0.214 M -2
Concentraciones de CH3COOH y CH3COO(-) con 4 mL NaOH (pH = 5.53) -3
[CH3COOH] = 0.008 M y [CH3COO(-)] = 0.063 M -4
5.53 = pKa + log (0.063/0.008) Volumen Promedio NaOH (mL)
pKa = 4.63
Estandarización NaOH
Masa
Volumen de NaOH (mL) KHP (g) [NaOH] M
7.10 0.147 0.096
7.10 0.145 0.095
7.10 0.145 0.095
PROMEDIO 0.095
DESVIACIÓN 0.001
%C.V 0.8
Valoración Ácido Ácetico en Vinagre Comercial (Grupo Adrián)
Volumen de NaOH (mL) [NaOH] M [CH3COOH] % V/V
16.70 0.096 4.81
16.80 0.095 4.77
16.70 0.095 4.74
PROMEDIO 4.77
DESVIACIÓN 0.03
%C.V 0.7
Valoración Ácido Ácetico en Vinagre Comercial (Grupo Yislein)
Volumen de NaOH (mL) [NaOH] M [CH3COOH] % V/V
4.90 0.096 1.41
5.20 0.095 1.48
PROMEDIO 1.44
DESVIACIÓN 0.05
%C.V 3.2
También podría gustarte
- Introducción al cálculo y al álgebra. Fundamentos del cálculoDe EverandIntroducción al cálculo y al álgebra. Fundamentos del cálculoAún no hay calificaciones
- Métodos Matriciales para ingenieros con MATLABDe EverandMétodos Matriciales para ingenieros con MATLABCalificación: 5 de 5 estrellas5/5 (1)
- Ejercicios de Estadistica Sesion 8Documento5 páginasEjercicios de Estadistica Sesion 8Yessi Yirini Criollo HuacchilloAún no hay calificaciones
- Practica 3Documento5 páginasPractica 3Eduardo TrejoAún no hay calificaciones
- 8 AMAZON LogisticaDocumento8 páginas8 AMAZON LogisticaLuis DiazAún no hay calificaciones
- Evaluación Parcial Comunicacion EfectivaDocumento4 páginasEvaluación Parcial Comunicacion Efectiva60423495100% (1)
- ABAP +MODULE+POOL+Guía+BásicaDocumento21 páginasABAP +MODULE+POOL+Guía+BásicaLau SalvadorAún no hay calificaciones
- BadimaleDocumento34 páginasBadimalehannita23100% (1)
- SOLUCION DE EJERCICIOS CAP4 - Introduccion Al Analisis EstadisticoDocumento12 páginasSOLUCION DE EJERCICIOS CAP4 - Introduccion Al Analisis EstadisticoJose Oscar Henao MonjeAún no hay calificaciones
- Actividad Correlación Lineal DécimoDocumento2 páginasActividad Correlación Lineal DécimoLuis Mi0% (1)
- Tarea Previa. Practica 10Documento11 páginasTarea Previa. Practica 10Fabian Rafael100% (1)
- SOLUCIÓN DE EJERCICIOS CAP3 - Introducción Al Análisis EstadísticoDocumento14 páginasSOLUCIÓN DE EJERCICIOS CAP3 - Introducción Al Análisis EstadísticoJose Oscar Henao MonjeAún no hay calificaciones
- Efecto de Algunos Factores Que Afectan La Intensidad de Fluorescencia de La Riboflavina 1Documento4 páginasEfecto de Algunos Factores Que Afectan La Intensidad de Fluorescencia de La Riboflavina 1Dulce Zarate SPAún no hay calificaciones
- Ejercicios Producto 4Documento16 páginasEjercicios Producto 4Alejo MuñozAún no hay calificaciones
- Medicina - Fisiologia. Líquidos Corporales 2007Documento59 páginasMedicina - Fisiologia. Líquidos Corporales 2007DANIEL ALEJANDROAún no hay calificaciones
- Frege Estudios Sobre SemanticaDocumento89 páginasFrege Estudios Sobre SemanticaMjguerreroc100% (4)
- Palacios Prieto Cristhian André - MÉTODOS NUMÉRICOSDocumento3 páginasPalacios Prieto Cristhian André - MÉTODOS NUMÉRICOSCristhianPalaciosAún no hay calificaciones
- Actividad 8 Regresion Lineal 2Documento9 páginasActividad 8 Regresion Lineal 2viviana carolina garcia rosarioAún no hay calificaciones
- Guía Unidad IDocumento10 páginasGuía Unidad Iedwinfrancoenator6792Aún no hay calificaciones
- Metodo de Los Min. CuadradosDocumento14 páginasMetodo de Los Min. Cuadradosmaria jose ulloa gonzalezAún no hay calificaciones
- Electrodos CurvosDocumento3 páginasElectrodos CurvosTato AlfaroAún no hay calificaciones
- Wilcoxon 2017Documento16 páginasWilcoxon 2017Karla Díaz50% (2)
- Práctica 3. Cinética de NeutralizaciónDocumento17 páginasPráctica 3. Cinética de NeutralizaciónEstefanía LovatoAún no hay calificaciones
- Analisis de SeñalesDocumento16 páginasAnalisis de SeñalesLüîîs PâçhëçôôAún no hay calificaciones
- Wilcoxon 2017Documento16 páginasWilcoxon 2017Martha Felicitas SerranoAún no hay calificaciones
- Diseno - Malla - en - BT (1.1)Documento9 páginasDiseno - Malla - en - BT (1.1)Ariel Bastian Ramos MilchioAún no hay calificaciones
- Ejemplo Regresion y Correlacion Multiple OkDocumento31 páginasEjemplo Regresion y Correlacion Multiple OkEfrain Ccallo Ccalle33% (3)
- Distribución de Un Soluto Entre Líquidos No MisciblesDocumento4 páginasDistribución de Un Soluto Entre Líquidos No MisciblesManuela PuertaAún no hay calificaciones
- Radicacion de Numeros Reales para Segundo de SecundariaDocumento6 páginasRadicacion de Numeros Reales para Segundo de SecundariaLunyTunnzAún no hay calificaciones
- Soto Lopez Gitzel M18S1AI2Documento4 páginasSoto Lopez Gitzel M18S1AI2Gitzel SotoAún no hay calificaciones
- EJ10Documento3 páginasEJ10Erick NavarreteAún no hay calificaciones
- Practica #8, Determinacion Del PKDocumento11 páginasPractica #8, Determinacion Del PKErikaCorderoLópezAún no hay calificaciones
- Plantilla para Ejercicios de Regresion Lineal Simple ElectromecanicaDocumento5 páginasPlantilla para Ejercicios de Regresion Lineal Simple ElectromecanicaRamón ManuelAún no hay calificaciones
- Cálculos y Resultados Detergente PDFDocumento4 páginasCálculos y Resultados Detergente PDFKarla Alexandra Palacios RojasAún no hay calificaciones
- Practica AnalisisDocumento5 páginasPractica Analisisromanaadiaz.1Aún no hay calificaciones
- Resolucion 1Documento2 páginasResolucion 1WALTERAún no hay calificaciones
- Distribuciones Muestrales Con y Sin ReposiciónDocumento8 páginasDistribuciones Muestrales Con y Sin ReposicióncarlosAún no hay calificaciones
- Libro 1Documento9 páginasLibro 1Charles MoralesAún no hay calificaciones
- ENZIMASDocumento8 páginasENZIMASFAUSTO GUAYAQUILAún no hay calificaciones
- 21 10Documento3 páginas21 10Arata NovachronnoAún no hay calificaciones
- Informe Sistema Puestas A Tierra SoldadurasDocumento16 páginasInforme Sistema Puestas A Tierra Soldadurasbasti2000Aún no hay calificaciones
- Potenciacion de Numeros Naturales ML 2023Documento2 páginasPotenciacion de Numeros Naturales ML 2023ANSELMO BEDON CHAVEZAún no hay calificaciones
- Ai Esta El MioDocumento10 páginasAi Esta El Mioluis100% (1)
- Previo p.10. FQ QGIIDocumento11 páginasPrevio p.10. FQ QGIIUriel AlvarezAún no hay calificaciones
- Acido Base IiDocumento13 páginasAcido Base IiZamira RiveraAún no hay calificaciones
- Pre-Tarea - Jhancarlos-VizcainoDocumento7 páginasPre-Tarea - Jhancarlos-VizcainoHayder RamosAún no hay calificaciones
- Practica #8, Determinacion Del PKDocumento11 páginasPractica #8, Determinacion Del PKErikaCorderoLópezAún no hay calificaciones
- Primer Examen Parcial de Geologia de MinasDocumento4 páginasPrimer Examen Parcial de Geologia de MinashuberAún no hay calificaciones
- Repaso Primer Parcial 2020.Documento6 páginasRepaso Primer Parcial 2020.Andrea Patricia PaxtorAún no hay calificaciones
- Deberes Totales AnaliticaDocumento17 páginasDeberes Totales AnaliticaDiego Tobar100% (3)
- Cartel - LIQ IV - Cinética QuímicaDocumento1 páginaCartel - LIQ IV - Cinética Químicachuvak.elcAún no hay calificaciones
- Lab - QG II Repor Práctica 3Documento4 páginasLab - QG II Repor Práctica 3Ezequiel MedinaAún no hay calificaciones
- Estudio de CasoDocumento17 páginasEstudio de CasoEddie AlarconAún no hay calificaciones
- Soluciones Tema0Documento3 páginasSoluciones Tema0Daisy Paola Rodriguez SuarezAún no hay calificaciones
- Tarea PatronDocumento4 páginasTarea PatronJhoselin Haro SebastianAún no hay calificaciones
- Practica No. 8 Lab 2Documento14 páginasPractica No. 8 Lab 2Vidaña DuronAún no hay calificaciones
- Actividad 4 - Analisis de Caso 3Documento7 páginasActividad 4 - Analisis de Caso 3Juan RodriguezAún no hay calificaciones
- Informe TomatesDocumento7 páginasInforme TomatesDavid TayronAún no hay calificaciones
- 21 13Documento3 páginas21 13Arata NovachronnoAún no hay calificaciones
- TrabajoDocumento10 páginasTrabajoLeonidas Bustos AcostaAún no hay calificaciones
- Uni 2 Act 3Documento34 páginasUni 2 Act 3johana torresAún no hay calificaciones
- Ef TM 212 SoluciónDocumento4 páginasEf TM 212 SoluciónBladimir H GarciaAún no hay calificaciones
- Psicofísica de Stevens: Práctica 4Documento6 páginasPsicofísica de Stevens: Práctica 4Jose Antonio Canovas gallegoAún no hay calificaciones
- LAB1HCLDocumento7 páginasLAB1HCLNatalia Arias EspinozaAún no hay calificaciones
- Calculos InformeDocumento5 páginasCalculos InformeJorge Luis CastilloAún no hay calificaciones
- Trabajo Final de Cáculo IIDocumento22 páginasTrabajo Final de Cáculo IILuis CoaquiraAún no hay calificaciones
- Informe de Electronica de PotenciaDocumento9 páginasInforme de Electronica de PotenciaOscar AnteAún no hay calificaciones
- Mof CiscoDocumento29 páginasMof CiscoRubén Rodríguez GuerreroAún no hay calificaciones
- Corbí. Principios-de-epistemologia-Axiologica.1r.cap.Documento123 páginasCorbí. Principios-de-epistemologia-Axiologica.1r.cap.deulofeuAún no hay calificaciones
- Tarea Ix Evaluacion Psicometrica de La PersonalidadDocumento8 páginasTarea Ix Evaluacion Psicometrica de La PersonalidadIsamar Vargas100% (1)
- 01 - 3° ComunicacionDocumento14 páginas01 - 3° ComunicacionDaniel MelendezAún no hay calificaciones
- ACT1 HUML PyE P2Documento9 páginasACT1 HUML PyE P2Harold Ulises Monsivais LópezAún no hay calificaciones
- Resolucion Conjunta citma-minsapNBSDocumento188 páginasResolucion Conjunta citma-minsapNBSOscar MoraAún no hay calificaciones
- Via Se Special EsDocumento2 páginasVia Se Special Eshugo higueraAún no hay calificaciones
- Gráficas y Ecuaciones Diferenciales en MatlabDocumento30 páginasGráficas y Ecuaciones Diferenciales en MatlabedcamesAún no hay calificaciones
- Tests de Psicologia IndustrialDocumento21 páginasTests de Psicologia IndustrialCésar OtzoyAún no hay calificaciones
- Conceptos Básico InteractividadDocumento15 páginasConceptos Básico InteractividadEvamaris EnriquezAún no hay calificaciones
- Principales Indicadores Del Dpto RRHHDocumento23 páginasPrincipales Indicadores Del Dpto RRHHluisaalejandraAún no hay calificaciones
- Investigación Cualitativa (Tapa) 1.3Documento1 páginaInvestigación Cualitativa (Tapa) 1.3Chiara PerroneAún no hay calificaciones
- Capitulo 5 PERSONALIDAD Y COMPORTAMIENTO DEL CONSUMIDORDocumento23 páginasCapitulo 5 PERSONALIDAD Y COMPORTAMIENTO DEL CONSUMIDORCami SalvatierraAún no hay calificaciones
- MTD - Mtto AsfaltoDocumento8 páginasMTD - Mtto AsfaltoAndres ValenciaAún no hay calificaciones
- Pa3 Tarea 2022-10Documento2 páginasPa3 Tarea 2022-10ARIANA MARICIELO HUAMANCHUMO BERNEDOAún no hay calificaciones
- Eventracion 2019Documento54 páginasEventracion 2019Guillermo CabrejosAún no hay calificaciones
- INFORME El Sena SallyDocumento31 páginasINFORME El Sena SallyPaula Andrea Hernández LozadaAún no hay calificaciones
- Revista Digital Actividad Física y Deporte Enero-Junio 2024 Volumen 10 No. 1Documento89 páginasRevista Digital Actividad Física y Deporte Enero-Junio 2024 Volumen 10 No. 1bogotano8Aún no hay calificaciones
- Guia 23 Noveno Campo de ComunicacionDocumento6 páginasGuia 23 Noveno Campo de ComunicacionMaria Rocio Sisa OrtizAún no hay calificaciones
- El Corazón DelatorDocumento2 páginasEl Corazón DelatorNayely RuizAún no hay calificaciones
- Caso Practico Unidad 3 - Administración de Los Procesos IDocumento9 páginasCaso Practico Unidad 3 - Administración de Los Procesos IClara Milena VanegasAún no hay calificaciones
- Transistores BJTDocumento15 páginasTransistores BJTSamantha dominguezAún no hay calificaciones
- La Endospora Bacteriana y La EsporulaciónDocumento14 páginasLa Endospora Bacteriana y La EsporulaciónTerry Huaman Che100% (1)