Documentos de Académico
Documentos de Profesional
Documentos de Cultura
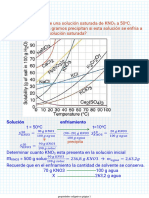
Preparacion Cu2+
Cargado por
'Saul 'EduardoDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Preparacion Cu2+
Cargado por
'Saul 'EduardoCopyright:
Formatos disponibles
Se obtiene la cantidad
Calcular los gramos de de 24.8 g de Na2S2O3 . 5
Na2S2O3 . 5 H2O Pesar ± 24.8 g de
H2O, por lo tanto, se Disolver con H2O
necesarios para la Na2S2O3 . 5 H2O
usará una balanza destilada
solución en un vaso de
granataria precipitados
𝑎Na2S2O3.5H2O
𝑁Na2S2O3.5H2O =
𝑃𝑒𝑞Na2S2O3.5H2O ∗𝑉Na2S2O3.5H2O
𝑎Na2S2O3.5H2O = (𝑁 ∗ 𝑉 ∗ 𝑃𝑒𝑞)Na2S2O3.5H2O =
𝑒𝑞 − 𝑔 248 𝑔
0.1 ⁄𝐿 ( )(1𝐿) = 24.8 𝑔
𝑒𝑞 − 𝑔 Transferir a un matraz
volumétrico de 1 L
Pesar 0.5 g de Disolverlos con H2O
Na2CO3 destilada
Aforar con H2O
Transferir a un frasco destilada y
nombre del reactivo ámbar homogenizar
reactivo,
Preparación concentración y
del Na2S2O3 . fecha de
elaboración y
5 H2O clave de quien Etiqueta
elaboro
Pesar ± 49 mg
de K2Cr2O7 en
Calcular los gramos de Se obtiene la cantidad un matraz
K2Cr2O7 necesarios para de 49 mg de K2Cr2O7, por Erlenmeyer a Disolver con 50 mL de
valorar la solución de lo tanto, se usará una temperatura H2O destilada
Na2S2O3 en 10 mL balanza analítica ambiente
𝑒K2Cr2O7 = 𝑒Na2S2O3
𝑎
(𝑃𝑒𝑞)K2Cr2O7 = (𝑉 ∗ 𝑁)Na2S2O3
𝑎K2Cr2O7 = (𝑉 ∗ 𝑁)Na2S2O3 ∗ 𝑃𝑒𝑞K2Cr2O7
𝑚𝑒𝑞 − 𝑔 294 𝑚𝑔
= 10 𝑚𝐿 (0.1 ⁄𝑚𝐿)( ) Agregar 5 mL de HCl
6 𝑒𝑞 − 𝑔 relación [1:1] y 10 mL de
= 49 𝑚𝑔 KI al 10%
Continuar con la
titulación hasta un Agregar 1 mL de KI
Titular con Na2S2O3 HCl
verde esmeralda almidón al 0.5 %
hasta amarillo claro
Reposar en la
oscuridad de
5 a 10 minutos
También podría gustarte
- Preparacion Fe2+Documento2 páginasPreparacion Fe2+'Saul 'EduardoAún no hay calificaciones
- P3 Diagrama CinéticaDocumento1 páginaP3 Diagrama CinéticaGabriel Vallejo CabreraAún no hay calificaciones
- DISOLUCIONESDocumento15 páginasDISOLUCIONESSergio Lazarte Mercado80% (5)
- Grupo2 Inf 11Documento6 páginasGrupo2 Inf 11Evelyn Paguay CarrilloAún no hay calificaciones
- Preparacion P3Documento2 páginasPreparacion P3'Saul 'EduardoAún no hay calificaciones
- 5 Disoluciones - OcepbDocumento20 páginas5 Disoluciones - Ocepbwilly chaveAún no hay calificaciones
- Articulo Cientifico Valoración de SolucionesDocumento5 páginasArticulo Cientifico Valoración de SolucionesL Angel SanchezAún no hay calificaciones
- Preparacion de Una Solucion de Naoh y Estandarizacion Con Ftalato Acido de PotasioDocumento7 páginasPreparacion de Una Solucion de Naoh y Estandarizacion Con Ftalato Acido de PotasioJose murciaAún no hay calificaciones
- Reporte Practica 4 Aplicaciones EsiqieDocumento5 páginasReporte Practica 4 Aplicaciones EsiqieJesús Yair Mejía SánchezAún no hay calificaciones
- Metodos Con PermanganatoDocumento18 páginasMetodos Con PermanganatoKatyAún no hay calificaciones
- Reporte de Analisis 1Documento9 páginasReporte de Analisis 1Anny RmzAún no hay calificaciones
- AugustoDocumento12 páginasAugustoVANESSA MONTESAún no hay calificaciones
- P5 SolubilidadDocumento8 páginasP5 Solubilidadwarmachine98Aún no hay calificaciones
- Encuadre 2 U1 XDocumento25 páginasEncuadre 2 U1 XJulieta AlvarezAún no hay calificaciones
- Informe 5 Acido Base 2020Documento4 páginasInforme 5 Acido Base 2020JHONATAN MORALES0% (1)
- Química Prac.09Documento8 páginasQuímica Prac.09Daniela Alessandra Suárez RamírezAún no hay calificaciones
- Practica 1 Mea422 Abigail Vergara ColqueDocumento8 páginasPractica 1 Mea422 Abigail Vergara ColqueAbigail VergaraAún no hay calificaciones
- Práctica No.3Documento8 páginasPráctica No.3Paams Mart100% (1)
- Cuestionario G 16Documento33 páginasCuestionario G 16cristina ayb100% (1)
- Curvas Solubildad ProbleamasDocumento2 páginasCurvas Solubildad ProbleamasrFaridAún no hay calificaciones
- DicromatometriaDocumento5 páginasDicromatometriaEliecer GonzalezAún no hay calificaciones
- Estandarización de NaOHDocumento19 páginasEstandarización de NaOHHarold Betancourt Perez100% (1)
- SOLUBILIDADDocumento6 páginasSOLUBILIDADnestor chambiAún no hay calificaciones
- Previo 1 Organica IVDocumento6 páginasPrevio 1 Organica IVdany_289Aún no hay calificaciones
- Practica3 - Metodos - Eq5 UPIBIDocumento8 páginasPractica3 - Metodos - Eq5 UPIBIWendy DiazAún no hay calificaciones
- Diagrama de Bloques P3 Lab. CyRHDocumento7 páginasDiagrama de Bloques P3 Lab. CyRHAlfredo EscamillaAún no hay calificaciones
- Evaluación de Biología. 9° - 10.08 - Molaridad, MolalidadDocumento1 páginaEvaluación de Biología. 9° - 10.08 - Molaridad, MolalidadJean Deli GutierrezAún no hay calificaciones
- 8° Informe de QuimicaDocumento10 páginas8° Informe de QuimicaJesus Calle AbadAún no hay calificaciones
- Examen Parcial QGI Solución 09 Julio 2008Documento6 páginasExamen Parcial QGI Solución 09 Julio 2008carlos stalin carlosAún no hay calificaciones
- Informe de Lab. 15 Q.a.ii - Grupo 3Documento6 páginasInforme de Lab. 15 Q.a.ii - Grupo 3kevin saraguroAún no hay calificaciones
- Solubilidad: Carrera de Ingeniería QuímicaDocumento6 páginasSolubilidad: Carrera de Ingeniería QuímicaJimin PipersAún no hay calificaciones
- Reporte Pia LqaDocumento6 páginasReporte Pia LqaMoises MontelongoAún no hay calificaciones
- 8 AEDT Formacion de ComplejosDocumento4 páginas8 AEDT Formacion de ComplejosHéctor Fabio Hernández SánchezAún no hay calificaciones
- Concentracion de Las SolucionesDocumento20 páginasConcentracion de Las SolucionesMIGUEL100% (1)
- Determinación de Ácido Ascórbico Por Valoraciones Con Bromato de PotasioDocumento17 páginasDeterminación de Ácido Ascórbico Por Valoraciones Con Bromato de PotasioEstefania Enriquez Mallama0% (1)
- U SolucionesDocumento34 páginasU SolucionessebastianAún no hay calificaciones
- Volumetria FACTOR de SOLUCION Titulacion PDFDocumento3 páginasVolumetria FACTOR de SOLUCION Titulacion PDFLopez1980Aún no hay calificaciones
- Informe de Laboratorio Semana 5Documento9 páginasInforme de Laboratorio Semana 5Brandon EspinozaAún no hay calificaciones
- Eq3p9 RevDocumento6 páginasEq3p9 RevAreli CervantesAún no hay calificaciones
- Titulacion de Peroxido de Hidrogeno en Agua OxigenadaDocumento12 páginasTitulacion de Peroxido de Hidrogeno en Agua OxigenadaJulieth Karina Mendoza AcostaAún no hay calificaciones
- Propiedades ColigativasDocumento15 páginasPropiedades ColigativasmarialuisallamocaAún no hay calificaciones
- Clase SolucionesssDocumento9 páginasClase SolucionesssAlcides RamosAún no hay calificaciones
- Disoluciones Ejercicios de La GuiaDocumento7 páginasDisoluciones Ejercicios de La GuiaLia CastilloAún no hay calificaciones
- Determinacion de NitrogenoDocumento6 páginasDeterminacion de NitrogenoEzmyytha CaZtiillo ReyynaAún no hay calificaciones
- Química II 2Documento16 páginasQuímica II 2snauzk RojasAún no hay calificaciones
- Practica de Laboratorio 4 y 5Documento15 páginasPractica de Laboratorio 4 y 5marifer cruz calderonAún no hay calificaciones
- Practica 15Documento3 páginasPractica 15EnriqueAún no hay calificaciones
- Obtencion de Carbonato de Calcio 1Documento6 páginasObtencion de Carbonato de Calcio 1cm 2Aún no hay calificaciones
- Preparation of Common Types of Desk Reagents Specified in Standard MethodsDocumento541 páginasPreparation of Common Types of Desk Reagents Specified in Standard Methodsdiana benites salcedoAún no hay calificaciones
- B1 - FYQ - U03 - MGH - Estequiometria y Energia de Las Reacciones Quimicas - SDocumento8 páginasB1 - FYQ - U03 - MGH - Estequiometria y Energia de Las Reacciones Quimicas - SAlicia Garcia BallesterosAún no hay calificaciones
- Práctica 9Documento7 páginasPráctica 9Cristian SaldanaAún no hay calificaciones
- Práctica 10. Valoraciones Potenciométricas de OxidoreducciónDocumento12 páginasPráctica 10. Valoraciones Potenciométricas de OxidoreducciónItzel Vargas100% (1)
- Standard Methods For The Examination of 23 Edition Unlocked 1 en EsDocumento106 páginasStandard Methods For The Examination of 23 Edition Unlocked 1 en Eshecor hernandez0% (1)
- Preparación de Soluciones QAII-2020Documento9 páginasPreparación de Soluciones QAII-2020Mariana PerezAún no hay calificaciones
- Método Winkler Determinación de Oxigeno Disuelto en Agua PotableDocumento10 páginasMétodo Winkler Determinación de Oxigeno Disuelto en Agua Potablejuan100% (1)
- Lab 3Documento3 páginasLab 3Gian Juarez RondoAún no hay calificaciones
- QUIMICA 2 000000docxDocumento14 páginasQUIMICA 2 000000docxCarla Flores DiasAún no hay calificaciones
- Represent Ante 1Documento3 páginasRepresent Ante 1Lilibeth VeroyAún no hay calificaciones
- ACTIVIDAD 09 REDOX SOLUCIONES - Alondra Marchena Am20-0965 PDFDocumento7 páginasACTIVIDAD 09 REDOX SOLUCIONES - Alondra Marchena Am20-0965 PDFAlondra Marchena GarciaAún no hay calificaciones
- Reporte Analisis de AceiteDocumento11 páginasReporte Analisis de Aceite'Saul 'EduardoAún no hay calificaciones
- Practica de Analisis de ClorurosDocumento6 páginasPractica de Analisis de Cloruros'Saul 'EduardoAún no hay calificaciones
- Practica SulfatosDocumento9 páginasPractica Sulfatos'Saul 'EduardoAún no hay calificaciones
- Determinacion de SiO2Documento4 páginasDeterminacion de SiO2'Saul 'EduardoAún no hay calificaciones
- Metodos Dif y IntDocumento14 páginasMetodos Dif y Int'Saul 'EduardoAún no hay calificaciones
- Precios de Ref.Documento15 páginasPrecios de Ref.yazminconygriegaAún no hay calificaciones
- Prueba HidrocarburosDocumento4 páginasPrueba HidrocarburosNicole Alejandra Abarca CamposAún no hay calificaciones
- Tarea3 G33Documento42 páginasTarea3 G33jairoAún no hay calificaciones
- 2.1. Riesgos Químicos y Equipo de Protección PersonalDocumento22 páginas2.1. Riesgos Químicos y Equipo de Protección PersonalCharly ContrerasAún no hay calificaciones
- Nec2011-Cap.14-Energías Renovables-021412Documento110 páginasNec2011-Cap.14-Energías Renovables-021412Mercedez BenzAún no hay calificaciones
- Guia No 1 - III Periodo 8° Dilatación TérmicaDocumento5 páginasGuia No 1 - III Periodo 8° Dilatación Térmicadana perezAún no hay calificaciones
- Catalogo Vam PDFDocumento23 páginasCatalogo Vam PDFVíctor MezquitaAún no hay calificaciones
- Tipos de LigandosDocumento6 páginasTipos de LigandosTatianaBohorquezAún no hay calificaciones
- Acero en EcuadorDocumento13 páginasAcero en EcuadorCynthia Tandalla0% (1)
- Practica 2Documento3 páginasPractica 2MILLER GANDHY REA SALASAún no hay calificaciones
- Sintesis y Caracterizacion UV-Vis Del Complejo Tris Acetilacetonato de Manganeso (III)Documento3 páginasSintesis y Caracterizacion UV-Vis Del Complejo Tris Acetilacetonato de Manganeso (III)Jorge CalderonAún no hay calificaciones
- Revision 1 Catabolismo 1 2Documento2 páginasRevision 1 Catabolismo 1 2liss alvaradoAún no hay calificaciones
- Hidrostefra, Litosfera y Atmosfera - Desarrollo SustentableDocumento5 páginasHidrostefra, Litosfera y Atmosfera - Desarrollo SustentableLuis Felipe Tam Glez.Aún no hay calificaciones
- Sustancias y Preparados PeligrososDocumento42 páginasSustancias y Preparados Peligrososedgardo villazon gutierrezAún no hay calificaciones
- INFORME Prácticas Volumen Molar ParcialDocumento4 páginasINFORME Prácticas Volumen Molar ParcialVale SanchezAún no hay calificaciones
- MSDS Dye Check 4Documento4 páginasMSDS Dye Check 4jaimito2324Aún no hay calificaciones
- Informe Fisica 9Documento8 páginasInforme Fisica 9JoselyNoemiSánchezMedinaAún no hay calificaciones
- Teoria Cuantica Por Max PlanckDocumento10 páginasTeoria Cuantica Por Max PlanckAdrian Navarro HdezAún no hay calificaciones
- Desengrasante Emulsionable - Limpieza Extrema 3BSI FTDocumento1 páginaDesengrasante Emulsionable - Limpieza Extrema 3BSI FT3BSI SACAún no hay calificaciones
- Diagrama de Proceso y de Equipos-PenicilinaDocumento2 páginasDiagrama de Proceso y de Equipos-PenicilinaCarlos Alberto Abaunza CamachoAún no hay calificaciones
- Práctica8 Org2Documento3 páginasPráctica8 Org2Lilibeth Pamela Arispe Guerra50% (2)
- CalidaddelAire Transporte de ContaminantesDocumento16 páginasCalidaddelAire Transporte de ContaminantesfaduAún no hay calificaciones
- Analisis de La Formacion de Una Sal Co Mpleja - Complejos de Werner - 1Documento3 páginasAnalisis de La Formacion de Una Sal Co Mpleja - Complejos de Werner - 1milagrosAún no hay calificaciones
- Manipulación GenéticaDocumento6 páginasManipulación GenéticaMagaly Castillo OrtizAún no hay calificaciones
- Practica 5Documento7 páginasPractica 5Miguel Guerrero100% (1)
- Fluidos Newtonianos y No NewtonianosDocumento20 páginasFluidos Newtonianos y No NewtonianosAlex Junior Durand OrdoñezAún no hay calificaciones
- Factores Que Influyen en El Crecimiento yDocumento8 páginasFactores Que Influyen en El Crecimiento yAnthony BaltazarAún no hay calificaciones
- Preguntas Del Examen Integrador - Giselle MontenegroDocumento20 páginasPreguntas Del Examen Integrador - Giselle Montenegromicaela.tapiaAún no hay calificaciones
- Multipro 3000Documento2 páginasMultipro 3000RICARDO DONOSOAún no hay calificaciones
- Practica 7 InorganicaDocumento6 páginasPractica 7 InorganicaVíctor JímenezAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La conciencia infinita: El viaje de un neurocirujano al corazón del universo conscienteDe EverandLa conciencia infinita: El viaje de un neurocirujano al corazón del universo conscienteCalificación: 4.5 de 5 estrellas4.5/5 (4)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Guía práctica para la refracción ocularDe EverandGuía práctica para la refracción ocularCalificación: 5 de 5 estrellas5/5 (2)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Había una vez el átomo: O cómo los científicos imaginan lo invisibleDe EverandHabía una vez el átomo: O cómo los científicos imaginan lo invisibleCalificación: 5 de 5 estrellas5/5 (3)
- Historia del cuerpo humano: Evolución, salud y enfermedadDe EverandHistoria del cuerpo humano: Evolución, salud y enfermedadAún no hay calificaciones
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- Zang Fu: Revelando la Cara del SíndromeDe EverandZang Fu: Revelando la Cara del SíndromeCalificación: 4.5 de 5 estrellas4.5/5 (2)
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)