Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Construc Pourbaix Fe
Cargado por
Andreea Tataru Stanci0 calificaciones0% encontró este documento útil (0 votos)
16 vistas1 páginaDerechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
16 vistas1 páginaConstruc Pourbaix Fe
Cargado por
Andreea Tataru StanciCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
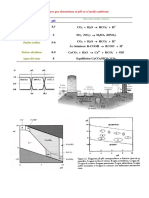
Construcción diagrama pE-pH (diagrama de Pourbaix) para el Fe
1º) Reducción del Fe3+ a Fe2+: (línea a)
Fe3+ + e- ⇔ Fe2+ Eº = 0.77v ó pE = 13.05
2º) Disolución del precipitado de Fe(OH)3: (línea b)
{Fe3+}
Fe(OH)3 + 3H+ ⇔ Fe3+ + 3H2O Ks = = 9,1.103 (Cte de solubilidad)
{H +}3
Despejamos [H+] y tomando log ⇒ pH = 1.32 - ⅓log[Fe3+]
Concentración máxima de Fe3+ soluble en agua: 10-5 M, → pH = 2.99.
3º) Interconversión del Fe(OH)3 a Fe2+: (línea c)
Fe(OH)3 + 3H+ + e- ⇔ Fe2+ + 3H2O
( Fe2+ )
E = Eº -0.059 log = Eº - 0.059log[Fe2+] – (0.059 x 3)pH
(H )+ 3
Considerando [Fe2+] = 10-5 M y Eº = 1.01v: → pE = 22.2 – 3 pH
4º) Hidrólisis del Fe2+: (línea d)
{Fe2+}
Fe(OH)2 + 2H+ ⇔ Fe2+ + 2H2O Ks = = 8,0.1012
{H +}2
Concentración máxima de Fe2+ soluble en agua: 10-5 M, → pH = 8.95
5º) Fe(OH)3 + H+ + e- ⇔ Fe(OH)2(s) + H2O (línea e)
1
E = Eº -0.059 log = Eº - 0.059pH; pE = pEº - pH = 4.3 - pH
( H +)
También podría gustarte
- Evaluacion de Avance - 3er Cons. IngarocaDocumento9 páginasEvaluacion de Avance - 3er Cons. IngarocaDani IngarocaAún no hay calificaciones
- Actividad Domiciliaria N°1Documento6 páginasActividad Domiciliaria N°1Frankin C. Tovar MendozaAún no hay calificaciones
- Actividad Domiciliaria N°1Documento6 páginasActividad Domiciliaria N°1Frankin C. Tovar MendozaAún no hay calificaciones
- Diagrama de Pourbaix Del AguaDocumento31 páginasDiagrama de Pourbaix Del AguaYesz Iml50% (2)
- Problemas Resueltos HidrometalurgiaDocumento18 páginasProblemas Resueltos HidrometalurgiaItzel HernandezAún no hay calificaciones
- Ejercicios 1,2, y 3 Ing. Ambiental IDocumento11 páginasEjercicios 1,2, y 3 Ing. Ambiental Ianais zambranoAún no hay calificaciones
- Set de Problemas 1 - Maria CristinaDocumento18 páginasSet de Problemas 1 - Maria CristinaCésar González LagosAún no hay calificaciones
- Ejercicios 5.2 y 5.7Documento3 páginasEjercicios 5.2 y 5.7IRIS YANETH GOMEZ RODRIGUEZAún no hay calificaciones
- Examen de Hidrometalurgia I: Problemas resueltos de equilibrios electroquímicos y cálculos de pHDocumento7 páginasExamen de Hidrometalurgia I: Problemas resueltos de equilibrios electroquímicos y cálculos de pHAlex Franz Orosco QuintanaAún no hay calificaciones
- CarsolioVanesa DiagramaPourbaixFeDocumento11 páginasCarsolioVanesa DiagramaPourbaixFeVania Carsolio ReneaumAún no hay calificaciones
- Hoja 3 ResDocumento27 páginasHoja 3 ResA A Asdasd DfAún no hay calificaciones
- Previo 1Documento4 páginasPrevio 1Fernanda E Ortíz0% (1)
- Métodos de PrecipitaciónDocumento14 páginasMétodos de PrecipitaciónJuan Manuel Uceda PérezAún no hay calificaciones
- ACTIVIDAD DOMICILIARIA N°1 - Tercer ConsolidadoDocumento2 páginasACTIVIDAD DOMICILIARIA N°1 - Tercer ConsolidadoDaniels Felix Tinoco Orihuela0% (1)
- Análisis de iones metálicos en aguasDocumento23 páginasAnálisis de iones metálicos en aguasCarlos Alexis Sepulveda HenriquezAún no hay calificaciones
- A Partir de Pirita Producir Hematita y Gas de Dióxido de AzufreDocumento8 páginasA Partir de Pirita Producir Hematita y Gas de Dióxido de AzufreFelipe SantanderAún no hay calificaciones
- Quimica Analitica 1 - RedoxDocumento42 páginasQuimica Analitica 1 - RedoxSoniaMonroyAún no hay calificaciones
- Talleres Ac-Base CarbonatoDocumento13 páginasTalleres Ac-Base CarbonatoMauricio RodriguezAún no hay calificaciones
- Procesos hidro-electrometalúrgicos para la recuperación de cobre y uranioDocumento6 páginasProcesos hidro-electrometalúrgicos para la recuperación de cobre y uranioGuss TavooAún no hay calificaciones
- Diagrama Potencial PHDocumento29 páginasDiagrama Potencial PHRoberto Sebastian Andres Araya ContrerasAún no hay calificaciones
- REPASODocumento7 páginasREPASOQuiñonez Romero BrandonAún no hay calificaciones
- Oxidorreducción y AcidezDocumento27 páginasOxidorreducción y AcidezWILFREDO ROMAN PAUCARAún no hay calificaciones
- Separacion PDFDocumento35 páginasSeparacion PDFMisaelAún no hay calificaciones
- Remoción de FósforoDocumento7 páginasRemoción de FósforoAlondra MondragónAún no hay calificaciones
- Volumetría Redox IIDocumento26 páginasVolumetría Redox IISol PolitanoAún no hay calificaciones
- 14.02 Ionización de AguaDocumento2 páginas14.02 Ionización de AguaYajaira EspinozaAún no hay calificaciones
- Problemas Resueltos Hidrometalurgia - Cesar Gonzalez Lagos - Academia - EduDocumento13 páginasProblemas Resueltos Hidrometalurgia - Cesar Gonzalez Lagos - Academia - EduNicolas Martinez100% (1)
- EJercicios Resueltos Sobre PH y POHDocumento16 páginasEJercicios Resueltos Sobre PH y POHWilliam A Lopez QuejAún no hay calificaciones
- Clase 06 Grupo 16Documento9 páginasClase 06 Grupo 16Jose Manuel Quispe RiveraAún no hay calificaciones
- Tarea 02 Lixiviación y Diagramas de PourbaixDocumento13 páginasTarea 02 Lixiviación y Diagramas de PourbaixDaniel Bacilio RoldanAún no hay calificaciones
- Clase 10 Ejercicios de SolubilidadDocumento3 páginasClase 10 Ejercicios de SolubilidadClaudia AscencioAún no hay calificaciones
- Tratamiento de Agua-1Documento13 páginasTratamiento de Agua-1GabrielyNoelia GarayAún no hay calificaciones
- 3a. QI - Unidad 3 (Parte 1) - Ejercicios ModeloDocumento18 páginas3a. QI - Unidad 3 (Parte 1) - Ejercicios Modeloyessie varelaAún no hay calificaciones
- 4.06 Diagramas de PourbaixDocumento4 páginas4.06 Diagramas de PourbaixConstanza BergAún no hay calificaciones
- Paso 2-QA2022I-Primera ParteDocumento6 páginasPaso 2-QA2022I-Primera ParteVictor Segovia CandiaAún no hay calificaciones
- Hidroxidos y Ácidos IDocumento5 páginasHidroxidos y Ácidos ILuisito MarquinaAún no hay calificaciones
- ÁCIDOS Y BASES - Tarea Semana 10Documento3 páginasÁCIDOS Y BASES - Tarea Semana 10Fiorella Rios Goñy0% (1)
- Ejercicios Acido BaseDocumento12 páginasEjercicios Acido BaseGISELLA MANCHAY TOCTOAún no hay calificaciones
- Química para PrimariaDocumento6 páginasQuímica para PrimariaJhimy Castro P100% (1)
- Taller Módulo 1 BioquímicaDocumento11 páginasTaller Módulo 1 BioquímicaMarian Pineda GarciaAún no hay calificaciones
- Repsaso Equilibrios QuimicosDocumento6 páginasRepsaso Equilibrios QuimicosJuan Ignacio FabregasAún no hay calificaciones
- Quimica 1 Esmi Ejercicios de Acidos y Bases y ElectroquimicaDocumento7 páginasQuimica 1 Esmi Ejercicios de Acidos y Bases y ElectroquimicaDENNIS - CONDORIAún no hay calificaciones
- Equilibrio ácido-base: pH, Ka y KbDocumento49 páginasEquilibrio ácido-base: pH, Ka y KbPancho VillasAún no hay calificaciones
- Guia QuimicaDocumento4 páginasGuia QuimicaPablo MartínezAún no hay calificaciones
- MÓDULO 20 - III BIM - CyT - 3ERODocumento5 páginasMÓDULO 20 - III BIM - CyT - 3EROREBECA REYES QUISPEAún no hay calificaciones
- TP N°9-Equilibrio Ácido - Base y Dis IonicaDocumento8 páginasTP N°9-Equilibrio Ácido - Base y Dis Ionicagino MamaniAún no hay calificaciones
- Examen-junio-Andalucc3ada-Quc3admica-Selectividad-2012 para Hacer Con Oscar y AinhDocumento6 páginasExamen-junio-Andalucc3ada-Quc3admica-Selectividad-2012 para Hacer Con Oscar y AinhSrr -'Aún no hay calificaciones
- 7 ElectroquimicaDocumento15 páginas7 ElectroquimicaPeter Poma AriasAún no hay calificaciones
- Calculo de Los Gramos y Datos Del DiagramaDocumento6 páginasCalculo de Los Gramos y Datos Del DiagramaRodrigo Colin HerreraAún no hay calificaciones
- Ácidos y Bases para Quinto Grado de SecundariaDocumento3 páginasÁcidos y Bases para Quinto Grado de SecundariaGray D L LeoAún no hay calificaciones
- Solucionario del seminario - pH y KspDocumento7 páginasSolucionario del seminario - pH y KspAlbert FernandezAún no hay calificaciones
- Quimica Analitica 1 - RedoxDocumento42 páginasQuimica Analitica 1 - RedoxOmar LevaAún no hay calificaciones
- Sesion 3 RX Quimicas C-Redox D-Ion ElectronDocumento20 páginasSesion 3 RX Quimicas C-Redox D-Ion ElectronMarco AntonioAún no hay calificaciones
- Seminar Cres To DoDocumento11 páginasSeminar Cres To Dolinda brownAún no hay calificaciones
- WiffyDocumento10 páginasWiffyandreeastanciAún no hay calificaciones
- Transp T1 07Documento3 páginasTransp T1 07Andreea Tataru StanciAún no hay calificaciones
- Seminario No 1Documento1 páginaSeminario No 1andreeastanciAún no hay calificaciones
- Tratamientos AguaDocumento6 páginasTratamientos AguaandreeastanciAún no hay calificaciones
- Tratamientos AguaDocumento11 páginasTratamientos AguaandreeastanciAún no hay calificaciones
- Reduccion Particulas y Contaminacion Espacios CerradosDocumento7 páginasReduccion Particulas y Contaminacion Espacios CerradosAndreea Tataru StanciAún no hay calificaciones
- Resumen Informe Ipcc2007 AmbientaDocumento6 páginasResumen Informe Ipcc2007 AmbientaandreeastanciAún no hay calificaciones
- Universidad de Malaga PDFDocumento16 páginasUniversidad de Malaga PDFCarlos Ferrer LuppiAún no hay calificaciones
- Figt8 09Documento2 páginasFigt8 09Andreea Tataru StanciAún no hay calificaciones
- FORMULACION QuimicaDocumento9 páginasFORMULACION QuimicaandreeastanciAún no hay calificaciones
- Seminario No 4 sobre contaminación y depuración de aguasDocumento2 páginasSeminario No 4 sobre contaminación y depuración de aguasAndreea Tataru StanciAún no hay calificaciones
- Forza Mien ToDocumento1 páginaForza Mien ToandreeastanciAún no hay calificaciones
- Lluvia Acida Corrosion SmogDocumento15 páginasLluvia Acida Corrosion SmogandreeastanciAún no hay calificaciones
- Ar4 Syr SPDocumento114 páginasAr4 Syr SPRaúl García CruzAún no hay calificaciones
- Contaminacion y Tratamiento Aguas ResidualesDocumento23 páginasContaminacion y Tratamiento Aguas ResidualesAndreea Tataru StanciAún no hay calificaciones
- Fotocopias T3Documento2 páginasFotocopias T3andreeastanciAún no hay calificaciones
- Valores Limites Aire Junta AndaluciaDocumento2 páginasValores Limites Aire Junta AndaluciaAndreea Tataru StanciAún no hay calificaciones
- Metales Pesados Resumen 06Documento2 páginasMetales Pesados Resumen 06Andreea Tataru StanciAún no hay calificaciones
- Fotocopias T3Documento2 páginasFotocopias T3andreeastanciAún no hay calificaciones
- Seminario No 3Documento1 páginaSeminario No 3Andreea Tataru StanciAún no hay calificaciones
- Representaci N de Las Estructuras de LewisDocumento1 páginaRepresentaci N de Las Estructuras de LewisAndreea Tataru StanciAún no hay calificaciones
- OBR 3 Ano20010 11Documento6 páginasOBR 3 Ano20010 11Andreea Tataru StanciAún no hay calificaciones
- Obr 5 PDFDocumento7 páginasObr 5 PDFAndreea Tataru StanciAún no hay calificaciones
- TitulationDocumento15 páginasTitulationAndreea Tataru StanciAún no hay calificaciones
- OBR 4 Golfo de Cadiz4Documento9 páginasOBR 4 Golfo de Cadiz4Andreea Tataru StanciAún no hay calificaciones
- ProgramasAsignaturas Titulacion 99 AsigUMA 7972 PoluareDocumento2 páginasProgramasAsignaturas Titulacion 99 AsigUMA 7972 PoluareandreeastanciAún no hay calificaciones
- MeniuDocumento6 páginasMeniuAndreea Tataru StanciAún no hay calificaciones
- Valores Limites Aire Junta AndaluciaDocumento2 páginasValores Limites Aire Junta AndaluciaAndreea Tataru StanciAún no hay calificaciones
- Ordenacion Del Territorio y Proteccion Del Agua SubterraneaDocumento10 páginasOrdenacion Del Territorio y Proteccion Del Agua SubterraneaAndreea Tataru StanciAún no hay calificaciones