Documentos de Académico
Documentos de Profesional
Documentos de Cultura
3ra Tabla 94
Cargado por
Renzo VegaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
3ra Tabla 94
Cargado por
Renzo VegaCopyright:
Formatos disponibles
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
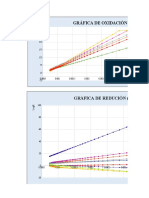
ENERGIA LIBRE ESTANDAR DE FORMACION: ΔG°= ΔH°- ΔS°T 94
Los siguientes datos termoquímicos son de energía libre estándar de formación de óxidos,
sulfuros, haluros, arseniuros, carburos, hidruros, nitruros, carbonatos, hidróxidos y silicatos más
comunes.
Se usa la forma lineal (recta: Y = a + mx) del cambio de energía libre: ΔG°= ΔH°- ΔS°T
NOTA: Estos, son extractos de los Datos Termoquímicos del “Metallurgical Thermochemistry” de
O. KUBASCHEWSKI y C. B. ALCOCK, donde:
< > = sólido, { } = líquido, y ( ) = gas; m, punto de fusión (metal); M, punto de fusión (compuesto);
b, punto de ebullición (metal); B, punto de ebullición (compuesto); S, punto de sublimación
(compuesto); D, punto de disociación (compuesto); t, cambio de fase.
A continuación, se tabulan los ΔGº de formación de dichas funciones químicas.
ΔG°= ΔH°- ΔS°T
FORMACIÓN DE OXIDOS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
2<Ag> + 0,5(O2) = <Ag2O) -28 117 -60,626 298-1000
2<Al> + 1,5(O2) = <Al2O3> -1 675 100 -313,195 298-933(m)
2{Al} + 1,5(O2) = <Al2O3> -1 682 927 -323,239 933-2315(M)
2{Al} + 1,5(O2) = {Al2O3} -1 574 106 -275,011 2315-2766,8(b)
2(Al) + 1,5(O2) = {Al2O3} -2 106 430 -468,619 2766,8-3500
<Ba> + 0,5(O2) = <BaO> -568 187 -97,069 298-1002(m)
{Ba} + 0,5(O2) = <BaO> -557 183 -102,675 1002-1895(b)
<C> + 0,5(O2) = (CO) -112 877 +86,514 298-2500
<C> + (O2) = (CO2) -394 762 +0,836 298-2500
<Ca> + 0,5(O2) = <CaO> -633 144 -98,993 298-1112(m)
{Ca} + 0,5(O2) = <CaO> -640 152 -108,575 1112-1764(b)
(Ca) + 0,5(O2) = <CaO> -795 378 -195,058 1764-2500
<Cd>} + 0,5(O2) = <CdO> -198 996 -97,679 298-594(m)
{Cd} + 0,5(O2) = <CdO> -263 174 -104,935 594(m)-1040(b)
(Cd) + 0,5(O2) = <CdO> -356 657 -198,531 1040-1500
<Co> + 0,5(O2) = <CoO> -233 886 -70,710 298-1400
2<Cr> + 1,5(O2) = <Cr2O3> -1 110 140 -247,316 1173-1923
<Cr> + 0,5(O2) = {CrO} -334 218 -63,806 1938-2023(M)
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
2<Cu> + 0,5(O2) = <Cu2O> -168 406 -71,254 298-1356(m) 95
2{Cu} + 0,5(O2) = <Cu2O> -181 692 -80,563 1356-1509(M)
2{Cu} + 0,5(O2) = {Cu2O} -118 742 -39,455 1509-2273
<Cu> + 0,5(O2) = <CuO> -152 522 -85,253 298-1356(m)
<Fe> + 0,5(O2) = <FeO> -264 002 -64,591 298-1650
{Fe} + 0,5(O2) = {FeO} -256 061 -53,681 1644(M)-2273
3<Fe> + 2,0(O2) = <Fe3O4> -1 103 120 -307,378 298-1870(M)
2<Fe> + 1,5(O2) = <Fe2O3> -815 023 -251,117 298-1735
(H2) + 0,5(O2) = (H2O) -247 392 -55,849 298-2500
2{K} + 0,5(O2) = <K2O> -363 233 -140,351 336(m)-1037(b)
2(K) + 0,5(O2) = <K2O> -478 738 -252,954 1037-2000
2{Li} + 0,5(O2) = <Li2O> -603 834 -136,586 454(m)-1620(b)
2(Li) + 0,5(O2) = <Li2O> -854 662 -290,780 1620-1843(M)
<Mg> + 0,5(O2) = <MgO> -601 230 -107,586 298-922(m)
{Mg} + 0,5(O2) = <MgO> -609 571 -116,522 922-1378(b)
(Mg) + 0,5(O2) = <MgO> -732 702 -205,988 1378-2000
<Mn> + 0,5(O2) = <MnO> -388 861 -76,316 298-1517(m)
3<Mn> + 2,0(O2) = <Mn3O4> -1 384 904 -344,427 298-1517(m)
2<Mn> + 1,5(O2) = <Mn2O3> -953 952 -255,224 298-1517(m)
<Mo> + (O2) = <MoO2> -578 229 -166,523 298-2273
<Mo> + (O2) = (MoO2) -18 410 +33,890 298-2273
0,5(N2)+0,5(O2) = (NO) +90 416 +12,678 298-2273
0,5(N2)+ (O2) = (NO2) +32 300 -63,346 298-2273
<Ni> + 0,5(O2) = <NiO> -235 797 -86,195 298-1728(m)
{Pb} + 0,5(O2) = <PbO>red -221 505 -104,600 600(m)-762(t)
{Pb} + 0,5(O2) = <PbO>amari -218 137 -100,177 762-1170(M)
{Pb} + 0,5(O2) = <PbO> -219 143 -101,150 600-1170(M)
{Pb} + 0,5(O2) = {PbO} -185 080 -72,028 1170-1789(B)
3{Pb} + 2,0(O2) = <Pb3O4> -702 494 -368,945 600-1473
{Pb} + (O2) = <PbO2> -272 378 -193,677 600-1173
0,5(S2)+ (O2) = (SO2) -361 665 -72,676 718(b)-2273
0,5(S2)+1,5(O2) = (SO3) -457 897 -163,343 718(b)-2273
2<Sb> + 1,5(O2) = <Sb2O3> -687 600 -241,082 298-904(m)
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
<Si> + (O2) = <SiO2>cuarzo -907 091 -175,728 298-1685(m) 96
<Si> + (O2) = <SiO2>cristob -904 757 -173,829 298-1685(m)
{Si} + (O2) = <SiO2>cristob -946 348 -197,643 1685-1996(M)
{Si} + (O2) = {SiO2} -921 737 -185,906 1996-3514(b)
2<V> + 2,5(O2) = {V2O5} -1 447 371 -321,582 943(M)-2273
<W> + 1,5(O2) = <WO3> -833 453 -245,433 298-1745(M)
<Zn> + 0,5(O2) = <ZnO> -350 074 -99,222 298-693(m)
{Zn} + 0,5(O2) = <ZnO> -356 054 -107,847 693(m)-1180(b)
(Zn) + 0,5(O2) = <ZnO> -464 923 -200,109 1180-1973
==================================================================
FORMACIÓN DE SULFUROS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
2<Ag> + 0,5(S2) = <Ag2S) -161 251 -168,573 298-1103(M)
<Ca> + 0,5(S2) = <CaS> -541 556 -95,437 298-721
<Ca> + 0,5(S2) = <CaS> -542 037 -96,065 721-1112(m)
{Ca} + 0,5(S2) = <CaS> -548 104 -103,847 1112-1764(b)
{Cd} + 0,5(S2) = <CdS> -215 476 -97,194 594(m)-1040(b)
(Cd) + 0,5(S2) = <CdS> -310 666 -184,724 1100-1500
2<Cu> + 0,5(S2) = <Cu2S> -140 708 -43,346 298-708
2<Cu> + 0,5(S2) = <Cu2S> -131 796 -30,794 708-1359(m)
<Cu> + 0,5(S2) = <CuS> -115 604 -76,065 298-708
<Cu>+ <Fe> +(S2)=<CuFeS2> -278 613 -115,311 830-973
<Fe> + 0,5(S2) = <FeS> -154 934 -56,861 1179-1261
<Fe> + 0,5(S2) = {FeS} -164 013 -61,086 1261-1468(M)
<Fe> + (S2) = <FeS2> -336 938 -244,513 903-1033
(H2) + 0,5(S2) = (H2S) -91 630 -50,585 298-2273
2{K} + 0,5(S2) = <K2S> -481 160 -143,511 336(m)-1037(b)
2(K) + 0,5(S2) = <K2S> -633 098 -289,779 1037-1221(M)
2(K) + 0,5(S2) = {K2S} -616 948 -276,552 1221-2000
2{Li} + 0,5(S2) = <Li2S> -514 632 -121,336 454(m)-1273
<Mg> + 0,5(S2) = <MgS> -409 614 -94,391 298-922(m)
{Mg} + 0,5(S2) = <MgS> -408 879 -97,981 922-1378(b)
(Mg) + 0,5(S2) = <MgS> -539 736 -193,050 1378-1973
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
<Mn> + 0,5(S2) = <MnS> -296 520 -76,735 973-1473 97
2<Mo> + 1,5(S2) = <Mo2S3> -594 128 -265,266 298-1473
<Mo> + (S2) = (MoS2) -397 480 -182,004 298-1458(M)
2{Na} + 0,5(S2) = <Na2S> -393 967 -83,709 371(m)-1156(b)
2(Na) + 0,5(S2) = <Na2S> -521 221 -200,058 1156-1223(M)
2(Na) + 0,5(S2) = {Na2S} -610 904 -274,698 1223-2000
3<Ni> + 0,5(S2) = <Ni3S2> -336 671 -162,878 298-1064(M)
3<Ni> + 0,5(S2) = {Ni3S2} -237 328 -62,426 1064-1728(m)
<Ni> + 0,5(S2) = <NiS> -153 602 -83,553 298-1067(M)
<Ni> + 0,5(S2) = {NiS} -111 742 -43,572 1067-1728(m)
{Pb} + 0,5(S2) = <PbS> -163 176 -88,031 600(m)-1386(M)
{Pb} + 0,5(S2) = (PbS) +58 953 +53,974 1100-1400
2{S} = (S2) +119 897 +139,602 388(m)-718(b)
{Zn} + 0,5(S2) = <ZnS> -277 818 -107,947 693(m)-1180(b)
(Zn) + 0,5(S2) = <ZnS> -375 382 -191,572 1120-2000
(Zn) + 0,5(S2) = (ZnS) +5 021 -30,543 1180-1973
==================================================================
FORMACIÓN DE HALUROS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
<Ag> + 0,5(Br2) = {AgBr} -97 305 -27,720 715-838
<Ag> + 0,5(Cl2) = {AgCl} -105 975 -25,380 803-1193
<Ag> + 0,5(I2) = {AgI} -74 130 -24,120 873-973
{Al} + 1,5(Cl2) = (AlCl3) -602 119 -67,948 933(m)-2273
2<Al> + 3,0(Cl2) = (Al2Cl6) -1 292 019 -242,212 298-933(m)
{Bi} + 1,5(Cl2) = {BiCl3} -351 121 -160,498 545(m)-712(B)
<Ca> + (Cl2) = <CaCl2> -794 542 -142,256 298-1045(M)
{Ca} + (Cl2) = {CaCl2} -798 558 -145,980 1112(m)-1764(b)
{Cd} + (Cl2) = <CdCl2> -389 614 -152,967 594(m)-841(M)
{Cd} + (Cl2) = {CdCl2} -352 621 -110,306 841(M)-1040(b)
<Cu> + 0,5(Cl2) = <CuCl> -134 926 -49,672 400-703(M)
<Cu> + 0,5(Cl2) = {CuCl} -116 022 -23,443 703(M)-1356(m)
<Cu> + 0,5(Cl2) = (CuCl) +86 224 +83,166 400-1356(m)
{Cu} + 0,5(Cl2) = (CuCl) +62 830 +66,475 1356(m)-2273
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
<Cu> + (Cl2) = <CuCl2> -203 136 -140,022 298-766(D) 98
<Fe> + (Cl2) = <FeCl2> -339 448 -119,152 298-950(M)
<Fe> + (Cl2) = {FeCl2} -286 395 -63,681 950(M)-1297(B)
<Fe> + (Cl2) = (FeCl2) -169 565 +26,504 1297(B)-1809(m)
<Fe> + 1,5(Cl2) = <FeCl3> -396 528 -210,392 298-577(M)
<Fe> + 1,5(Cl2) = (FeCl3) -261 284 -28,043 605(B)-1809(m)
0,5(H2) + 0,5(Cl2) = (HCl) -94 098 +6,402 298-2273
0,5(H2) + 0,5(F2) = (HF) -274 470 +3,473 298-2273
0,5(H2) + 0,5(I2) = (HI) -4 184 +8,828 298-2273
{Mg} + (Cl2) = {MgCl2} -596 831 -114,171 987(M)-1378(b)
<Mn> + (Cl2) = <MnCl2> -478 231 -127,696 298-923(M)
<Mn> + (Cl2) = {MnCl2} -440 575 -86,900 923(M)-1200
{Na} + 0,5(Cl2) = <NaCl> -411 622 -93,094 371(m)-1074(M)
(Na) + 0,5(Cl2) = {NaCl} -464 424 -133,888 1074(M)-1738(B)
3(Na)+{Al}+ 3(F2) = {Na3AlF6} -3 378 162 -623,416 1285(M)-2273
<Ni> + (Cl2) = <NiCl2> -305 432 -146,440 298-1260(S)
{Pb} + (Cl2) = {PbCl2} -324 553 -103,470 774(M)-1226(B)
{Pb} + (Cl2) = (PbCl2) -188 280 +7,531 1226(B)-2023(b)
<Si> + 2,0(F2) = (SiF4) -1 615 442 -144,432 298-1685(m)
{Sn} + (Cl2) = {SnCl2} -333 046 -118,407 520-925(B)
<Zn> + (Cl2) = <ZnCl2> -415 368 -153,323 298-591(M)
<Zn> + (Cl2) = {ZnCl2} -401 253 -129,286 591-693(m)
{Zn} + (Cl2) = {ZnCl2} -402 705 -131,650 693-1005(B)
{Zn} + (Cl2) = (ZnCl2) -278 245 -7,660 1005-1184(b)
(Zn) + (Cl2) = (ZnCl2) -393 417 -105,027 1184-2000
______________________________________________________
ARSENUROS, CARBUROS, HIDRUROS, NITRUROS Y FOSFUROS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
4{Al} + 3,0<C> = <Al4C3> -264 973 -95,061 933(m)-2473
{Al} + 0,5(N2) = <AlN> -327 063 -115,520 933(m)-2273
{Al} + 0,5(P2) = <AlP> -249 492 -104,349 933(m)-1973
<C> + 2,0(H2) = (CH4) -87 399 -108,738 298-2500
2<C> + 2,0(H2) = (C2H4) +40 389 -80,459 298-2500
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
{Ca} + 2,0<C> = <CaC2> -60 250 +26,276 1112(m)-1764(b) 99
3<Ca> + (N2) = <Ca3N2> -435 136 -198,740 298-1112(m)
3<Cr> + 2,0<C> = <Cr3C2> -79 078 +17,657 298-2130(m)
2<Cr> + 0,5<N2> = <Cr2C> -99 203 -46,986 1273-1673
3<Fe> + <C> = <Fe3C> +29 037 +28,033 298-1000
3<Fe> + <C> = <Fe3C> +11 234 +11,004 1000-1410
4(Fe) + 0,5(N2) = <Fe4N> -33 472 -69,789 673-953
3<Mg> + (N2) = <Mg3N2> -460 240 -202,924 298-922(m)
7<Mn> + 3,0<C> = <Mn7C3> -127 612 -21,087 298-1473
3<Mn> + <C> = <Mn3C> -19 933 +1,088 298-1310
2<Mo> + <C> = <Mo2C> -45 606 +4,184 298-1373
<Mo> + <C> = <MoC> -7 531 +5,439 298-973
0,5(N2) + 1,5(H2)= (NH3) -53 273 -116,524 298-2273
3<Ni> + <C> = <Ni3C> +39 748 +17,154 298-773
0,5(P2) + 1,5(H2) = (PH3) -71 546 -108,198 298-1973
<Si> + <C> = <SiC> -73 053 -7,657 298-1685(m)
{Si} + <C> = <SiC> -122 591 -37,028 1685-2273
<Si> + 0,5(P2) = <SiP> -130 541 +89,161 298-1683(D)
<Ti> + <C> = <TiC> -184 765 -12,552 298-1943(m)
<Ti> + 0,5(N2) = <TiN> -336 310 -93,261 298-1943(m)
<V> + <C> = <VC> -102 090 -9,581 298-2273
<V> + 0,5(N2) = <VN> -214 639 -82,425 298-2619(D)
<W> + <C> = <WC> -42 258 -4,979 1173-1575
==================================================================
FORMACIÓN DE CARBONATOS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
{Ba} + <C> + 1,5(O2) = <BaCO3> -1 203 277 -249,199 1073-1333
<Ca> + <C> + 1,5(O2) = <CaCO3> -1 196 312 -242,087 298-1112(m)
{Ca} + <C> + 1,5(O2) = <CaCO3> -1 196 247 -244,973 1112-1473
<Mg> + <C> + 1,5(O2) = <MgCO3> -1 109 527 -274,441 298-922(m)
2{Na} + <C>+ 1,5(O2) = <Na2CO3> -1 127 473 -273,642 371(m)-1156(b)
2(Na) + <C>+ 1,5(O2) = {Na2CO3} -1 229 560 -362,468 1123(M)-2500
===================================================================
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
FORMACIÓN DE HIDROXIDOS 100
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
<Ba> + (H2) + (O2) = <Ba(OH)2> -941 313 -291,129 298-681(M)
{Ba} + (H2) + (O2) = {Ba(OH)2} -918 395 -248,405 1002(m)-1263
<Ca> + (H2) + (O2) = <Ca(OH)2> -983 060 -285,165 298-1000
{K} +0,5(H2)+0,5(O2)= {KOH} -402 313 -117,955 673(M)-1037(b)
(K) +0,5(H2)+0,5(O2)= {KOH} -469 646 -182,873 1037-1600(B)
<Mg> + (H2) + (O2) = <Mg(OH)2> -922 925 -300,816 298-922(m)
{Na}+0,5(H2)+0,5(O2)= {NaOH} -408 107 -125,722 592(M)-1156(b)
(Na)+0,5(H2)+0,5(O2)= {NaOH} -486 618 -192,534 1156(b)-1663(B)
===================================================================
FORMACIÓN DE SILICATOS
REACCION ΔH°(J/mol) ΔS°(J/mol K) RANGO (K)
<Al2O3> + <SiO2> = <Al2O3.SiO2> -8 812 -3,891 298-1973
2<BaO> + <SiO2> = <2BaO.SiO2> -259 826 +5,858 298-2033
<BaO> + <SiO2> = <BaO.SiO2> -148 950 +6,276 298-1878(M)
3<CaO> + <SiO2> = <3CaO.SiO2> -118 826 +6,694 298-1773
2<CaO> + <SiO2> = <2CaO.SiO2> -118 826 +11,297 298-2403(M)
3<CaO> +2<SiO2> = <3CaO.2SiO2> -236 814 -9,623 298-1773
<CaO> + <SiO2> = <CaO.SiO2> -92 466 -2,510 298-1813(M)
<CaO>+<MgO>+<SiO2>=<CaO.MgO.SiO2> -124 683 -3,766 298-1473
<CaO>+<Al2O3>+<SiO2>=<CaO.Al2O3.SiO2> -105 855 -14,226 298-1673
2<FeO> + <SiO2> = <2FeO.SiO2> -36 233 -21,087 298-1493(M)
<K2O> + <SiO2> = <K2O.SiO2> -279 910 +0,460 298-1249(M)
2<MgO> + <SiO2> = <2MgO.SiO2> -67 195 -4,310 298-2171(M)
<MgO> + <SiO2> = <MgO.SiO2> -41 129 -6,109 298-1850(M)
2<MnO> + <SiO2> = <2MnO.SiO2> -53 555 -24,727 298-1618(M)
<MnO> + <SiO2> = <MnO.SiO2> -28 033 -2,761 298-1564(M)
<Na2O> + <SiO2> = <Na2O.SiO2> -237 651 -8,828 298-1362(M)
<Na2O> +2<SiO2> = <Na2O.2SiO2> -233 467 +3,849 298-1147(M)
2{PbO} + <SiO2> = {2PbO.SiO2} -33 472 +6,694 1158-1773
{PbO} + <SiO2> = {PbO.SiO2} -25 104 -1,255 1158-1773
2<ZnO> + <SiO2> = <2ZnO.SiO2> -36 401 -2,845 298-1785(M)
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
ECUACIONES DE PRESION DE VAPOR PARA DIFERENTES SUSTANCIAS 101
Log P = AT-1 + B.logT + C.T + D (torr)
Sustancia A B C.103 D Rango (K)
<Ag> -14 900 -0,85 0,0 12,20 298 - 1235,08(m)
{Ag} -14 400 -0,85 0,0 11,70 1235,08 - 2420(b)
{Al} -16 380 -1,00 0,0 12,32 933,61(m) - 2798(b)
<Ca> -9 350 -1,39 0,0 12,82 298 - 1112(m)
{Ca} -8 920 -1,39 0,0 12,45 1112 - 1757(b)
<Cd> -5 908 -0,232 -0,284 9,717 298 - 594,26(m)
{Cd} -5 819 -1,257 0,0 12,287 594,26(m) - 1040(b)
<Cu> -17 770 -0,86 0,0 12,29 298 - 1357(m)
{Cu} -17 520 -1,21 0,0 13,21 1357 - 2839(b)
<Fe> -21 080 -2,14 0,0 16,89 298 - 1811(m)
{Fe} -19 710 -1,27 0,0 13,27 1811 - 3135(b)
{Ga} -15 617 -0,795 0,0 12,337 302,9(m) - 2478(b)
{H2O} -2 900 -4,65 0,0 22,613 273,15(M) - 373,15(B)
{Hg} -3 305 -0,795 0,0 10,355 298 - 629,81(b)
{In} -12 580 -0,45 0,0 9,79 429,78(m) - 2346(b)
{K} -4 770 -1,37 0,0 11,58 336,35 - 1037(b)
{Li} -8 415 -1,00 0,0 11,34 453,7(m) - 1620(b)
<Mg> -7 849 -0,945 0,0 11,731 298 - 922(m)
{Mg} -7 784 -1,929 0,0 14,585 922 - 1363(b)
{Na} -5 780 -1,18 0,0 11,50 371 - 1177(b)
<NaCl> -12 440 -0,90 -0,46 14,31 298 - 1074(M)
{NaCl} -11 530 -3,48 0,0 20,77 1074 - 1738(B)
<Ni> -22 500 -0,96 0,0 13,60 298 - 1728(m)
{Ni} -22 400 -2,01 0,0 16,95 1728 - 3187(b)
{Pb} -10 130 -0,985 0,0 11,16 600,65 - 2023(b)
{Sx} -4 830 -5,00 0,0 23,88 388(m) - 717,8(b)
<Zn> -6 850 -0,755 0,0 11,24 298 - 692,73(m)
{Zn} -6 620 -1,255 0,0 12,34 692,73(m) - 1180(b)
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
POTENCIAL ESTÁNDAR DE REDUCCION (E° a 25°C) 102
Media-reacción E°(v)
Li+ + e- Li - 3,045
Ca(OH)2 + 2e- Ca + 2OH- - 3,030
K+ + e- K - 2,925
Cs+ + e- Cs - 2,920
Ba2+ + 2e- Ba - 2,900
Sr2+ + 2e- Sr - 2,890
Ca2+ + 2e- Ca - 2,870
Na+ + e- Na - 2,714
Mg(OH)2 + 2e- Mg + 2OH- - 2,690
Mg2+ + 2e- Mg - 2,370
H2AlO3- + H2O + 3e- Al + 4OH- - 2,350
H2(g) + 2e- 2H-(ac) - 2,250
Al3+ + 3e- Al - 1,680
Mn(OH)2 + 2e- Mn + 2OH- - 1,550
ZnS(s) + 2e- Zn(s) + S2-(ac) - 1,440
Cr(OH)3 + 3e- Cr + 3OH- - 1,300
Zn(CN)42- + 2e- Zn + 4CN- - 1,260
Zn(OH)2 + 2e- Zn + 2OH- - 1,245
ZnO22- + 2H2O + 2e- Zn + 4OH- - 1,216
CdS(s) + 2e- Cd(s) + S2-(ac) - 1,210
Mn2+ + 2e- Mn - 1,180
S + Hg2+ + 2e- HgS - 1,150
2SO32+ + 2H2O + 2e- S2O42- + 4OH- - 1,120
Cd(CN)42- + 2e- Cd + 4CN- - 1,030
Zn(NH3)42+ + 2e- Zn + 4NH3 - 1,030
FeS(s) + 2e- Fe(s) + S2-(ac) - 1,010
Cr2+ + 2e- Cr - 0,910
SO42-+ H2O + 2e- SO32- + 2OH- - 0,930
Fe(OH)2 + 2e- Fe + 2OH- - 0,877
2H2O + 2e- H2 + 2OH- (1 M OH-) - 0,8277
Cd(OH)2 + 2e- Cd + 2OH- - 0,809
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
Media-reacción E°(v) 103
2+ -
Zn + 2e Zn - 0,763
Cr3+ + 3e- Cr - 0,740
Co(OH)2 + 2e- Co + 2OH- - 0,730
Ni(OH)2 + 2e- Ni + 2OH- - 0,720
Ag2S + 2e- 2Ag + S2- - 0,690
Au(CN)2-- + e- Au + 2CN- - 0,600
2SO32-- + 3H2O + 4e- S2O32- + 6OH- - 0,580
Fe(OH)3 + e- Fe(OH)2 + OH- - 0,560
2CO2(g) + 2H+ + 2e- H2C2O4(aq) - 0,490
S(s) + 2e- S2-(ac) - 0,480
Bi2O3 + 3H2O + 6e- 2Bi + 6OH- - 0,440
Fe2+ + 2e- Fe - 0,440
Cr3+ + e- Cr2+ - 0,410
2H2O + 2e- H2 + 2OH- (1O-7 OH-, 1O-7 H3O+) - 0,410
Cd2+ + 2e- Cd - 0,403
2H3O+ + Se + 2e- H2Se + 2H2O - 0,400
Mn(OH)3 + e- Mn(OH)2 + OH- - 0,400
PbI2 + 2e- Pb + 2I- - 0,365
Cu(OH)2(s) + 2e- Cu(s) + 2OH-(ac) - 0,360
PbSO4 + 2e- Pb + SO42- - 0,356
Ag(CN)2- + e- Ag + 2CN- - 0,310
Co2+ + 2e- Co - 0,277
PbCl2 + 2e- Pb + 2Cl- - 0,268
V3+ + e- V2+ - 0,255
Ni2+ + 2e- Ni - 0,250
2SO42- + 4H3O+ + 2e- S2O62- + 6H2O - 0,220
CO2 + 2H3O+ + 2e- HCOOH + 2H2O - 0,196
AgI + e- Ag + I- - 0,151
Sn2+ + 2e- Sn - 0,136
CrO42- + 4H2O + 3e- Cr(OH)3 + 5OH- - 0,130
Pb2+ + 2e- Pb - 0,126
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
Media-reacción E°(v) 104
Cu(NH3)2+ -
+ e Cu + 2NH3 - 0,120
NO3- + 6H2O + 8e- NH3 + 9OH- - 0,120
MnO2 + 2H2O + 2e- Mn(OH)2 + 2OH- - 0,050
SO42- + 2H+ + 2e- SO32- + H2O - 0,040
2H3O+ + 2e- H2 + 2H2O (1 M H3O+) 0,000
2H+ + 2e- H2(g, 1 atm)) 0,000
NO3- + H2O + 2e- NO2- + 2OH- + 0,010
Ag(S2O3)23- + e- Ag + 2S2O32- + 0,015
S4O62- + 2e- 2S2O32- + 0,080
Mn(OH)3 + e- Mn(OH)2 + OH- + 0,100
CuCl + e- Cu + Cl- + 0,137
SO42- + 8H2O + 8e- S2- + 12H2O + 0,140
S + 2H+ + 2e- H2S + 0,141
2H3O+ + S + 2e- H2S + 2H2O + 0,141
Sn4+ + 2e- Sn2+ + 0,150
Cu2+ + e- Cu+ + 0,153
SO42- + 4H3O+ + 2e- H2SO3(ac) + 5H2O + 0,170
S(s) + 2H+ + 2e- H2S(g) + 0,170
S4O62- + 2e- 2S2O32- + 0,180
SO42- + 4H+ + 2e- SO2(g) + 2H2O + 0,200
AgCl(s) + e- Ag(s) + Cl- + 0,222
SO42- + 9H+ + 8e- HS- + 4H2O + 0,240
PbO2 + H2O + 2e- PbO + 2OH- + 0,248
IO3- + 3H2O + 6e- I- + 6OH- + 0,260
*Hg2Cl2 + 2e- 2Hg + 2Cl- (+ 0,280) + 0,334
Cu2+ + 2e- Cu + 0,337
SO42- + 10H+ + 8e- H2S(g) + 4H2O + 0,340
Ag2O + H2O + 2e- 2Ag + 2OH- + 0,342
SO42- + 8H+ + 6e- S + 4H2O + 0,350
ClO4- + H2O + 2e- ClO3- + 2OH- + 0,360
Fe(CN)63- + e- Fe(CN)64- + 0,360
Ag(NH3)2+ + e- Ag + 2NH3 + 0,373
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
Media-reacción E°(v) 105
+ - 2-
2H2SO3 + 2H3O + 4e S2O3 + 5H2O + 0,400
O2 + 2H2O + 4e- 4OH- (1 M OH-) + 0,401
Ag2CrO4 + 2e- 2Ag + CrO42- + 0,4463
NiO2 + 2H2O + 2e- Ni(OH)2 + 2OH- + 0,490
4H2SO3 + 4H+ + 6e- S4O62- + 6H2O + 0,510
Cu+ + e- Cu + 0,521
I2(s) + 2e- 2I- + 0,5355
I3- + 2e- 3I- + 0,536
Cu2+ + Cl- + e- CuCl + 0,538
H3AsO4 + 2H3O+ + 2e- H3AsO3 + 3H2O + 0,559
MnO4- + e- MnO42- + 0,564
MnO4- + 2H2O + 3e- MnO2(s) + 4OH- + 0,588
ClO3- + 3H2O + 6e- Cl- + 6OH- + 0,620
Cu2+ + Br- + e- CuBr + 0,640
O2 + 2H3O+ + 2e- H2O2 + 2H2O + 0,682
PtCl42- + 2e- Pt + 4Cl- + 0,730
Fe3+ + e- Fe2+ + 0,771
Hg22+ + 2e- 2Hg + 0,789
Ag+ + e- Ag + 0,7994
2NO3- + 4H3O+ + 2e- 2NO2 (ó N2O4) + 6H2O + 0,800
O2 + 4H3O+ + 4e- 6H2O (1O-7 OH-, 1O-7 H3O+) + 0,820
NO3- + 1OH3O+ + 8e- NH4+ + 13H2O + 0,840
NO3- + 2H+ + 2e- NO2- + H2O + 0,840
Hg2+ + 2e- Hg + 0,854
Cu2++ I- + e- CuI + 0,860
AuBr4- + 3e- Au + 4Br- + 0,870
NO3- + 1OH+ + 8e- NH4+ + 3H2O + 0,880
HO2- + H2O + 2e- 3OH- + 0,880
ClO- + H2O + 2e- Cl- + 2OH- + 0,890
NO2- + 8H+ + 6e- NH4+ + 2H2O + 0,890
2Hg2+ + 2e- Hg22+ + 0,920
NO3- + 3H3O+ + 2e- HNO2 + 4H2O + 0,940
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
Media-reacción E°(v) 106
NO3- + -
+ 4H3O + 3e NO + 6H2O + 0,960
AuCl4-(ac)+ 3e- Au + 4Cl-(ac) + 1,000
HNO2 + H3O+ + e- NO + 2H2O + 1,000
Fe(OH)3(s) + 3H+ + e- Fe2+ + 3H2O + 1,060
Br2(l) + 2e- 2Br- + 1,0652
NO2 + H3O+ + e- HNO2 + 2H2O + 1,070
Br2(aq) + 2e- 2Br- + 1,090
ClO4- + 2H3O+ + 2e- ClO3- + 3H2O + 1,190
IO3- + 6H3O+ + 5e- O,5 I2 + 9H2O + 1,195
ClO3- + 3H3O+ + 2e- 4H2O + HClO2 + 1,210
O2 + 4H3O+ + 4e- 6H2O (1 M H3O+) + 1,229
O2 + 4H+ + 4e- 2H2O + 1,229
MnO2 + 4H3O+ + 2e- 6H2O + Mn2+ + 1,230
MnO2 + 4H+ + 2e- Mn2+ + 2H2O + 1,230
2NO3- + 12H+ + 10e- N2(g) + 6H2O + 1,240
Cr2O72-+ 14H3O+ + 6e- 2Cr3+ + 21H2O + 1,330
Cr2O72-+ 14H+ + 6e- 2Cr3+ + 7H2O + 1,330
Cl2(g)+ 2e- 2Cl- + 1,36
Cl2(ac)+ 2e- 2Cl- + 1,39
HIO + H3O+ + e- O,5I2 + 2H2O + 1,450
PbO2 + 4H3O+ + 2e- Pb2+ + 6H2O + 1,455
2ClO3- + 12H3O+ + 1Oe- Cl2 + 18H2O + 1,470
Au3+ + 3e- Au + 1,500
Mn3+ + e- Mn2+ + 1,510
MnO4- + 8H3O+ + 5e- Mn2+ + 12H2O + 1,510
MnO4- + 8H+ + 5e- Mn2+ + 4H2O + 1,510
Ti2+ + 2e- Ti + 1,628
HClO + H3O+ + e- O,5 Cl2 + 2H2O + 1,630
Au+ + e- Au + 1,680
NiO2 + 4H3O+ + 2e- Ni2+ + 6H2O + 1,680
PbO2 + SO42- + 4H3O+ + 2e- PbSO4 + 6H2O + 1,685
PbO2(s) + SO42- + 4H+ + 2e- PbSO4(s) + 2H2O + 1,680
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
Media-reacción E°(v) 107
MnO4- + -
+ 4H3O + 3e MnO2 + 6H2O + 1,695
H2O2 + 2H3O+ + 2e- 4H2O + 1,770
Co3+ + e- Co2+ + 1,820
Ag2+ + e- Ag+ + 1,980
S2O82- + 2e- 2SO42- + 2,010
O3 + 2H3O+ + 2e- O2 + 3H2O + 2,070
*F2 + 2e- 2F- + 2,870
F2 + 2H3O+ + 2e- 2 HF(aq) + 2H2O + 3,060
________________________________________________________________
POTENCIALES DE DESCOMPOSICION (P.D.)
Reacción del electrodo Concentración P.D.(V)
del electrolito
Ag+ + e- Ag 0,1 N AgNO3 0,84
Cu2+ + 2e- Cu 1,0 N CuSO4 1,49
Zn2+ + 2e- Zn 1,0 N ZnSO4 2,35
Zn2+ + 2e- Zn 0,5 N ZnCl2 2,28
Ni2+ + 2e- Ni 1,0 N NiSO4 2,09
Ni2+ + 2e- Ni 1,0 N NiCl2 1,85
Co2+ + 2e- Co 1,0 N CoCl2 1,78
Cd2+ + 2e- Cd 1,0 N CdSO4 1,98
Pb2+ + 2e- Pb 0,1 N Pb(NO3)2 1,52
2H3O+ + 2e- H2 + 2H2O 1,0 N H2SO4 1,67
2H3O+ + 2e- H2 + 2H2O 1,0 N H3PO4 1,70
2H3O+ + 2e- H2 + 2H2O 0,2 N HCl 1,40
2H3O+ + 2e- H2 + 2H2O 1,0 N HClO4 1,67
2H3O+ + 2e- H2 + 2OH- 1,0 N NaOH 1,69
2H3O+ + 2e- H2 + 2OH- 1,0 N KOH 1,69
============================================================================
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
108
REACCIONES METALURGICAS
OXIDOS:
Muchos óxidos se descomponen (Ag2O, HgO), pierden oxígeno, produciendo el metal respectivo;
otros pierden parte de su oxígeno (MnO2 a MnO) y en otros óxidos el calor provoca una mayor
oxidación (Cu2O a CuO).
A. Los óxidos en los procesos metalúrgicos pueden formarse:
1. Por calentamiento del metal sólido o compuesto metálico sólido en contacto con el aire (tostación:
sólido- gas): Fe + O2 Fe3O4 ; ZnS + O2 ZnO + SO2
2. Por inyección de aire o vapor a través de un metal fundido (refinación térmica) o a través de sulfuros
fundidos (conversión, reacciones líquido-gas):
Zn + H2O ZnO + H2 ; FeS + O2 FeO + SO2
3. Por calentamiento de carbonatos y sulfatos metálicos (calcinación, reacción de descomposición):
CaCO3 CaO + CO2 ; ZnSO4 ZnO + SO31
4. Tratando el metal fundido con sustancias oxidantes (refinación térmica, reacción líquido-gas):
Sb + PbO Sb2O5 + Pb ; As + NaNO3 As2O3 + Na2O + NO
B. Los óxidos metálicos en los procesos metalúrgicos son descompuestos:
1. Por acción de los gases reductores sobre los óxidos al estado sólido (fundición reductora, reacción
sólido-gas): FeO + CO Fe + CO2
2. Por reacción entre óxidos y sulfuros líquidos (conversión: oxidación-reducción, y otros, reacción
líquido-líquido): Cu2O + Cu2S Cu + SO2
3. Por el tratamiento de los óxidos con soluciones acuosas (lixiviación: reacciones de disolución):
CuO + H2SO4 CuSO4 + H2O
4. Por reacciones de doble descomposición (fundición y conversión, reacciones: líquido-líquido):
FeS + Cu2O Cu2S + FeO
5. Por electrólisis de los óxidos disueltos en sales fundidas: Al2O3 Al + O2
Informarse sobre los procesos Hall-Heroult; Pidgeon.
SULFUROS:
La mayoría de los sulfuros tienen bajo punto de fusión y cuando son calentados por debajo de
dichos puntos en presencia de aire, se descomponen para dar lugar al óxido metálico. En algunos
procesos se producen mezclas artificiales fundidas de sulfuros que reciben el nombre de MATAS;
así las matas de Cu, son mezclas de sulfuros de Cu y Fe; las de Pb constituidas por sulfuros de Pb,
Cu y Fe; las matas de Ni, por sulfuros de Ni, Cu y Fe, etc. La mayoría de los sulfuros al estado
líquido son solubles entre sí en todas las proporciones.
Se forman:
1.- Por adición de azufre elemental a un metal líquido (refinación térmica): Cu + S Cu2S
2.- Por doble descomposición cuando están fundidos (conversión y otros):
Cu2O + FeS Cu2S + FeO
Ing. Qco. MSc. Luis Antonio Pacheco Acero
UNCP – INGENIERÍA METALÚRGICA Y DE MATERIALES - 2020
109
3.-Por calentamiento de los sulfatos metálicos en presencia de sustancias reductoras (fundición):
PbSO4 + C CO + PbS
Se descomponen por:
a) Por calentamiento de los sulfuros sólidos en corriente de aire (tostación):
ZnS + O2 ZnO + SO2
b) Por inyección de aire a través de sulfuros fundidos (conversión):
FeS + O2 FeO + SO2
c) Por tratamiento con soluciones acuosas (lixiviación):
Cu2S + FeCl3 CuCl2 + FeCl2 + S
4.- Por calentamiento del sulfuro con un metal u otro elemento que tenga afinidad por el S:
PbS + Fe FeS + Pb
Ing. Qco. MSc. Luis Antonio Pacheco Acero
También podría gustarte
- Potenciales Estándar de Reducción A 298Documento18 páginasPotenciales Estándar de Reducción A 298Citlalic De La Rosa C100% (2)
- Manual CompresorDocumento200 páginasManual CompresorDiego OrtegaAún no hay calificaciones
- Protocolo de Alcohol y DrogasDocumento6 páginasProtocolo de Alcohol y DrogasRenzo VegaAún no hay calificaciones
- Protocolo de Alcohol y DrogasDocumento6 páginasProtocolo de Alcohol y DrogasRenzo VegaAún no hay calificaciones
- Selección de LubricantesDocumento5 páginasSelección de LubricantesJose Luis Ramos75% (4)
- Tabla Potencial Estandar ReduccionDocumento13 páginasTabla Potencial Estandar ReduccionnataliasusanarojasbazaesAún no hay calificaciones
- Comercializacion de ConcentradosDocumento52 páginasComercializacion de ConcentradosRenzo Vega100% (2)
- Comercializacion de ConcentradosDocumento52 páginasComercializacion de ConcentradosRenzo Vega100% (2)
- Manifiesto de PasajerosDocumento2 páginasManifiesto de PasajerosRenzo Vega100% (3)
- Manifiesto de PasajerosDocumento2 páginasManifiesto de PasajerosRenzo Vega100% (3)
- Diana Albañileria ConfinadaDocumento140 páginasDiana Albañileria ConfinadaJunior Campos Alvarez100% (1)
- Tabla RedoxDocumento1 páginaTabla RedoxSusana Gonzalez100% (1)
- Valorización de Concentrado de Plomo 2021Documento1 páginaValorización de Concentrado de Plomo 2021Renzo Vega100% (1)
- Potenciales Estándar de Reduccion A 25 ºcDocumento2 páginasPotenciales Estándar de Reduccion A 25 ºcSoniia MendozaAún no hay calificaciones
- Valorización de Concentrado de Zinc 2021Documento1 páginaValorización de Concentrado de Zinc 2021Renzo VegaAún no hay calificaciones
- Valorización de Concentrado de Zinc 2021Documento1 páginaValorización de Concentrado de Zinc 2021Renzo VegaAún no hay calificaciones
- Clase 6 Pirometalurgia 2020Documento20 páginasClase 6 Pirometalurgia 2020yairAún no hay calificaciones
- Redox ResueltosDocumento6 páginasRedox ResueltosCejb Circulo de Estudios100% (1)
- Problemas de Pirometalurgia IIDocumento8 páginasProblemas de Pirometalurgia IITacachiri Chocamani Jaime0% (1)
- Tabla Potenciales de Reducción-1Documento1 páginaTabla Potenciales de Reducción-1a aAún no hay calificaciones
- Ficha Tecnica Temple Fino SinolitDocumento2 páginasFicha Tecnica Temple Fino SinolitMary SanAún no hay calificaciones
- Sesion #15 - Prueba de HipotesisDocumento33 páginasSesion #15 - Prueba de Hipotesishector quispeAún no hay calificaciones
- Ácidos OxácidosDocumento8 páginasÁcidos Oxácidoshelvert abrilAún no hay calificaciones
- Tabla Entalpia, Entropia, Energia LibreDocumento6 páginasTabla Entalpia, Entropia, Energia LibreWilliam Lyon100% (1)
- Tabla de Potenciales ElectricosDocumento2 páginasTabla de Potenciales ElectricosV-Shadow Kuro Shiro100% (1)
- Cuadro1 14G0Documento7 páginasCuadro1 14G0ahsimAún no hay calificaciones
- Tabla de PotencialesDocumento2 páginasTabla de PotencialesNAHELY CabreraAún no hay calificaciones
- Tabla de Potenciales de Reducción Estándar A 25Documento1 páginaTabla de Potenciales de Reducción Estándar A 25Richard MamaniAún no hay calificaciones
- METALURGIA EXTRACTIVA 2. E Piro-TostaciónDocumento21 páginasMETALURGIA EXTRACTIVA 2. E Piro-TostaciónAnonymous f5Iw04XbB7Aún no hay calificaciones
- Energías Libres de FormaciónDocumento2 páginasEnergías Libres de FormaciónDavid Reiser Mamani CarpioAún no hay calificaciones
- Tabla de Potenciales de ReduccionDocumento6 páginasTabla de Potenciales de ReduccionGonzalo Escuti ToroAún no hay calificaciones
- Clase 7-2022-2Documento24 páginasClase 7-2022-2Iyubopy HayKaAún no hay calificaciones
- FEM EstandarDocumento6 páginasFEM Estandara01741618Aún no hay calificaciones
- Tabla de Potenciales de Reducción EstándarDocumento1 páginaTabla de Potenciales de Reducción EstándarManuel Andonayre RamirezAún no hay calificaciones
- Tabla de Potenciales de ReduccionDocumento2 páginasTabla de Potenciales de ReduccionJohan Lozano GarciaAún no hay calificaciones
- Chemical EquationsDocumento7 páginasChemical EquationseshaamjedAún no hay calificaciones
- Dados TermodinâmicosDocumento1 páginaDados TermodinâmicosGustavo VieceliAún no hay calificaciones
- Tabla de Calores de ReacciónDocumento6 páginasTabla de Calores de Reacciónwilder16061997Aún no hay calificaciones
- HIERRODocumento3 páginasHIERROMar GonzalezAún no hay calificaciones
- Tabla de Potenciales EstándarDocumento2 páginasTabla de Potenciales EstándarArwen LightwoodAún no hay calificaciones
- Termo Trabajo N 9 Despues de Clases.Documento17 páginasTermo Trabajo N 9 Despues de Clases.Elizabeth MolloAún no hay calificaciones
- Termoquimica TablasDocumento3 páginasTermoquimica TablasKarla Maria Zaraos VazquezAún no hay calificaciones
- Listado de Ejercicios Estabilidad y EquilibriosDocumento4 páginasListado de Ejercicios Estabilidad y Equilibriosastres0% (1)
- Tarea01 CQG02 Jose Angel Estrada ArroyoDocumento14 páginasTarea01 CQG02 Jose Angel Estrada ArroyoJose Angel Estrada ArroyoAún no hay calificaciones
- CompuestoDocumento6 páginasCompuestoGonzalez ScAún no hay calificaciones
- 3ra PC de Piro 2021-1Documento6 páginas3ra PC de Piro 2021-1Benjamín Vitón TapiaAún no hay calificaciones
- Diagrama de KelloggDocumento11 páginasDiagrama de KelloggalexAún no hay calificaciones
- Química EjerciciosDocumento6 páginasQuímica Ejerciciosjoel mosquera100% (1)
- Diagrama de Kellog Cu-S-ODocumento7 páginasDiagrama de Kellog Cu-S-OYerson Torres CardenasAún no hay calificaciones
- Diagrama de ELLINGHAMDocumento4 páginasDiagrama de ELLINGHAMIsidora Martin TriviñoAún no hay calificaciones
- Potencial de ReduccionDocumento18 páginasPotencial de ReduccionJose V. Chunga MunaycoAún no hay calificaciones
- Constantes Reacciones Disolucion Acuosa PDFDocumento3 páginasConstantes Reacciones Disolucion Acuosa PDFeutectic1992Aún no hay calificaciones
- 1PC ME327 2020 I 6btosDocumento234 páginas1PC ME327 2020 I 6btosFRANCIS DAVID CABREJOS RAMOSAún no hay calificaciones
- Examen Extraordinario Recuperación 2022Documento6 páginasExamen Extraordinario Recuperación 2022iris silvaAún no hay calificaciones
- Diagrama Cr-S-O: A) Escriba Las Reacciones Representadas en El Grafico Adjunto para Definir La Zona de Estabilidad Del CR ODocumento10 páginasDiagrama Cr-S-O: A) Escriba Las Reacciones Representadas en El Grafico Adjunto para Definir La Zona de Estabilidad Del CR OBrayan BarriosAún no hay calificaciones
- Diagrama de Kellog UltimoDocumento11 páginasDiagrama de Kellog UltimoYelitsa RoViAún no hay calificaciones
- Tabla de Potenciales de ReduccionDocumento9 páginasTabla de Potenciales de ReduccionguidoAún no hay calificaciones
- Potencial Estandar de ReduccionDocumento9 páginasPotencial Estandar de ReduccionHugo GimenzAún no hay calificaciones
- Oxido ReducciónDocumento10 páginasOxido ReducciónmonicaAún no hay calificaciones
- Temperatura Llama Adiabatica PentanoDocumento2 páginasTemperatura Llama Adiabatica PentanoHermann TamayoAún no hay calificaciones
- Deber Ecuaciones QuimicasDocumento32 páginasDeber Ecuaciones QuimicasPaolo Ramírez Cáceres WinRxAún no hay calificaciones
- Tabla de Potenciales EstándarDocumento2 páginasTabla de Potenciales EstándarEkaitz Duke FernandezAún no hay calificaciones
- Reaccion SO3Documento12 páginasReaccion SO3Gerardo F. MartinezAún no hay calificaciones
- Ejercicios Resueltos de Análisis ElectroanalíticoDocumento4 páginasEjercicios Resueltos de Análisis ElectroanalíticoPedro Luis Vargas AguilarAún no hay calificaciones
- Diagrama de Estabilidad Fe-S-ODocumento1 páginaDiagrama de Estabilidad Fe-S-OChpAún no hay calificaciones
- CP SelulosaDocumento83 páginasCP SelulosaMilian Asha Bio MuradAún no hay calificaciones
- Química - Tabela1 - Oxi-ReduçãoDocumento1 páginaQuímica - Tabela1 - Oxi-ReduçãoQuímica_Moderna100% (3)
- Tranque de RelaveDocumento7 páginasTranque de RelaveAgustín Labra FidanzaAún no hay calificaciones
- Sintesis Del AmoniacoDocumento6 páginasSintesis Del AmoniacoLuz Elena Maldonado CastilloAún no hay calificaciones
- Formulación 3ºesoDocumento2 páginasFormulación 3ºesoAna Cayado peñaAún no hay calificaciones
- Tabla de OxidaciónDocumento5 páginasTabla de OxidaciónMario Antonio Anaya RaymundoAún no hay calificaciones
- Anexo Tabla de Potenciales de ReducciónDocumento6 páginasAnexo Tabla de Potenciales de ReducciónAndrea ArteagaAún no hay calificaciones
- Etkt 1647392459735Documento3 páginasEtkt 1647392459735Renzo VegaAún no hay calificaciones
- Matriz de Aspectos e ImpactosDocumento1 páginaMatriz de Aspectos e ImpactosRenzo VegaAún no hay calificaciones
- Renovación Del PIDDocumento3 páginasRenovación Del PIDRenzo VegaAún no hay calificaciones
- Practicas Entrada 2022-I TALLER DE TESIS Vega GonzalesDocumento3 páginasPracticas Entrada 2022-I TALLER DE TESIS Vega GonzalesRenzo VegaAún no hay calificaciones
- Diseño DigitalDocumento8 páginasDiseño DigitalRenzo VegaAún no hay calificaciones
- Plan de TesisDocumento75 páginasPlan de TesisRenzo VegaAún no hay calificaciones
- Matriz de Consistencia ..Documento2 páginasMatriz de Consistencia ..Renzo VegaAún no hay calificaciones
- Plan Anual de SeguridadDocumento21 páginasPlan Anual de SeguridadRenzo VegaAún no hay calificaciones
- Plan de TesisDocumento75 páginasPlan de TesisRenzo VegaAún no hay calificaciones
- Vega Gonzales Renzo Anthony-Certificado Comercializacion de ConcentradosDocumento1 páginaVega Gonzales Renzo Anthony-Certificado Comercializacion de ConcentradosRenzo VegaAún no hay calificaciones
- Valorización de Concentrado de Plomo 2021Documento1 páginaValorización de Concentrado de Plomo 2021Renzo VegaAún no hay calificaciones
- Valorización de Concentrado de Cobre Con Alto Contenido de OroDocumento4 páginasValorización de Concentrado de Cobre Con Alto Contenido de OroRenzo VegaAún no hay calificaciones
- Constancia de Trabajo SandvikDocumento2 páginasConstancia de Trabajo SandvikRenzo VegaAún no hay calificaciones
- Valorización de Concentrado de Cobre Con Alto Contenido de OroDocumento4 páginasValorización de Concentrado de Cobre Con Alto Contenido de OroRenzo VegaAún no hay calificaciones
- Prueba Antigena Volcan-ModeloDocumento1 páginaPrueba Antigena Volcan-ModeloRenzo VegaAún no hay calificaciones
- Articulo MineroDocumento1 páginaArticulo MineroRenzo VegaAún no hay calificaciones
- Plan Anual de SeguridadDocumento21 páginasPlan Anual de SeguridadRenzo VegaAún no hay calificaciones
- Constancia de Trabajo SandvikDocumento2 páginasConstancia de Trabajo SandvikRenzo VegaAún no hay calificaciones
- Prueba Antigena Volcan-ModeloDocumento1 páginaPrueba Antigena Volcan-ModeloRenzo VegaAún no hay calificaciones
- Articulo MineroDocumento1 páginaArticulo MineroRenzo VegaAún no hay calificaciones
- Habilitacion Quimica Decimo 2022Documento5 páginasHabilitacion Quimica Decimo 2022Valentina CastroAún no hay calificaciones
- Memoria de Calculo - Portico Con Carrete para Izaje de Tuberia de 48Documento8 páginasMemoria de Calculo - Portico Con Carrete para Izaje de Tuberia de 48Erick SxsxAún no hay calificaciones
- Ya Estudiados Los Temas Completos Correspondiente Al Programa de Higiene y Manipulación de AlimentosDocumento3 páginasYa Estudiados Los Temas Completos Correspondiente Al Programa de Higiene y Manipulación de AlimentosShirley price ortizAún no hay calificaciones
- Presupuesto AnaliticoDocumento3 páginasPresupuesto AnaliticoKarla NapaicoAún no hay calificaciones
- Informe 2 MC327CDocumento8 páginasInforme 2 MC327CDanny Axel Ruiz SalsavilcaAún no hay calificaciones
- Fundamentos Del Formado de MetalesDocumento24 páginasFundamentos Del Formado de MetalesKathy Milieth Guzman BritoAún no hay calificaciones
- Pavi MentosDocumento9 páginasPavi MentosBrayan SanchezAún no hay calificaciones
- Nte Inen 3082 Nte Inen 3082: Norma Norma Técnica Técnica Ecuatoriana EcuatorianaDocumento30 páginasNte Inen 3082 Nte Inen 3082: Norma Norma Técnica Técnica Ecuatoriana EcuatorianaDiego AlvarezAún no hay calificaciones
- Análisis de Costos Unitarios - MDHDocumento100 páginasAnálisis de Costos Unitarios - MDHSergioAún no hay calificaciones
- Acabados SuperficialesDocumento10 páginasAcabados SuperficialesJUAN REYESAún no hay calificaciones
- Filtracion Con CoadyuvantesDocumento3 páginasFiltracion Con CoadyuvantessamanthatabaniAún no hay calificaciones
- Acido Clorhidrico - MonografiaDocumento10 páginasAcido Clorhidrico - MonografiaLizz CMAún no hay calificaciones
- MSDS Acido FosforicoDocumento5 páginasMSDS Acido FosforicoJUAN ALBERTO BERROCAL VALDIVIAAún no hay calificaciones
- Intermediarios de ReacciónDocumento5 páginasIntermediarios de ReacciónSponja75Aún no hay calificaciones
- Presupuesto Original San Pedro de CurahuaraDocumento24 páginasPresupuesto Original San Pedro de CurahuaraFelix Omar Orias SalasAún no hay calificaciones
- Desplazamientos de NudosDocumento30 páginasDesplazamientos de NudosAngelo Marcelo EspinozaAún no hay calificaciones
- 4ta Sem Julio Ejm PDFDocumento4 páginas4ta Sem Julio Ejm PDFLudita VentoAún no hay calificaciones
- TFM Condrea Rineanu, Gina-BiodegradabilidadDocumento93 páginasTFM Condrea Rineanu, Gina-Biodegradabilidadomar velasquezAún no hay calificaciones
- Estructura Losa AligeradaDocumento1 páginaEstructura Losa AligeradaDina R. VelasquezAún no hay calificaciones
- Taller 1 de BioquímicaDocumento3 páginasTaller 1 de BioquímicaValeria Aragon CerqueraAún no hay calificaciones
- Alanis Colunga - Tarea 3 - U1 - Preparacion de Aire ComprimidoDocumento3 páginasAlanis Colunga - Tarea 3 - U1 - Preparacion de Aire ComprimidoDaniel ColungaAún no hay calificaciones
- SOLDADURADocumento16 páginasSOLDADURAomar chuquillanquiAún no hay calificaciones
- VIGAS DE CONCRETO ARMADO MatiasDocumento26 páginasVIGAS DE CONCRETO ARMADO MatiasMadyOrtizAún no hay calificaciones
- Acidet SpinDocumento4 páginasAcidet SpinAlexa Tamara Gomez UgarteAún no hay calificaciones
- Informe de Laboratorio DilatacionDocumento9 páginasInforme de Laboratorio DilatacionAndres Felipe Bocarejo MejiaAún no hay calificaciones