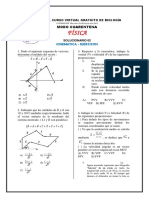
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reacciones
Reacciones
Cargado por
Sarai ArguelloDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Reacciones
Reacciones
Cargado por
Sarai ArguelloCopyright:
Formatos disponibles
Introducción a la cinética: La cinética es el estudio de las velocidades de las
reacciones y los mecanismos por medio de los cuales ocurren, su objetivo es
estudiar la medida e interpretación de las velocidades de reacción, esto incluye
los factores que afectan estas velocidades y el análisis de los mecanismos por
los cuales se producen las reacciones químicas.
Términos básicos:
Reacción Homogénea: es aquella que se produce en una sola fase.
Reacción Heterogénea: es aquella que necesita la presencia de al
menos dos fases para llevarse a cabo.
Velocidad: es el cambio de número de moles de un reactante o de un
producto por unidad de tiempo y volumen, viene representada por
1 d ni
rt = . La velocidad es intrínsecamente positiva, por lo cual se utiliza
V dt
signo positivo para los productos y negativo para los reactantes.
Avance de la reacción (ξ ): es una propiedad extensiva que representa el
progreso de la reacción en medida de moles y varía con el tiempo:
ni −nio
ξ=
Vi
Cada reacción tiene un ξ propio, y este se puede definir de varias
maneras:
−nio
o Cuando se aplica reactivo limitante a la reacción: ξ max =
Vi
ξ
o Cuando el volumen de la reacción es constante: ξ v =
V
o Para una reacción en fase gaseosa a volumen constante:
Pi P io
= +ξ V
RT RT V i
o Para cualquier reactivo o reactante de una reacción: C i=Cio ± γ ξ V
Conversión: es la fracción del reactante que reacciona, se define como
ξ ξ n −n n
x=
ξ max
=(−V i)
( )
nio
= io i =1− i
nio n io
Eficacia: se utiliza cuando el transcurso de la reacción está limitado por
la existencia de un equilibrio químico, donde no se puede alcanzar ξ max
ξ
sino ξ eq. La eficiencia está dada por η=
ξeq
Formas de expresar la velocidad de reacción: en el caso de
reacciones heterogéneas, se aplica la definición de ξ̇
Para el caso de reacciones catalíticas heterogéneas, se puede utilizar el área
activa o total de la superficie del catalizador, la masa o el volumen del mismo,
sin embargo en el caso de usar la velocidad por unidad de área (que se
presenta como la mejor alternativa) es mejor utilizar la definición de velocidad
de reacción en términos de sitios activos.
Número de reacción (turnover number): Número de veces que se da la
dn
reacción en un ciclo catalítico, dado por r =
dt
Frecuencia de reacción (turnover frequency): Número de reacción por
sitio catalítico y unidad de tiempo para una reacción a T, P relación de
1 dn
reactantes y avance de reacción determinados: r t =
S dt
Cuantificar rt presenta ciertas dificultades, por lo cual es probable que este
valor sea un promedio de la actividad catalítica y un límite menor de la actividad
verdadera. Además, rt es una velocidad de reacción por lo tanto es necesario
especificar todas las condiciones de reacción.
Principio de Reversibilidad Microscópica: “En un sistema en equilibrio,
cualquier proceso molecular y el inverso ocurren en promedio a la misa
velocidad”. Así pues, afecta a las reacciones químicas de manera que si en un
sistema hay un flujo de reactantes en una dirección, habrá flujo en dirección
opuesta. Esto es conocido como el principio de balance detallado de las
reacciones químicas, se aplica A K 1 B K 2 C K 3 A
↔ ↔ ↔
Cinética de reacciones homogéneas: se tienen 5 reglas sobre la función
cinética, de naturaleza aproximada pero lo suficientemente generales:
1. A temperatura constante la función cinética r disminuye generalmente
de forma monotónica o con el avance de la reacción/tiempo
2. La velocidad de una reacción reversible se puede escribir como
r =kF (Ci )
3. Generalmente la constante de velocidad varía con la temperatura
−E
siguiendo la ec. de Arrhenius k = A e RT
4. Frecuentemente, la función F(C i) es independiente de la temperatura y
α
se puede aproximar a F ( C i )=∏ C i
i
5. Cuando una reacción es reversible, la velocidad de reacción puede ser
expresada como r =r d −r i o r =k d F d (C ¿¿ i)−k i F i (C¿ ¿i)¿ ¿
Factor dependiente de la concentración en la ecuación cinética:
Reacciones simples: una sola ecuación estequiométrica
Reacciones múltiples: varias ecuaciones estequiométricas, pueden ser
competitivas, simultaneas o sistemas más complejos
Reacciones elementales: cuando para A+ B → R la velocidad para A por
ejemplo, corresponde a −r a =k C A C B
Reacciones múltiples: cuando la ecuación cinética se vuelve mas
compleja ya que la reacción es en realidad, una serie de reacciones
cuyos productos intermedios son despreciables
Para A+ B ⇌ R+ S la velocidad de formación directa de R es
r R .d =kC A C B Y r R .i=kC R C S
Molecularidad y Orden de Reacción: El número de especies químicas
involucradas en una sola reacción se conoce como Molecularidad de una
reacción, para la cual el número de Molecularidad indica el orden de reacción
pero de manera inversa.
Unimolecular A →∏ ¿ V =k [ A ]
Bimolecular A+ B → ∏ ; 2 A → ∏ ¿ V =k [ A ][ B ] ; V =k [ A ]
2
2
Trimolecular A+ B+C → ∏ ; 2 A+ B → ∏ ¿ V =k [ A ][ B ][ C ] ; V =k [ A ] [ B ]
Coeficiente Cinético: Es el término de proporcionalidad que multiplica a las
concentraciones en las ecuaciones de velocidad (k, s -1·mol1-n·Ln-1) se le llama
constante cuando la reacción es elemental y coeficiente cuando no lo es.
Factor dependiente de la temperatura en la ecuación cinética: Para la
inmensa mayoría de las reacciones se ha encontrado que el factor dependiente
−E
de la temperatura se ajusta a la ecuación de Arrhenius: k =K e RT
o
K1
Dependencia de la temperatura según la termodinámica: Para A R Δ H r →
←
K2
utilizando la ecuación de Van Hoff d ¿ ¿ se pueden obtener dos
ecuaciones para la velocidad directa e inversad ¿ ¿ y d ¿ ¿
Dependencia de la temperatura a partir del estado de transición: La teoría
del estado de transición establece que los reactantes se convierten en
productos intermedios inestables llamados complejos activados. La
velocidad de formación de estos complejos viene dada por:
kT kT
r AB , directa= Concentracion del Velocidad de descomposicion = [ AB¿ ] =
( )(
Complejo activo del complejo activado ) h
k C C
h ċ A B
Donde k representa la constante de Boltzmann y h = 6,63 x IO -27 erg-seg, la
constante de Planck.
Se puede observar que la ecuación de Arrhenius representa una buena
aproximación en cuanto a la dependencia del coeficiente cinético a la
temperatura, ya que se puede establecer una relación entre esta ecuación y la
ecuación de Van Hoff y la teoría de estado de transición.
También podría gustarte
- Experimentos ConductualesDocumento7 páginasExperimentos ConductualesSarai ArguelloAún no hay calificaciones
- Planeacion Didactica Argumentada INFDocumento5 páginasPlaneacion Didactica Argumentada INFCarmen García Hernández0% (1)
- Intención Paradójica.Documento8 páginasIntención Paradójica.Sarai ArguelloAún no hay calificaciones
- Analisis Modelos TerapeuticosDocumento3 páginasAnalisis Modelos TerapeuticosSarai ArguelloAún no hay calificaciones
- Esquemas Interpersonales de Safran y SesgalDocumento6 páginasEsquemas Interpersonales de Safran y SesgalSarai ArguelloAún no hay calificaciones
- Desensibilizacion SistemáticaDocumento12 páginasDesensibilizacion SistemáticaSarai ArguelloAún no hay calificaciones
- Examen MentalDocumento6 páginasExamen MentalSarai ArguelloAún no hay calificaciones
- Guía de Práctica de Anormal 1Documento4 páginasGuía de Práctica de Anormal 1Sarai ArguelloAún no hay calificaciones
- Anormal 1 (Teoría)Documento12 páginasAnormal 1 (Teoría)Sarai ArguelloAún no hay calificaciones
- Ensayo Critico Sarai Arguello. (Revisado)Documento9 páginasEnsayo Critico Sarai Arguello. (Revisado)Sarai ArguelloAún no hay calificaciones
- Anormal Unidad 2 Parte 2Documento7 páginasAnormal Unidad 2 Parte 2Sarai ArguelloAún no hay calificaciones
- 1 Desarrollo Humano IIIDocumento2 páginas1 Desarrollo Humano IIISarai ArguelloAún no hay calificaciones
- Islas de BasuraDocumento5 páginasIslas de BasuraSarai ArguelloAún no hay calificaciones
- PIROMETALURGIADocumento26 páginasPIROMETALURGIASarai Arguello100% (1)
- Endulzamiento Con AminasDocumento13 páginasEndulzamiento Con AminasSarai ArguelloAún no hay calificaciones
- Resumen de Sistemas PsicologicosDocumento19 páginasResumen de Sistemas PsicologicosSarai ArguelloAún no hay calificaciones
- Final Proceso OstwaldDocumento12 páginasFinal Proceso OstwaldSarai ArguelloAún no hay calificaciones
- Sesión de Aprendizaje de MatemáticaDocumento9 páginasSesión de Aprendizaje de MatemáticaMandy López Morales100% (1)
- Cinemática - CotamaniaDocumento3 páginasCinemática - CotamaniaCarlos LopezAún no hay calificaciones
- Manual de Aplicación RUBRICAS 2018Documento40 páginasManual de Aplicación RUBRICAS 2018anon_119333692100% (20)
- Guias Analisis Materia Prima PDFDocumento79 páginasGuias Analisis Materia Prima PDFAnderson Torres0% (1)
- Carpeta PedagogicaDocumento29 páginasCarpeta PedagogicaangieAún no hay calificaciones
- EJE Pedagogiay Formacion SociocriticaDocumento8 páginasEJE Pedagogiay Formacion SociocriticaYariAún no hay calificaciones
- Universidad Nacional Del Callao FDocumento28 páginasUniversidad Nacional Del Callao FJuangjAún no hay calificaciones
- Panel FotograficoDocumento6 páginasPanel FotograficoLeo TiconaAún no hay calificaciones
- DINAMICA Ejercicios Centro Instantaneos PDFDocumento5 páginasDINAMICA Ejercicios Centro Instantaneos PDFKirk Arteaga100% (1)
- Curriculum VitaeDocumento6 páginasCurriculum VitaeHelenn Padilla ReaAún no hay calificaciones
- Television EducativaDocumento6 páginasTelevision EducativaJose Reynaldo Cabrera RebolloAún no hay calificaciones
- Movimiento Rectilineo Uniforme Acelerado 1.0Documento4 páginasMovimiento Rectilineo Uniforme Acelerado 1.0Santiago DuranAún no hay calificaciones
- Movimiento Mecanico 3Documento10 páginasMovimiento Mecanico 3Osmer PicotaAún no hay calificaciones
- Practica 6Documento10 páginasPractica 6BrayanAún no hay calificaciones
- 3.2cátedra Dra. Lucarelli Trabajo Final SMorales6Documento9 páginas3.2cátedra Dra. Lucarelli Trabajo Final SMorales6Seba PeñaAún no hay calificaciones
- Ensayo Todo Por La RecompensaDocumento5 páginasEnsayo Todo Por La RecompensaEdwin Amaral LopezAún no hay calificaciones
- Act. Matematica 3º U 18-07-2023Documento4 páginasAct. Matematica 3º U 18-07-2023Melady Jhoryett Gavidia ValverdeAún no hay calificaciones
- Matriz Destrezas Bachillerato Física 3Documento42 páginasMatriz Destrezas Bachillerato Física 3MaluMalucillaHPatAún no hay calificaciones
- Constanza Rocha Vidal - AntecedentesDocumento7 páginasConstanza Rocha Vidal - AntecedentesBasil T UretaAún no hay calificaciones
- Iniciación Deportiva. Un Enfoque Desde La PromociónDocumento12 páginasIniciación Deportiva. Un Enfoque Desde La Promociónnicolas cristianAún no hay calificaciones
- Química, Grado en Ingeniería de La Energía Tema 13: Cinética QuímicaDocumento13 páginasQuímica, Grado en Ingeniería de La Energía Tema 13: Cinética QuímicaJssusj ZjzuzbAún no hay calificaciones
- PC2 - Fundamentos de Dinámica - 2023 02Documento3 páginasPC2 - Fundamentos de Dinámica - 2023 02victor mauricio ferrer carhuasAún no hay calificaciones
- Cinematica y Dinamica (L+)Documento6 páginasCinematica y Dinamica (L+)Ricky RiconAún no hay calificaciones
- Organigrama 2018Documento3 páginasOrganigrama 2018Elena H ArroyoAún no hay calificaciones
- Coloquio de Practica DocenteDocumento18 páginasColoquio de Practica DocenteGustavo Sanchez100% (1)
- Aprendizaje Asistido Propuesto Por VygotskyDocumento6 páginasAprendizaje Asistido Propuesto Por VygotskyJANETH ALEXANDRA CORAL BOLAÑOSAún no hay calificaciones
- Matematicas 11111Documento10 páginasMatematicas 11111Stiven EscobarAún no hay calificaciones
- Giraldo Borrero MosqueraDocumento7 páginasGiraldo Borrero MosqueraJUAN DANIEL GIRALDO MUÑOZAún no hay calificaciones
- Silabo DinámicaDocumento11 páginasSilabo DinámicaLMVVAún no hay calificaciones