Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Para Ejercicios
Cargado por
Gonzalo GarciaDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Para Ejercicios
Cargado por
Gonzalo GarciaCopyright:
Formatos disponibles
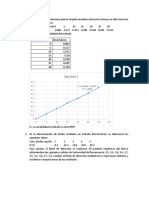
EJERCICIOS
1.- .-Se supone que una disolución de NaOH es aprox. 0,1 N. Para determinar su
verdadera molaridad se valora esta disolución de NaOH utilizando Ftalato ácido de
potasio, KHC8H4O4. Se disuelve una muestra de 0,5 gramos de Ftalato en agua y se
valora con 24,03 ml de la disolución de NaOH. ¿Cuál es la normalidad real del NaOH?
NaOH 24,03 ml N=?
0,5 g ftalato acido de potasio +fenolftaleína
FORMAS DE RESOLVER
204g + 40 = 226g + 18 g
0,5g x=
g
N= =¿
VC xmEQ
2.-.-Supongamos que valoramos 20,00 mL de ácido acético 0,1000 N con NaOH 0,1000 N.
Nuevamente pondremos el ácido débil, sustancia a valorar en el erlenmeyer y el agente
valorante en la bureta.
Reacción de valoración: NaAc + H2OHAc + NaOH Calculemos primero el volumen de base
necesario para alcanzar el punto equivalente. Como en el caso anterior el volumen en el punto
equivalente será:
EJERCICIOS
V=? NaOH O,1 N
20 ml CH3-COOH O,1N
60g + 40g =
82 + 18g
3.-Si 38,22 ml de una solución de HCl titularon exactamente 0,2808 g
del estándar primario carbonato de sodio puro, ¿cuál es la
normalidad de la solución y qué volumen de ella se necesitaría para
preparar un litro de solución exactamente 0,1000 N de HCl?
106g + 2(36,5) = 2(58,5) + 44g + 18g
106g + 73g = 117g + 44g + 18g
EJERCICIOS
HCL 32,ml N=?
0,2808 g Na2CO3 + ANARANJADO DE METILO
También podría gustarte
- Experiment oDocumento9 páginasExperiment ogiselxAún no hay calificaciones
- Problemas Propiedades ColigativasDocumento8 páginasProblemas Propiedades ColigativasLuis MartínezAún no hay calificaciones
- Informe 1Documento12 páginasInforme 1ZENAIDA ALEXANDRA CCAMA CCAHUANAAún no hay calificaciones
- Ejercicio 1y 2 de CurvasDocumento2 páginasEjercicio 1y 2 de CurvasNatasha VargasAún no hay calificaciones
- Laboratorio 7Documento3 páginasLaboratorio 7DEYSI LOPEZ TOLAAún no hay calificaciones
- Ensayo de ProteinasDocumento6 páginasEnsayo de ProteinasLucía YánezAún no hay calificaciones
- INFORME Quimica (Conductividad)Documento4 páginasINFORME Quimica (Conductividad)Kevin Gonzalez RicoAún no hay calificaciones
- CURVA TITULACION NH3 HCLDocumento2 páginasCURVA TITULACION NH3 HCLArmando MoraAún no hay calificaciones
- Aplicaciones Acido-BaseDocumento4 páginasAplicaciones Acido-BaseRosmeri DelgadoAún no hay calificaciones
- 05 - Solucion Formula Empirica y MolecularDocumento9 páginas05 - Solucion Formula Empirica y MolecularAngélica Durán Muñoz0% (1)
- Prac Quimica Orgii Nuevo 3Documento29 páginasPrac Quimica Orgii Nuevo 3blobAún no hay calificaciones
- Laboratorio N°13-Quimica AnaliticaDocumento7 páginasLaboratorio N°13-Quimica AnaliticaAndrea JimenezAún no hay calificaciones
- Ejer DisolucionesDocumento2 páginasEjer DisolucionesMario Angulo PérezAún no hay calificaciones
- Laboratorio FQ II Guevara Bernardo ArianeDocumento13 páginasLaboratorio FQ II Guevara Bernardo ArianeAndy AlegreAún no hay calificaciones
- Guía de Ejercicios Precipitación y RedoxDocumento2 páginasGuía de Ejercicios Precipitación y Redoxfernanda100% (1)
- 2014guia de Problemas Nº1 PDFDocumento3 páginas2014guia de Problemas Nº1 PDFDiego TorresAún no hay calificaciones
- Problemas PropuestosDocumento1 páginaProblemas PropuestosJohhn MendozAún no hay calificaciones
- Precipitación FraccionadaDocumento7 páginasPrecipitación FraccionadaHenry Jesus Saavedra Alvarez0% (1)
- 10 Practica Volumetria ComplejosDocumento9 páginas10 Practica Volumetria ComplejosMax Ñañez GutierrezAún no hay calificaciones
- Sesión 9. Producto de SolubilidadDocumento16 páginasSesión 9. Producto de SolubilidadAdrián Lume HuayllaniAún no hay calificaciones
- Termodinamica ENUNCIADOSDocumento4 páginasTermodinamica ENUNCIADOSMåiirå SDj K. ZYtAún no hay calificaciones
- Guia Quimica II 2023 PDFDocumento135 páginasGuia Quimica II 2023 PDFMc Gabo.16Aún no hay calificaciones
- Tarea 11 Grupo 3Documento5 páginasTarea 11 Grupo 3ERIKA LUCIA REYES MENDOZAAún no hay calificaciones
- Practica Nº2Documento10 páginasPractica Nº2PEREDA ZELADA DANIEL ARTUROAún no hay calificaciones
- Reporte Lab 1 Oper y Proc UnitariosDocumento7 páginasReporte Lab 1 Oper y Proc UnitariosGabriel Humberto Pe�a ChangAún no hay calificaciones
- Taller de FQ-Amb-GasesDocumento4 páginasTaller de FQ-Amb-GasesmaiAún no hay calificaciones
- Organica 2Documento11 páginasOrganica 2Diego Padilla SantosAún no hay calificaciones
- Tarea - Práctica de Ecuaciones Diferenciales Ordinarias y Aplicaciones.Documento3 páginasTarea - Práctica de Ecuaciones Diferenciales Ordinarias y Aplicaciones.INGRID LIZETH VERA ESCOBEDOAún no hay calificaciones
- CLASE4 EstadisticaDocumento33 páginasCLASE4 EstadisticaDiego VHAún no hay calificaciones
- Cap-8 Descusion InorganicaDocumento12 páginasCap-8 Descusion InorganicaOrlando Luna100% (1)
- Determinacion de Acidez en Vinagre ComercialesDocumento6 páginasDeterminacion de Acidez en Vinagre ComercialesCristhianMontaño100% (1)
- Ebulloscopia DiscusionesDocumento2 páginasEbulloscopia DiscusionesAdrianyz QuintanaAún no hay calificaciones
- Analitica 04 - DETERMINACION GRAVIMETRICA DE PLATA, COMO CLORURO DE PLATA, AgClDocumento11 páginasAnalitica 04 - DETERMINACION GRAVIMETRICA DE PLATA, COMO CLORURO DE PLATA, AgClJean Pierre Cirilo SosaAún no hay calificaciones
- Informe EdtaDocumento8 páginasInforme EdtaJorge RomeroAún no hay calificaciones
- Informe Analisis de CationesDocumento12 páginasInforme Analisis de CationesYersonChavezCochachinAún no hay calificaciones
- Tarea 3Documento12 páginasTarea 3Jennifer BenavidesAún no hay calificaciones
- Taller Procesos IndustrialesDocumento11 páginasTaller Procesos IndustrialesSebastian HerreraAún no hay calificaciones
- Análisis de Ácido Acético en Una Muestra de VinagreDocumento4 páginasAnálisis de Ácido Acético en Una Muestra de VinagreCAROLINA HERRERA MARTÍNEZAún no hay calificaciones
- Lab 03 Espectroscopia de Absorción AtómicaDocumento12 páginasLab 03 Espectroscopia de Absorción AtómicaRONALDO JOSE ORIHUELA ORIHUELAAún no hay calificaciones
- Primera Lista de Ejercicios Antes Del ParcialDocumento12 páginasPrimera Lista de Ejercicios Antes Del ParcialDiego PeláezAún no hay calificaciones
- Termo 5Documento6 páginasTermo 5ChristianAún no hay calificaciones
- Análisis Químico - Clases EstudioDocumento35 páginasAnálisis Químico - Clases EstudioFernanda LexAún no hay calificaciones
- CAPITULO I (Almanza Obregon Sherlín Dayana)Documento18 páginasCAPITULO I (Almanza Obregon Sherlín Dayana)Sherlin Almanza ObregonAún no hay calificaciones
- Reporte 2-Daniel Chavez Micha - Grupo 6Documento3 páginasReporte 2-Daniel Chavez Micha - Grupo 6DANIEL CHAVEZ MICHAAún no hay calificaciones
- Determinación Ca2+ en MedicamentoDocumento2 páginasDeterminación Ca2+ en MedicamentoSantiago MoralesAún no hay calificaciones
- Estandarizacion de Soluciones PatrónDocumento10 páginasEstandarizacion de Soluciones Patrónmateo201211Aún no hay calificaciones
- Problemas Sobre Acido BaseDocumento2 páginasProblemas Sobre Acido BaseJack Santa CruzAún no hay calificaciones
- PROBLEMASDocumento3 páginasPROBLEMASsandra quispeAún no hay calificaciones
- Ejercicio de Balance de Masa y EnergiaDocumento6 páginasEjercicio de Balance de Masa y EnergiaalbertoAún no hay calificaciones
- Taller 1 Análisis PDFDocumento2 páginasTaller 1 Análisis PDFBayron Sandoval DíazAún no hay calificaciones
- Practica N1 de Tecno 3Documento10 páginasPractica N1 de Tecno 3Jayke MaybiAún no hay calificaciones
- Actividad 9Documento7 páginasActividad 9PATRICIA ROSARIO SANTANDER SALASAún no hay calificaciones
- Informe de Laboratorio 7 - Quimica 2Documento9 páginasInforme de Laboratorio 7 - Quimica 2dany diana mamani lipiriAún no hay calificaciones
- Solucin de Problema de Cromatografia SkoogDocumento2 páginasSolucin de Problema de Cromatografia SkoogAlex ExpenserAún no hay calificaciones
- QA 02 Complejos Problemas03 PDFDocumento10 páginasQA 02 Complejos Problemas03 PDFalexander beltranAún no hay calificaciones
- Bueno Vasquez Ilmer QDocumento25 páginasBueno Vasquez Ilmer QEULER ROSSEL CAMPOS SALDA�AAún no hay calificaciones
- Practica 4 (Qu-142)Documento14 páginasPractica 4 (Qu-142)Miguel Riveros CabreraAún no hay calificaciones
- PRACTICA N.6 ResultadosDocumento3 páginasPRACTICA N.6 ResultadosADELINA VALDIVIA BAZANAún no hay calificaciones
- Informe Ley de Hess Fisicoquimica IDocumento8 páginasInforme Ley de Hess Fisicoquimica IValentina LópezAún no hay calificaciones
- Preparacion y Valoracion de La Solucion PatronDocumento6 páginasPreparacion y Valoracion de La Solucion PatronMarco Antonio Vedia AmpueroAún no hay calificaciones
- Informe de Teletrabajo Semana 13 Al 17 de Diciembre Del 2021 Lic. Oswaldo GarciaDocumento2 páginasInforme de Teletrabajo Semana 13 Al 17 de Diciembre Del 2021 Lic. Oswaldo GarciaGonzalo GarciaAún no hay calificaciones
- PA 132 ProgramaAnalitico 1bromatoogiaDocumento2 páginasPA 132 ProgramaAnalitico 1bromatoogiaGonzalo GarciaAún no hay calificaciones
- Actividad 1 Función DirectaDocumento1 páginaActividad 1 Función DirectaGonzalo GarciaAún no hay calificaciones
- Silabo de BromatologiaDocumento6 páginasSilabo de BromatologiaGonzalo GarciaAún no hay calificaciones
- Cronograma de Ingreso A LaboratoriosDocumento1 páginaCronograma de Ingreso A LaboratoriosGonzalo GarciaAún no hay calificaciones
- Tutelas o CuradurasDocumento13 páginasTutelas o CuradurasGonzalo GarciaAún no hay calificaciones
- Informe de Teletrabajo Semana 24 Al 28 de Enero Del 2022 Lic - Gonzalo GarciaDocumento2 páginasInforme de Teletrabajo Semana 24 Al 28 de Enero Del 2022 Lic - Gonzalo GarciaGonzalo GarciaAún no hay calificaciones
- Analisis AguasDocumento94 páginasAnalisis AguasRom AguicAún no hay calificaciones
- Determinación de Cu en Cerveza Por EAADocumento14 páginasDeterminación de Cu en Cerveza Por EAAPedro Zúñiga PauroAún no hay calificaciones
- Saldo General Reactivos Seted de Lab. Procesos QuimicosDocumento2 páginasSaldo General Reactivos Seted de Lab. Procesos QuimicosGonzalo GarciaAún no hay calificaciones
- Cómo Hacer Desinfectantes CaserosDocumento5 páginasCómo Hacer Desinfectantes CaserosGonzalo GarciaAún no hay calificaciones
- Cronograma Culminación Analisis 1Documento3 páginasCronograma Culminación Analisis 1Gonzalo GarciaAún no hay calificaciones
- Guias Practicas de Laboratorio de TermodinamicaDocumento140 páginasGuias Practicas de Laboratorio de TermodinamicaGonzalo GarciaAún no hay calificaciones
- Borrador de Anteproyecto - Torres & VincesDocumento13 páginasBorrador de Anteproyecto - Torres & VincesGonzalo GarciaAún no hay calificaciones
- AnteproyectoDocumento9 páginasAnteproyectoGonzalo GarciaAún no hay calificaciones
- Guia de Seguridad y Buenas Practicas en El LaboratorioDocumento63 páginasGuia de Seguridad y Buenas Practicas en El LaboratorioGonzalo GarciaAún no hay calificaciones
- ManualDocumento78 páginasManualcristian camposAún no hay calificaciones
- Reactivos SeptiembreDocumento4 páginasReactivos SeptiembreGonzalo GarciaAún no hay calificaciones
- FORMULARIOS EXTERNOS - FO DCSC UE 010 UsoDocumento3 páginasFORMULARIOS EXTERNOS - FO DCSC UE 010 UsoGonzalo GarciaAún no hay calificaciones
- Analisis Quimico Cuantitativo IDocumento6 páginasAnalisis Quimico Cuantitativo IGonzalo GarciaAún no hay calificaciones
- Síntesis Del Acido Octanóico A Partir Del OctanolDocumento12 páginasSíntesis Del Acido Octanóico A Partir Del Octanolkaren peñatesAún no hay calificaciones
- Determinacion de Grados APIDocumento118 páginasDeterminacion de Grados APIGabiita Lara CevallosAún no hay calificaciones
- Cronograma Culminación Analisis 1Documento3 páginasCronograma Culminación Analisis 1Gonzalo GarciaAún no hay calificaciones
- Acta VinculaciónDocumento1 páginaActa VinculaciónGonzalo GarciaAún no hay calificaciones
- TERMODLAB1920Documento32 páginasTERMODLAB1920Gonzalo GarciaAún no hay calificaciones
- Syllabus Industrias y Procesos IiDocumento12 páginasSyllabus Industrias y Procesos IiGonzalo GarciaAún no hay calificaciones
- Syllabus Industrias y Procesos IiDocumento12 páginasSyllabus Industrias y Procesos IiGonzalo GarciaAún no hay calificaciones
- TPL 4 - Abs AtómicaDocumento13 páginasTPL 4 - Abs AtómicaEdupanda m100% (1)
- Analisis Instrumental PDFDocumento6 páginasAnalisis Instrumental PDFGonzalo GarciaAún no hay calificaciones
- Gravimetria Por VolatilizacionDocumento6 páginasGravimetria Por VolatilizacionGonzalo GarciaAún no hay calificaciones