Documentos de Académico
Documentos de Profesional
Documentos de Cultura
18 Lewis 2
Cargado por
AlexDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
18 Lewis 2
Cargado por
AlexCopyright:
Formatos disponibles
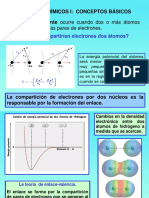
Estructura molecular
Enlace por pares de electrones
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Antecedentes
Aunque la Mecánica Cuántica es la manera de proceder, nosotros comen-
zaremos el estudio de las moléculas mediante modelos más sencillos.
El primero, y más sencillo, es el propuesto por G. N. Lewis en 1916 y
se conoce como:
“Enlace por pares de electrones” (Modelo de Lewis)
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Antecedentes
Aunque la Mecánica Cuántica es la manera de proceder, nosotros comen-
zaremos el estudio de las moléculas mediante modelos más sencillos.
El primero, y más sencillo, es el propuesto por G. N. Lewis en 1916 y
se conoce como:
“Enlace por pares de electrones” (Modelo de Lewis)
Este se basa en dos puntos:
a) Estabilidad de los gases nobles.
b) El hecho de que muchas moléculas presentan un número par de
electrones.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Enlace por pares de electrones
Lewis propone lo siguiente:
En una molécula los átomos se mantienen unidos al compartir un par
de electrones. De esta manera cada átomo puede adquirir una config-
uración de gas noble.
H2 : H + H −→ HH
1s 1 1s 1 −→ 1s 2 = [He]
HF : H + F −→ HF
1s 1 1s 2 2s 2 2p 5 −→ H : [He]
−→ F : [Ne]
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Enlace por pares de electrones
Para Lewis:
Cuando electrones desapareados en dos átomos se aparean forman un
Enlace Covalente.
CH4 : 4H + C −→ H C H
Es usual representar al par compartido de electrones o enlace covalente
por medio de una lı́nea.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Enlace por pares de electrones
En las estructuras de Lewis se distinguen dos tipos de pares electrónicos:
a) Pares de enlace: Aquellos que participan en la formación del enlace
covalente (lı́neas).
b) Pares solitarios o de no enlace: Estos son pares de electrones que
no contribuyen directamente al enlace.
En CF4 tenemos
4 pares de enlace C – F
3 pares de no enlace en cada F
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Escritura de las estructuras de Lewis
En general, nosotros seguiremos 5 pasos para su escritura:
1) Escribir la fórmula del compuesto y determinar la manera es que
están enlazados los átomos (átomo central y periféricos). Usual-
mente el átomo central es el menos electronegativo.
2) Obtener el número de electrones de valencia en la molécula, sumando
los electrones de cada átomo. En iones se suma o resta el número
de electrones equivalente a su carga.
3) Unir los átomos mediante una lı́nea par de enlace para representar
a un enlace covalente.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Escritura de las estructuras de Lewis
En general, nosotros seguiremos 5 pasos para su escritura:
1) Escribir la fórmula del compuesto y determinar la manera es que
están enlazados los átomos (átomo central y periféricos). Usual-
mente el átomo central es el menos electronegativo.
2) Obtener el número de electrones de valencia en la molécula, sumando
los electrones de cada átomo. En iones se suma o resta el número
de electrones equivalente a su carga.
3) Unir los átomos mediante una lı́nea par de enlace para representar
a un enlace covalente.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Escritura de las estructuras de Lewis
4) Distribuir los electrones restantes como pares de no enlace alrede-
dor de los átomos intentando que cada uno complete su octeto.
5) Si un átomo presenta un octeto incompleto, se pueden utilizar
pares de no enlace y formar enlaces dobles, triples, . . . para com-
pletar octetos.
A continuación realicemos algunos ejemplos para entender mejor cada
uno de estos pasos.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4 χC < χCl
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4 χC < χCl
Átomo e − valencia e − estructura
C 4
32e −
Cl 7
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4 χC < χCl
Átomo e − valencia e − estructura
C 4
32e −
Cl 7
4 pares de enlace = 8e −
12 pares de no enlace = 24e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4 χC < χCl
Átomo e − valencia e − estructura
C 4
32e −
Cl 7
4 pares de enlace = 8e −
12 pares de no enlace = 24e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Ejemplos:
a) CCl4 χC < χCl
Átomo e − valencia e − estructura
C 4
32e −
Cl 7
4 pares de enlace = 8e −
12 pares de no enlace = 24e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
1 pares de enlace = 2e −
5 pares de no enlace = 10e −
¡Octeto incompleto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
2 pares de enlace = 2e −
5 pares de no enlace = 10e −
¡Octeto incompleto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
2 pares de enlace = 2e −
5 pares de no enlace = 10e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
2 pares de enlace = 2e −
5 pares de no enlace = 10e −
¡Octeto incompleto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
a) O2 χO = χO
Átomo e − valencia e − estructura
O 6 12e −
2 pares de enlace = 4e −
4 pares de no enlace = 8e −
¡Utilizamos pares de no enlace para formar un doble enlace!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Efectivamente el O2 presenta un doble enlace en su estructura.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Efectivamente el O2 presenta un doble enlace en su estructura.
¿Conclusión?
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Efectivamente el O2 presenta un doble enlace en su estructura.
¿Conclusión?
“El modelo de Lewis puede dar cuenta del orden de enlace de ciertas
moléculas”
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6 χS < χF
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6 χS < χF
Átomo e − valencia e − estructura
S 6
48e −
F 7
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6 χS < χF
Átomo e − valencia e − estructura
S 6
48e −
F 7
6 pares de enlace = 12e −
18 pares de no enlace = 36e −
¡Si el elemento es del tercer periodo o superior, puede tener más de 8
electrones en su valencia!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6 χS < χF
Átomo e − valencia e − estructura
S 6
48e −
F 7
6 pares de enlace = 12e −
18 pares de no enlace = 36e −
¡Si el elemento es del tercer periodo o superior, puede tener más de 8
electrones en su valencia!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
c) SF6 χS < χF
Átomo e − valencia e − estructura
S 6
48e −
F 7
6 pares de enlace = 12e −
18 pares de no enlace = 36e −
¡Si el elemento es del tercer periodo o superior, puede tener más de 8
electrones en su valencia!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Elementos del tercer periodo o superiores presentan octetos extendidos
(hipervalentes)
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Elementos del tercer periodo o superiores presentan octetos extendidos
(hipervalentes)
¿Por qué ocurre esto?
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Elementos del tercer periodo o superiores presentan octetos extendidos
(hipervalentes)
¿Por qué ocurre esto?
“Esto de debe a la existencia de orbitales d, n = 3, ` = 0, 1, 2”
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3 χB < χH
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3 χB < χH
Átomo e − valencia e − estructura
B 3
6e −
H 1
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3 χB < χH
Átomo e − valencia e − estructura
B 3
6e −
H 1
3 pares de enlace = 6e −
0 pares de no enlace = 0e −
¡Boro no completa su octeto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3 χB < χH
Átomo e − valencia e − estructura
B 3
6e −
H 1
3 pares de enlace = 6e −
0 pares de no enlace = 0e −
¡Boro no completa su octeto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
d) BH3 χB < χH
Átomo e − valencia e − estructura
B 3
6e −
H 1
3 pares de enlace = 6e −
0 pares de no enlace = 0e −
¡Boro no completa su octeto!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
La realidad es que BH3 es extremadamente inestable, tanto ası́ que
quien usualmente es detectado en la naturaleza es su dı́mero (BH3 )2 :
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
La realidad es que BH3 es extremadamente inestable, tanto ası́ que
quien usualmente es detectado en la naturaleza es su dı́mero (BH3 )2 :
Pero, BH3 es un ejemplo de como algunos compuestos pueden presentar
octetos incompletos.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
e) NH3
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
e) NH3 χH < χN
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
e) NH3 χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
e) NH3 χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
¡H no será el átomo central!
3 pares de enlace = 6e −
1 pares de no enlace = 2e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
e) NH3 χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
¡H no será el átomo central!
3 pares de enlace = 6e −
1 pares de no enlace = 2e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
f) NH4 + χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
f) NH4 + χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
4 pares de enlace = 8e −
0 pares de no enlace = 0e −
¡Los iones siempre se presentan entre corchetes!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
f) NH4 + χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
4 pares de enlace = 8e −
0 pares de no enlace = 0e −
¡Los iones siempre se presentan entre corchetes!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
f) NH4 + χH < χN
Átomo e − valencia e − estructura
N 5
8e −
H 1
4 pares de enlace = 8e −
0 pares de no enlace = 0e −
¡Los iones siempre se presentan entre corchetes!
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
¿A qué átomo podemos asociar la carga del ión?:
Especie átomo #e −
NH3 N 5
NH4 + N 4
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
¿A qué átomo podemos asociar la carga del ión?:
Especie átomo #e −
NH3 N 5
NH4 + N 4
Aquı́ surge el concepto de carga formal.
Esta carga puede considerarse como la carga parcial de un átomo en una
molécula. Para calcularla, se deben considerar el número de electrones
asociados a un átomo en su estado aislado, respecto al número de ellos
en la molécula.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Por lo tanto, la estructura de Lewis correcta para el NH4 + es:
Especie átomo #e −
NH3 N 5
NH4 + N 4
Aquı́ surge el concepto de carga formal.
Esta carga puede considerarse como la carga parcial de un átomo en una
molécula. Para calcularla, se deben considerar el número de electrones
asociados a un átomo en su estado aislado, respecto al número de ellos
en la molécula.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
g) NO2 – (ión nitrito) χN < χO
Átomo e − valencia e − estructura
N 5
18e −
O 6
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
g) NO2 – (ión nitrito) χN < χO
Átomo e − valencia e − estructura
N 5
18e −
O 6
2 pares de enlace = 4e −
7 pares de no enlace = 14e −
¿Cargas formales?
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
g) NO2 – (ión nitrito) χN < χO
Átomo e − valencia e − estructura
N 5
18e −
O 6
2 pares de enlace = 4e −
7 pares de no enlace = 14e −
¿Cargas formales?
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Especie átomo #e −
NO2 – O 7
N 4
Cada oxigeno tendrı́a una carga formal negativa y el nitrógeno una
carga formal positiva.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Especie átomo #e −
NO2 – O 7
N 4
Cada oxigeno tendrı́a una carga formal negativa y el nitrógeno una
carga formal positiva.
Pero, ¿es válida esta estructura?
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Especie átomo #e −
NO2 – O 7
N 4
Cada oxigeno tendrı́a una carga formal negativa y el nitrógeno una
carga formal positiva.
Pero, ¿es válida esta estructura?
¡No, el N no tiene un octeto completa!,
debemos añadir enlaces multiples.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Añadir enlaces multiples a la estructura anterior da pie a dos casos:
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Añadir enlaces multiples a la estructura anterior da pie a dos casos:
i) Primera estructura:
3 pares de enlace = 6e −
6 pares de no enlace = 12e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Pero no es la única:
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Pero no es la única:
iI) Segunda estructura:
3 pares de enlace = 6e −
6 pares de no enlace = 12e −
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Cuando un compuesto puede tener más de una estructura de Lewis
válida, estas se conocen como estructuras de RESONANCIA.
La flecha indica que puede haber interconversión entre una estructura
y otra.
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Cuando un compuesto puede tener más de una estructura de Lewis
válida, estas se conocen como estructuras de RESONANCIA.
La flecha indica que puede haber interconversión entre una estructura
y otra. Dicho de otra manera, la estructura de la molécula será un
hı́drido entre ambas estructuras. Consideren al ozono O3 :
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Cuando un compuesto puede tener más de una estructura de Lewis
válida, estas se conocen como estructuras de RESONANCIA.
La flecha indica que puede haber interconversión entre una estructura
y otra. Dicho de otra manera, la estructura de la molécula será un
hı́drido entre ambas estructuras. Consideren al ozono O3 :
Estructura de la Materia Modelo de Lewis Semestre 2018-2
Estructuras de Lewis
Otro ejemplo clásico es la molécula de benceno.
Por ello, es que también suele representarse como:
Estructura de la Materia Modelo de Lewis Semestre 2018-2
También podría gustarte
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Tema 4. Enlace Químico Libro PrincipalDocumento33 páginasTema 4. Enlace Químico Libro PrincipalPedro NapiasAún no hay calificaciones
- Estructura de LewisDocumento2 páginasEstructura de LewisValeria MejíaAún no hay calificaciones
- Estructura de Lewis Quimica GeneralDocumento93 páginasEstructura de Lewis Quimica GeneralMatías Alejandro Gaete Flores100% (1)
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosDe EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosAún no hay calificaciones
- Ejercicios de Enlace QuimicoDocumento18 páginasEjercicios de Enlace Quimicoafrunp5186Aún no hay calificaciones
- Estrategias de La NegociaciónDocumento9 páginasEstrategias de La Negociaciónjeniffer alejandra ZamoraAún no hay calificaciones
- Estructura de LewisDocumento10 páginasEstructura de LewisDar MendezAún no hay calificaciones
- Clase Enlace Quimico ACTUALDocumento73 páginasClase Enlace Quimico ACTUALDanielLeMuzzAún no hay calificaciones
- ? Estructura de Lewis - Ejemplos - Regla Del Octeto - Ejercicios de LewisDocumento4 páginas? Estructura de Lewis - Ejemplos - Regla Del Octeto - Ejercicios de Lewisaquino_danielaAún no hay calificaciones
- Problemas Resueltos - Estructura de LewisDocumento8 páginasProblemas Resueltos - Estructura de Lewisp.montper0% (1)
- Simbolos Lewis y Regla Del OctetoDocumento9 páginasSimbolos Lewis y Regla Del OctetoLuz Marina M. SancaAún no hay calificaciones
- Estructura de LewisDocumento15 páginasEstructura de LewisAmadaAún no hay calificaciones
- Unid 1 Tema 5 Estructura de LewisDocumento26 páginasUnid 1 Tema 5 Estructura de LewisPatricia Raimondi100% (1)
- SESION 04 - ESTRUCTURA DE LEWIS (1) - TaggedDocumento20 páginasSESION 04 - ESTRUCTURA DE LEWIS (1) - Taggedthalia payanoAún no hay calificaciones
- Enlace CovalenteDocumento48 páginasEnlace CovalentejorgeAún no hay calificaciones
- Estructura de Lewis 2011Documento49 páginasEstructura de Lewis 2011Valentina JavieraAún no hay calificaciones
- Clasificacion Enlaces Quimicos (Autoguardado)Documento57 páginasClasificacion Enlaces Quimicos (Autoguardado)Nancy FloresAún no hay calificaciones
- Enlace Químico. Libro PrincipalDocumento33 páginasEnlace Químico. Libro PrincipalshawtyAún no hay calificaciones
- Tema 2Documento37 páginasTema 2juan davidAún no hay calificaciones
- Enlace Covalente 2020 1c2aa Parte Estructuras de LewisDocumento22 páginasEnlace Covalente 2020 1c2aa Parte Estructuras de LewisIngrith Yohana FIGUEROA RODRIGUEZAún no hay calificaciones
- El Enlace Químico (I)Documento24 páginasEl Enlace Químico (I)D. AguiarAún no hay calificaciones
- Química I U2Documento40 páginasQuímica I U2On Binjuu xdAún no hay calificaciones
- Actividad 2Documento10 páginasActividad 2Anaiska PonceAún no hay calificaciones
- Problemas Numéricos y Cuestiones. Capítulo 6Documento8 páginasProblemas Numéricos y Cuestiones. Capítulo 6Da.Kracken Rz RzAún no hay calificaciones
- Enlace Quimico 1Documento51 páginasEnlace Quimico 1DS LindaAún no hay calificaciones
- Enlace Quimico Completo PDFDocumento38 páginasEnlace Quimico Completo PDFkatherineAún no hay calificaciones
- Tema 1.2. Enlace QuímicoDocumento97 páginasTema 1.2. Enlace QuímicoJavaeAún no hay calificaciones
- Geometria y PolaridadDocumento21 páginasGeometria y PolaridadArturo VelascoAún no hay calificaciones
- WP Contentuploads2017014. ENLACE QUÍMICO. LIBRO PRINCIPAL PDFDocumento29 páginasWP Contentuploads2017014. ENLACE QUÍMICO. LIBRO PRINCIPAL PDFCarmen SánchezAún no hay calificaciones
- Tema 3 - Quimica I - IADocumento65 páginasTema 3 - Quimica I - IARebeca RenedoAún no hay calificaciones
- Enlaces Quimicos Estructura de LewisDocumento42 páginasEnlaces Quimicos Estructura de LewisPablo Leopoldo Núñez VassalloAún no hay calificaciones
- Tema 1Documento78 páginasTema 1Antonio MarquezAún no hay calificaciones
- Guia N 5, Quìmic 10, II TrimestreDocumento8 páginasGuia N 5, Quìmic 10, II TrimestreIsaias Caicedo100% (1)
- Estructuras de LewisDocumento16 páginasEstructuras de LewisRey Bryan VicenteAún no hay calificaciones
- Teoria y Ejercicios de Tema Estructura de Lewis Clei VDocumento6 páginasTeoria y Ejercicios de Tema Estructura de Lewis Clei Vangela roseroAún no hay calificaciones
- Fundamentos de QuimicaDocumento37 páginasFundamentos de Quimicasanemi5Aún no hay calificaciones
- Guia N 10 Quimica 10 4 Enlace Químico 2014Documento15 páginasGuia N 10 Quimica 10 4 Enlace Químico 2014Cristian Javier Castellanos BrievaAún no hay calificaciones
- Enlaces Quimicos EjerciciosDocumento11 páginasEnlaces Quimicos EjerciciosAlexander Capcha MuñozAún no hay calificaciones
- Apuntes de Quimica Organica IDocumento32 páginasApuntes de Quimica Organica Imelvin moralesAún no hay calificaciones
- Semana 5 - Enlace QuimicoDocumento41 páginasSemana 5 - Enlace QuimicoSEBASTIAN HUARINGA GOICOCHEAAún no hay calificaciones
- Clase 1Documento18 páginasClase 1PaulusAún no hay calificaciones
- Semana 2Documento35 páginasSemana 2frajoahuAún no hay calificaciones
- Uniones Qcas LewisDocumento27 páginasUniones Qcas LewisFacundo GallardoAún no hay calificaciones
- Captura de Pantalla 2023-08-24 A La(s) 4.46.23Documento16 páginasCaptura de Pantalla 2023-08-24 A La(s) 4.46.23Paola Esperanza Perez PeraltaAún no hay calificaciones
- Presentacion Enlace CovalenteDocumento27 páginasPresentacion Enlace CovalentePaulaAún no hay calificaciones
- Estructuras de LewisDocumento17 páginasEstructuras de LewisEmmanuel CocomAún no hay calificaciones
- Notas Tercer ParcialDocumento68 páginasNotas Tercer ParcialRuiz AlbertoAún no hay calificaciones
- Enlace, Polaridad y Geometría MolecularDocumento9 páginasEnlace, Polaridad y Geometría MolecularFrancisca RojasAún no hay calificaciones
- Diapositivas Unidad 4Documento70 páginasDiapositivas Unidad 4agustin lopezAún no hay calificaciones
- Enlace Químico 3Documento38 páginasEnlace Químico 3LolaAún no hay calificaciones
- Clase 11 - Geometria MolecularDocumento8 páginasClase 11 - Geometria MolecularJuan Jose MedinaAún no hay calificaciones
- Estructura de LewisDocumento13 páginasEstructura de LewisEduver Polanco CruzAún no hay calificaciones
- Unidad III - Enlaces Quimicos - 2020Documento14 páginasUnidad III - Enlaces Quimicos - 2020Mirna Josefina Alemán FrancoAún no hay calificaciones
- Química: Unidad Ii. Enlaces Químicos Y El Estado Sólido (Cristalino)Documento35 páginasQuímica: Unidad Ii. Enlaces Químicos Y El Estado Sólido (Cristalino)Ana GalavizAún no hay calificaciones
- Estructura de LewisDocumento12 páginasEstructura de Lewisrivearturo03Aún no hay calificaciones
- Enlaces QuimicosDocumento27 páginasEnlaces QuimicosAda Zirce Garcia Del Valle DiegoAún no hay calificaciones
- Enlace Quimico 2023Documento26 páginasEnlace Quimico 2023deltaromero028Aún no hay calificaciones
- CCEjemplo 2Documento3 páginasCCEjemplo 2AlexAún no hay calificaciones
- CCEjemplo 1Documento3 páginasCCEjemplo 1AlexAún no hay calificaciones
- Examen P3-211208Documento2 páginasExamen P3-211208AlexAún no hay calificaciones
- Traduccion ArticuloDocumento12 páginasTraduccion ArticuloAlexAún no hay calificaciones
- Actividad Hierros - Parctica 2Documento3 páginasActividad Hierros - Parctica 2AlexAún no hay calificaciones
- Fundición Tarea 15 (2022-1)Documento4 páginasFundición Tarea 15 (2022-1)AlexAún no hay calificaciones
- Fundición Tarea 12 (2022-1)Documento4 páginasFundición Tarea 12 (2022-1)AlexAún no hay calificaciones
- Fundición Tarea 6 (2022-1)Documento3 páginasFundición Tarea 6 (2022-1)AlexAún no hay calificaciones
- Fundición Tarea 5 (2022-1)Documento3 páginasFundición Tarea 5 (2022-1)AlexAún no hay calificaciones
- Capacitor EsDocumento11 páginasCapacitor EsAlexAún no hay calificaciones
- 5 Heisenberg SchroedingerDocumento65 páginas5 Heisenberg SchroedingerAlexAún no hay calificaciones
- Examen Alquenos 1311Documento3 páginasExamen Alquenos 1311AlexAún no hay calificaciones
- Resumen Historia de La ProgramaciónDocumento2 páginasResumen Historia de La Programacióneddier de jesus rodriguez mendozaAún no hay calificaciones
- Administrar Router Del Cliente de Forma Remota o Local - UbiquitiDocumento5 páginasAdministrar Router Del Cliente de Forma Remota o Local - Ubiquiticarlos mesiasAún no hay calificaciones
- BrochureDocumento18 páginasBrochureDaymar GarciaAún no hay calificaciones
- Yii Framework Tutorial EspañolDocumento19 páginasYii Framework Tutorial EspañolIvan FernandezAún no hay calificaciones
- Seleccionar Los Sistemas Básicos de Automatización, Así Como Los Elementos A Implementar, Atendiendo Los Requerimientos Establecidos PDFDocumento4 páginasSeleccionar Los Sistemas Básicos de Automatización, Así Como Los Elementos A Implementar, Atendiendo Los Requerimientos Establecidos PDFAndresCarvajalOrtegaAún no hay calificaciones
- Vademecum NormabustosDocumento43 páginasVademecum NormabustosAlexis MercadoAún no hay calificaciones
- Física I-Laboratorio 2Documento4 páginasFísica I-Laboratorio 2Harold Briceño FloresAún no hay calificaciones
- Fra - Ov94-8585-Camara de Comercio BogotaDocumento1 páginaFra - Ov94-8585-Camara de Comercio BogotaJOHANNA VARGASAún no hay calificaciones
- Manual Grupos Electrogenos Cummins Diesel 45 250kvaDocumento34 páginasManual Grupos Electrogenos Cummins Diesel 45 250kvaLuisana Leon martinezAún no hay calificaciones
- DUARTE FLORES MICHEL ARMANDO - Actividad de Óxidos, Hidróxidos y ÁcidosDocumento6 páginasDUARTE FLORES MICHEL ARMANDO - Actividad de Óxidos, Hidróxidos y ÁcidosMichel DuarteAún no hay calificaciones
- Creación de TablasDocumento12 páginasCreación de TablasAlonso HernandezAún no hay calificaciones
- MODULO - Hojas de CalculoDocumento51 páginasMODULO - Hojas de CalculoPingui1000Aún no hay calificaciones
- Induccion: Actividades Iniciales Fase de AnalisisDocumento4 páginasInduccion: Actividades Iniciales Fase de AnalisisivanAún no hay calificaciones
- Otrupo 1Documento34 páginasOtrupo 1Lois Sacarias100% (1)
- Cap III ArchivosDocumento11 páginasCap III ArchivosJose MartinezAún no hay calificaciones
- Proceso de Servicio en Una CafeteríaDocumento4 páginasProceso de Servicio en Una CafeteríaAudeyAún no hay calificaciones
- Reseña CloroDocumento8 páginasReseña CloroJavier Antonio OlmosAún no hay calificaciones
- PAQUETE PRIORIZADO Nutricion Cero 20-04-2022Documento45 páginasPAQUETE PRIORIZADO Nutricion Cero 20-04-2022Jose ReinosaAún no hay calificaciones
- Armand FeigenbaumDocumento13 páginasArmand FeigenbaumJohn AlexanderAún no hay calificaciones
- 14 Portela - MassanoDocumento5 páginas14 Portela - MassanoLuis AlvaroAún no hay calificaciones
- 02 Responsabilidad y Etica Profesional 2017Documento9 páginas02 Responsabilidad y Etica Profesional 2017Gustavo HurtadoAún no hay calificaciones
- Catálogo Dv4Documento3 páginasCatálogo Dv4Adolfo MontecinosAún no hay calificaciones
- Biblioteca BodoniDocumento2 páginasBiblioteca BodoniNoeliaAún no hay calificaciones
- Investigacion No.1 Programacion Orientada A Objetos. (18600209) (18600200)Documento18 páginasInvestigacion No.1 Programacion Orientada A Objetos. (18600209) (18600200)Mara Leal RuízAún no hay calificaciones
- Op Cargas SuspendidasDocumento155 páginasOp Cargas SuspendidasFABRICIO JESUS ALARCON NARRYAún no hay calificaciones
- RJ 1992 - 2022oaf-Costo Acdemcios Año 2023Documento4 páginasRJ 1992 - 2022oaf-Costo Acdemcios Año 2023Roberto Fernando CoronadoAún no hay calificaciones
- 1 Sanidad Acuicola - IntroduccionDocumento13 páginas1 Sanidad Acuicola - IntroduccionNestor Alejandro Velazco Silva100% (1)
- Dibujar Ojos Manga y Anime - CASADocumento24 páginasDibujar Ojos Manga y Anime - CASAM.A.Aún no hay calificaciones
- DESARROLLO CASO INTEGRADOR 1 Final 2Documento8 páginasDESARROLLO CASO INTEGRADOR 1 Final 2Andres Mauricio RojasAún no hay calificaciones