Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Termodinamica Del Equilibrio Ejercicio PDF
Termodinamica Del Equilibrio Ejercicio PDF
Cargado por
foreveralonevnzTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Termodinamica Del Equilibrio Ejercicio PDF
Termodinamica Del Equilibrio Ejercicio PDF
Cargado por
foreveralonevnzCopyright:
Formatos disponibles
UNIVERSIDAD CENTRAL DE VENEZUELA
TERMODINÁMICA DEL EQUILIBRIO
SEM 3-2014
1) Para una mezcla de vapor equimolar de propano(l) y n-pentano(2) a 75 ºC y 2 bar, estime Z, HR y
SR. (Ejercicio 11.33 Van Ness)
Resolver por Redlich-Kwong
Datos:
Tc(K) Pc(bar) ω
1 369,8 42,48 0,152
2 469,7 33,70 0,252
Planteamiento:
y1=y2=0,5
Deseamos calcular z, Hr y Sr por medio de las ecuaciones siguientes:
(I); ( ) (II); * + ( ) (III)
Calcular a, b, A, B y θ (De la mezcla)
a=y12 .a1+2y1.y2.a12+y22.a22
a1= 0,42748*(R. Tc1)2/Pc1 ;
a2= 0,42748*(R. Tc2)2/Pc2
a12 = √ ; k12 es el parámetro de interacción y si no se da como dato, generalmente se
asume igual a cero. Por lo tanto a12 = √
b=Σyi.bi ; bi=0,08664R.Tci/Pci
√ ; Trm=T/Tcm (Trm es la temperatura pseudoreducida y Tcm la temp psuedocrítica)
∑
A=θ.P/(R.T)2
B=b.P/R.T
Teniendo A y B de la mezcla se obtienen los coeficientes del polinomio que define z:
α=-1; β=A-B-B2; γ=-A.B
Una vez calculado z, hallar el volumen empleando V=zRT/P.
Luego sustituir z y V en las ecuaciones (II) y (III) para obtener HR y SR
2) El volumen molar (cm3 /mol) de una mezcla binaria líquida a T y P se conocen por:
+ +
V = 120x1 70X2 (15x1 8X2)X1X2 +
a) Encuentre expresiones para los volúmenes molares parciales de las especies 1 y 2 a T y P.
b) Compruebe que cuando estas expresiones se combinan de acuerdo con la ecuación V=Σxi*Vi , se
recupera la ecuación conocida para V.
c) Demuestre que estas expresiones satisfacen la ecuación de Gibbs-Duhem.
̅
d) Demuestre que ( ) ( )
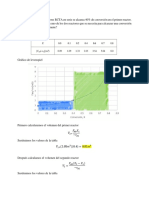
e) Grafique, en función de X1, los valores de V, y calculados a partir de la ecuación de V y de las desarrolladas
en el inciso (a).
(Ejercicio 11.13 Van Ness)
Preparador Jeferson Donado
Planteamiento:
a) Linealizar la ecuación dada para V, expresada solo en función de x1, es decir, sustituyendo x2=1-x1.
Luego determinar V1 y V2 empleando las ecuaciones:
̅ ; ̅
b) ̅ y ̅ , se debe llegar a la ecuación original de V al multiplicar
cada una de estas por su composición.
̅ ̅ ; Se debería llegar a la ecuación de V expresada en función de x1.
c) Ecuación de Gibbs-Duhem es ( ) ( ) ∑ ̅
Como el proceso se da a P y T constantes los dos primeros términos son iguales a cero; quedando al final la
ecuación a demostrar de la siguiente manera:
̅ ̅ (Se deriva V1 y V2 respecto de una sola variable, por tanto ambas
deben estar expresadas solo en función de x1 o x2)
3) Calcule los coeficientes de fugacidad de una mezcla de metano (1) y etano (2) a 37,73 y a una presión de
40,827 atm usando la ecuación de Redlich-Kwong.
Determine el error que se comete al usar esta ecuación si los resultados obtenidos experimentalmente son:
Compuesto Tc(k) Pc(MPa) ω Φexp
Metano 190,6 4,6 0,012 0,9301
Etano 305,4 4,884 0,100 0,7844
Planteamiento:
Como no nos dan la composición como dato, suponemos mezcla equimolar.
La ecuación de Redlich-Kwong para el coeficiente de fugacidad está dada por:
[ ] ( )
Se procede como en el planteamiento del ejercicio (1) Calculando a, b, θ, A, B y z de la mezcla.
Adicionalmente será necesario calcular θi, Ai y Bi
√
Ai=(θi.P)/(R.T)2
Bi=(bi.P)/(R.T)
Sustituir en la ecuación de Φi, y una vez obtenidos los valores de Φ1 y Φ2 calcular el porcentaje de error con los
valores experimentales dados.
Preparador Jeferson Donado
También podría gustarte
- Tarea 01 Parte 1 Unidad 03 - Estela - Castellan Cap 10 Resuelto PDFDocumento23 páginasTarea 01 Parte 1 Unidad 03 - Estela - Castellan Cap 10 Resuelto PDFEdgard Estela AlencastreAún no hay calificaciones
- Taller Equilibrio #1Documento8 páginasTaller Equilibrio #1Maria Paula BuitragoAún no hay calificaciones
- ProblemarioDocumento9 páginasProblemarioREYNA DEL CARMEN GUTIERREZ GUTIERREZAún no hay calificaciones
- Ejercicios Cap. 12 (Smith, Van Ness)Documento2 páginasEjercicios Cap. 12 (Smith, Van Ness)Sergio Rozo PerdomoAún no hay calificaciones
- Ejercicio 11.13Documento5 páginasEjercicio 11.13Andrea Sarahi Izquiy VAún no hay calificaciones
- Ejercicio de TermodinámicaDocumento2 páginasEjercicio de TermodinámicaMaira Mendiola100% (2)
- Practica 8Documento2 páginasPractica 8EDUIN JOSLI URBINA TAPIAAún no hay calificaciones
- Ejercicio Ley de Raoult NmodificadaDocumento5 páginasEjercicio Ley de Raoult NmodificadaUlises Barrientos Sánchez100% (1)
- Universidad de San Carlos de GuatemalaDocumento10 páginasUniversidad de San Carlos de GuatemalaGabriela MontenegroAún no hay calificaciones
- Se Emplea Un Intercambiador de Calor para Enfriar AceiteDocumento2 páginasSe Emplea Un Intercambiador de Calor para Enfriar AceiteAlan BritoAún no hay calificaciones
- Problemas LeyRaoult 4oct2019Documento15 páginasProblemas LeyRaoult 4oct2019DavidMejiaAún no hay calificaciones
- Tarea ProDocumento4 páginasTarea Provicky gonzalezAún no hay calificaciones
- Fenomenos de Tranporte - Bird Problema 2b-2Documento7 páginasFenomenos de Tranporte - Bird Problema 2b-2stephanieAún no hay calificaciones
- Práctica 1 Calor Diferencial de SoluciónDocumento7 páginasPráctica 1 Calor Diferencial de SoluciónDaniel Ortiz LealAún no hay calificaciones
- Reacciones ComplejasDocumento26 páginasReacciones ComplejasErika Itzel C AAún no hay calificaciones
- ProblemasDocumento5 páginasProblemasEduardo Javier PerezAún no hay calificaciones
- Ecuación de Estado de RedlichDocumento13 páginasEcuación de Estado de RedlichAlis Carbajal PinedaAún no hay calificaciones
- Ejercicio #2Documento11 páginasEjercicio #2Miguel Paramo100% (1)
- Ejercicios Intercambiador de CalorDocumento12 páginasEjercicios Intercambiador de CalorOttofrech86Aún no hay calificaciones
- 3.8 LevenspielDocumento2 páginas3.8 LevenspielBrenda KarenAún no hay calificaciones
- Problema 10.22Documento1 páginaProblema 10.22Ezequiel García Palomo100% (2)
- Tarea 2 PDFDocumento5 páginasTarea 2 PDFLuis Enrique Sanchez Mercado :DAún no hay calificaciones
- Tarea XI TermoDocumento42 páginasTarea XI TermoGabriel Arturo Castillo CcorimayyaAún no hay calificaciones
- Universidad Autónoma de San Luis Potosí: Facultad de Ciencias QuímicasDocumento85 páginasUniversidad Autónoma de San Luis Potosí: Facultad de Ciencias QuímicasAlejandro RomoAún no hay calificaciones
- EJERCICIODocumento6 páginasEJERCICIOMAYRA YOMIRA MECA RUIZAún no hay calificaciones
- Difusion de MasaDocumento6 páginasDifusion de MasaErick SalinasAún no hay calificaciones
- DABT31MADocumento8 páginasDABT31MAdavid pizzanoAún no hay calificaciones
- FISICOQUIMICA2Documento14 páginasFISICOQUIMICA2Jesus Alexis Cervantes RamirezAún no hay calificaciones
- Problemas de Difusion MolecularDocumento4 páginasProblemas de Difusion MolecularJuan Camilo Guerrero Paredes0% (1)
- Problema 2-74Documento4 páginasProblema 2-74JuliethAún no hay calificaciones
- Tarea 8 IPDocumento38 páginasTarea 8 IPMelissa Diahnne Sánchez MendozaAún no hay calificaciones
- Problemario Fisicoquímica IIIDocumento5 páginasProblemario Fisicoquímica IIIAdrián VázquezAún no hay calificaciones
- Método Diferencial de La Cinética de Una ReacciónDocumento12 páginasMétodo Diferencial de La Cinética de Una ReacciónLuis GamarraAún no hay calificaciones
- Estimación de La Viscosidad de Un LiquidoDocumento11 páginasEstimación de La Viscosidad de Un LiquidojoaquinAún no hay calificaciones
- Considere Una Pared Plana Grande de Espesor LDocumento2 páginasConsidere Una Pared Plana Grande de Espesor LLAIME MATAMORO CIRILO100% (1)
- 2.2 Reacciones - Complejas Reversibles 1er 2do y 3er OrdenDocumento26 páginas2.2 Reacciones - Complejas Reversibles 1er 2do y 3er OrdenCM CJAún no hay calificaciones
- Espesor de Una Pelicula Descendente Tarea 2Documento3 páginasEspesor de Una Pelicula Descendente Tarea 2Luis Lisandro MayAún no hay calificaciones
- Cinética Aplicada: Ejercicio 2.18 LevenspielDocumento8 páginasCinética Aplicada: Ejercicio 2.18 LevenspielShamir Nuñez SolisAún no hay calificaciones
- Problemas Resueltos - Ingeniería de Las Reaccciones Químicas IIDocumento82 páginasProblemas Resueltos - Ingeniería de Las Reaccciones Químicas IIAlejandra VelascoAún no hay calificaciones
- Serie Eq. Liq.-Vap. 18 - IIDocumento2 páginasSerie Eq. Liq.-Vap. 18 - IIjuan islasAún no hay calificaciones
- P11-53 (Tarea)Documento3 páginasP11-53 (Tarea)Yanided ValladolisAún no hay calificaciones
- FENOMENOSDocumento4 páginasFENOMENOSHader ArdilaAún no hay calificaciones
- ADA 1 ReactoresDocumento6 páginasADA 1 ReactoresSilvanaEscobedoNoveloAún no hay calificaciones
- Operaciones Expo 3er WordDocumento6 páginasOperaciones Expo 3er WordjuanAún no hay calificaciones
- Analisis Exergetico EDE - AntoineDocumento6 páginasAnalisis Exergetico EDE - AntoineJadderMedinaAún no hay calificaciones
- Ejercicio 17.1 MC CabeDocumento3 páginasEjercicio 17.1 MC Cabeadderlyn torresAún no hay calificaciones
- Ejercicio 3.B5 BirdDocumento4 páginasEjercicio 3.B5 BirdAdderlyn Scarlette Torres RiveraAún no hay calificaciones
- Tarea 3Documento26 páginasTarea 3Paola VillalobosAún no hay calificaciones
- 1 - Practico 1Documento13 páginas1 - Practico 1Mayra DayanaAún no hay calificaciones
- Ejercicios Flujo LaminarDocumento8 páginasEjercicios Flujo LaminardanibreloAún no hay calificaciones
- Ejemplo de 5.1Documento6 páginasEjemplo de 5.1Kevin Jholsin Soto CalixtoAún no hay calificaciones
- Tarea ReaccionesDocumento9 páginasTarea ReaccionesYordy QuecañoAún no hay calificaciones
- Ejer Cici OsDocumento10 páginasEjer Cici OsagussbaAún no hay calificaciones
- Tarea 5 Seguridad de ProcesosDocumento4 páginasTarea 5 Seguridad de ProcesosCARLOS GABRIEL SANDOVAL LIASAún no hay calificaciones
- Tarea3 FTCM Equipo3Documento44 páginasTarea3 FTCM Equipo3Sergio GuzmánAún no hay calificaciones
- Listado Ejercicios Primer CertamenDocumento5 páginasListado Ejercicios Primer CertamenDaniel Esteban Leiva VidalAún no hay calificaciones
- Evidencia Distribuciones de Probabilidad 2018Documento6 páginasEvidencia Distribuciones de Probabilidad 2018NnaLupiz100% (1)
- Guia 1 - Metodos EspectroscopDocumento5 páginasGuia 1 - Metodos EspectroscopJULITUS10000Aún no hay calificaciones
- Tarea Fenomenos 2Documento5 páginasTarea Fenomenos 2Angie AcostaAún no hay calificaciones
- Potencial de Cascaron Esferico Aplicacion de Polinomios de Legendre PDFDocumento5 páginasPotencial de Cascaron Esferico Aplicacion de Polinomios de Legendre PDFLuis E. MamaniAún no hay calificaciones
- Fisica I (Fis 1100) Proyecto Didactico El Modelo Vectorial Del Espacio (Documento de Apoyo Didáctico Elaborado Por El Ing. José B. Puña V.)Documento5 páginasFisica I (Fis 1100) Proyecto Didactico El Modelo Vectorial Del Espacio (Documento de Apoyo Didáctico Elaborado Por El Ing. José B. Puña V.)Edy MonrroyAún no hay calificaciones
- Directiva Escuela Profesional l1 Equivalencias 2021Documento4 páginasDirectiva Escuela Profesional l1 Equivalencias 2021George VasquezAún no hay calificaciones
- Circutor ReactivaDocumento165 páginasCircutor ReactivaYorwin GarciaAún no hay calificaciones
- 22 solucionNumericaEDPsDocumento10 páginas22 solucionNumericaEDPsIbeth Henao de AponteAún no hay calificaciones
- Ecuaciones Diferenciales de Segundo OrdenDocumento17 páginasEcuaciones Diferenciales de Segundo OrdenYesid Correa100% (1)
- Albañileria Estructural - PresentaciónDocumento23 páginasAlbañileria Estructural - PresentaciónElvis IJAún no hay calificaciones
- Funciones TermodinámicasDocumento2 páginasFunciones TermodinámicasJesús de la RosaAún no hay calificaciones
- Compresión Por Etapas Versión 2Documento10 páginasCompresión Por Etapas Versión 2Carlos Andres HerreraAún no hay calificaciones
- Ejercicios Del Tema 10 (Calor y Temperatura)Documento2 páginasEjercicios Del Tema 10 (Calor y Temperatura)ferminAún no hay calificaciones
- Presentacion Postensado 1-1Documento48 páginasPresentacion Postensado 1-1Luis Miguel Alarcón RojasAún no hay calificaciones
- Formato t4 ProesDocumento14 páginasFormato t4 ProesJhon Erick Rios CorteganaAún no hay calificaciones
- CaratulaDocumento1 páginaCaratulaYhony PCAún no hay calificaciones
- Laboratorio Asociacion de ResistenciasDocumento13 páginasLaboratorio Asociacion de ResistenciasJulio César JaimesAún no hay calificaciones
- Actividades de ExploraciónDocumento5 páginasActividades de ExploraciónJose MartinezAún no hay calificaciones
- Compactacion de TerraplenesDocumento37 páginasCompactacion de TerraplenesMariaCatacora100% (2)
- Fiunal Exp 2Documento12 páginasFiunal Exp 2KEVIN HIDALGO VARGASAún no hay calificaciones
- Dos Péndulos Acoplados Mediante Un ResorteDocumento28 páginasDos Péndulos Acoplados Mediante Un Resorteandresfelipeguerrero100% (1)
- Transformaciones Lineales - 1Documento2 páginasTransformaciones Lineales - 1pabelAún no hay calificaciones
- Fisica AplicadaDocumento32 páginasFisica Aplicadakarlasdfg123Aún no hay calificaciones
- Diapositivas FisicaDocumento6 páginasDiapositivas Fisicajulian gonzalezAún no hay calificaciones
- Temperatura y PresionDocumento52 páginasTemperatura y PresionJeffry ArteagaAún no hay calificaciones
- Mecanica - Reporte FinishDocumento13 páginasMecanica - Reporte FinishJuan Manuel González GarciaAún no hay calificaciones
- 1er Labo de Fisica2Documento9 páginas1er Labo de Fisica2Anthony Naupari SiuAún no hay calificaciones
- Practica Trabajo Energia y Potencia 2015 DOS COLUMNASDocumento3 páginasPractica Trabajo Energia y Potencia 2015 DOS COLUMNASJorge David Romero Chamaca100% (1)
- Asignacion Tema 2. Cinematica 2021Documento4 páginasAsignacion Tema 2. Cinematica 2021gabrielAún no hay calificaciones
- Resistencia de Materiales Tema 2Documento43 páginasResistencia de Materiales Tema 2Yors Bermeo CoelloAún no hay calificaciones
- Cap 04 FuerzasDocumento7 páginasCap 04 Fuerzasramirez_cruzAún no hay calificaciones
- Vidal Alarcon Rodolfo J.Documento121 páginasVidal Alarcon Rodolfo J.david.acuna.pAún no hay calificaciones
- Tesis de Resistencia Al AvanceDocumento204 páginasTesis de Resistencia Al AvanceMihuler Yordy Romero RojasAún no hay calificaciones
- Capacitores de MarchaDocumento3 páginasCapacitores de Marchageorge_elAún no hay calificaciones