0% encontró este documento útil (0 votos)
313 vistas3 páginasAzeótropos: Definición y Ejemplos
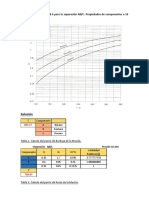
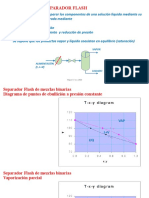
Un azeótropo es una mezcla binaria o ternaria de compuestos químicos que hierve a una temperatura constante. Puede ser de ebullición máxima o mínima. Un ejemplo es la mezcla etanol-agua, que forma un azeótropo de ebullición mínima a 78.2°C con una concentración de 95.6% de etanol. Otro ejemplo es HCl con agua, que forma un azeótropo de ebullición máxima a 110°C con una concentración de 20.2% HCl. La destil
Cargado por
EsaúDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
313 vistas3 páginasAzeótropos: Definición y Ejemplos
Un azeótropo es una mezcla binaria o ternaria de compuestos químicos que hierve a una temperatura constante. Puede ser de ebullición máxima o mínima. Un ejemplo es la mezcla etanol-agua, que forma un azeótropo de ebullición mínima a 78.2°C con una concentración de 95.6% de etanol. Otro ejemplo es HCl con agua, que forma un azeótropo de ebullición máxima a 110°C con una concentración de 20.2% HCl. La destil
Cargado por
EsaúDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd