Documentos de Académico
Documentos de Profesional
Documentos de Cultura
ACTIVIDAD 4 - Huamani Flores Adriana Alejandra
ACTIVIDAD 4 - Huamani Flores Adriana Alejandra
Cargado por
Anonymous 7NfXJMQCMgTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
ACTIVIDAD 4 - Huamani Flores Adriana Alejandra
ACTIVIDAD 4 - Huamani Flores Adriana Alejandra
Cargado por
Anonymous 7NfXJMQCMgCopyright:
Formatos disponibles
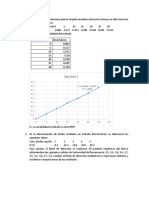
EJERCICIO PROPUESTO
La constante de basicidad Kb para el amoniaco es de 1.75 x 10-5 a 25°C (es mera
coincidencia que sea igual a Ka para el ácido acético). Calcular el pH y el pOH para
una solución 1.0 x 10-3 M de amoniaco.
𝑁𝐻3 + 𝐻2 𝑂 ⇌ 𝑁𝐻4 + 𝑂𝐻 −
(1.00 × 10−3 − 𝑥 ) 𝑥 𝑥
[𝑁𝐻4+ ][𝑂𝐻 − ]
= 1.75 𝑥 10−5
[𝑁𝐻3 ]
SOLUCIÓN:
−5
𝑥2
1.75 × 10 =
(1 × 10−3 − 𝑥)
𝑥 2 − 1.75 × 10−8 + ( 1.75 × 10−3) 𝑥 = 0
𝑥 = 1.2383 × 10−4
𝑝𝑂𝐻 = −𝑙𝑜𝑔[𝑂𝐻 − ]
𝑝𝑂𝐻 = 3.9072
𝑃𝑤 = 𝑝𝐻 + 𝑝𝑂𝐻
14 = 𝑝𝐻 + 3.9072
𝑝𝐻 = 10,0928
También podría gustarte
- Problema de Complejometria (DEL VIDEO)Documento1 páginaProblema de Complejometria (DEL VIDEO)Marcelo ArteagaAún no hay calificaciones
- Curvas de Titulacion PrecipitacionDocumento20 páginasCurvas de Titulacion PrecipitacionKarlos RamirezAún no hay calificaciones
- Practica # 7 PREPARACIÓN DE SOLUCIONES VALORADASDocumento12 páginasPractica # 7 PREPARACIÓN DE SOLUCIONES VALORADASGean HalanoccaAún no hay calificaciones
- Volumetría y Potenciometría Acido-BaseDocumento3 páginasVolumetría y Potenciometría Acido-BaseVanessa CamachoAún no hay calificaciones
- ACTIVIDAD 6 - Huamani Flores Adriana AlejandraDocumento1 páginaACTIVIDAD 6 - Huamani Flores Adriana AlejandraAnonymous 7NfXJMQCMgAún no hay calificaciones
- Conclusion EsDocumento1 páginaConclusion EsSamantha Barreto SanchezAún no hay calificaciones
- LAB #2-3 Determinación Gravimétrica de CalcioDocumento6 páginasLAB #2-3 Determinación Gravimétrica de CalcioAna Soffia Gomez AriasAún no hay calificaciones
- Curva de Calibración Por Standar Interno: Dr. Arturo Mallea AnglesDocumento4 páginasCurva de Calibración Por Standar Interno: Dr. Arturo Mallea AnglesCAROLINA MAMANI MAYTAAún no hay calificaciones
- Ejercicio 1y 2 de CurvasDocumento2 páginasEjercicio 1y 2 de CurvasNatasha VargasAún no hay calificaciones
- Cuestionaro AnalisisDocumento5 páginasCuestionaro Analisissaavedra evaristo bebeto alexisAún no hay calificaciones
- Discusion TitulacionDocumento3 páginasDiscusion TitulacionGaby NarväezAún no hay calificaciones
- Clase 19-20 CromatografiaDocumento19 páginasClase 19-20 CromatografiaJean Piero Bocanegra0% (1)
- Volumetrias de Precipitacion (UNE)Documento22 páginasVolumetrias de Precipitacion (UNE)GERMÁN COLQUE YAIBONAAún no hay calificaciones
- Discusión Vit. C FinalDocumento23 páginasDiscusión Vit. C FinalSheyla FuentesAún no hay calificaciones
- Sintesis de Cloruro de T AmiloDocumento15 páginasSintesis de Cloruro de T AmiloRicardo RíosAún no hay calificaciones
- Fundamentos Basicos de ArgentometriaDocumento3 páginasFundamentos Basicos de ArgentometriaLeslie WayneAún no hay calificaciones
- Espectrofotometria KMnO4Documento5 páginasEspectrofotometria KMnO4Eduardo Camarena SullcaAún no hay calificaciones
- Separación de Enantiómeros Por DestilaciónDocumento9 páginasSeparación de Enantiómeros Por DestilaciónAlex Huanacuni JesusAún no hay calificaciones
- Fundamento Teórico ArsenicoDocumento5 páginasFundamento Teórico Arsenicoroger2112017Aún no hay calificaciones
- Espectros IrDocumento3 páginasEspectros IrLuisafcaAún no hay calificaciones
- Informe 9Documento9 páginasInforme 9Marcela QuijanoAún no hay calificaciones
- Ejercicios UV VIS - 2 2022.1Documento8 páginasEjercicios UV VIS - 2 2022.1JONATHAN JUNIOR PARRALES BRINGASAún no hay calificaciones
- EQUILIBRIO Solucionesacuosas3Documento94 páginasEQUILIBRIO Solucionesacuosas3alessandro0% (1)
- Analisis Elemental Cualitativo Omarambi 2011Documento15 páginasAnalisis Elemental Cualitativo Omarambi 2011Oscar G. Marambio100% (1)
- 14 Sintesis de CiclohexenoDocumento3 páginas14 Sintesis de CiclohexenoSara GnrAún no hay calificaciones
- Aniones Más Comunes en Los AlimentosDocumento8 páginasAniones Más Comunes en Los AlimentosWashington Nuñez Soto100% (1)
- Ficha Tecnica Sodio Almidon Glicolato FagronDocumento1 páginaFicha Tecnica Sodio Almidon Glicolato FagronportosinAún no hay calificaciones
- Guia de Lab SolucionesDocumento7 páginasGuia de Lab SolucionesSofia UrregoAún no hay calificaciones
- Cómo Hacer Jabón de BarraDocumento3 páginasCómo Hacer Jabón de BarraEduard MaitaAún no hay calificaciones
- Fotometria Visible - Lab Analisis InstrumentalDocumento7 páginasFotometria Visible - Lab Analisis InstrumentalJuliana LondoñoAún no hay calificaciones
- Informe 5 Acidimetria 1 Parte PDFDocumento10 páginasInforme 5 Acidimetria 1 Parte PDFDani SantoyoAún no hay calificaciones
- Prob. PPMDocumento6 páginasProb. PPMCinthyaAún no hay calificaciones
- Informe Analítica #2 Hidrólisis de SalesDocumento10 páginasInforme Analítica #2 Hidrólisis de SalesDavid GarciaAún no hay calificaciones
- Taller 1 - Cifras Significativas y Cálculos Básicos - Agosto 2015Documento3 páginasTaller 1 - Cifras Significativas y Cálculos Básicos - Agosto 2015Pablo E Bravo SAún no hay calificaciones
- CeliaDocumento2 páginasCeliaLeanne MartinAún no hay calificaciones
- Problemas para ResolverDocumento2 páginasProblemas para ResolverFiorella Soto0% (1)
- Problemas Fase 1 Analisis 2 - 2022 UcsmDocumento17 páginasProblemas Fase 1 Analisis 2 - 2022 UcsmKevin Andre Cusi CahuataAún no hay calificaciones
- Practica #7 PH Soluciones Amortiguadoras Análisis FarmacéuticoDocumento3 páginasPractica #7 PH Soluciones Amortiguadoras Análisis Farmacéuticojuan layque layasaAún no hay calificaciones
- Analisis de Medicamentos Por Equilibrios RedoxDocumento7 páginasAnalisis de Medicamentos Por Equilibrios RedoxJavier HuertaAún no hay calificaciones
- Informe Análisis GravimetríaDocumento3 páginasInforme Análisis GravimetríaSamuel Gámez100% (1)
- Constante Producto de SolubilidadDocumento13 páginasConstante Producto de SolubilidadMesha RockefellerAún no hay calificaciones
- Taller No. 1 AnaliticaDocumento12 páginasTaller No. 1 AnaliticaRobin Angel Romero100% (2)
- Ejercicios de Gravimetría IDocumento4 páginasEjercicios de Gravimetría IJuan AguilarAún no hay calificaciones
- AnaliticaDocumento34 páginasAnaliticamipeneAún no hay calificaciones
- ExamenDocumento5 páginasExamenPAUL JHERSON CARCAHUSTO TUMBILLOAún no hay calificaciones
- Extracto EtereoDocumento2 páginasExtracto EtereoRaimundo BeltranAún no hay calificaciones
- 26436.ejercicio Del Cuestionario 8Documento3 páginas26436.ejercicio Del Cuestionario 8Camila Córdova LópezAún no hay calificaciones
- Resumen Equipo 1Documento6 páginasResumen Equipo 1Tano TGAún no hay calificaciones
- Curva de Calibración de Proteínas TotalesDocumento5 páginasCurva de Calibración de Proteínas TotalesCarlos VillarrealAún no hay calificaciones
- Análisis Volumétrico Marco TeoricoDocumento5 páginasAnálisis Volumétrico Marco TeoricoRossicela Vicente DueñasAún no hay calificaciones
- Informe de La PrácticaDocumento13 páginasInforme de La PrácticaAlejandra NuñezAún no hay calificaciones
- Práctica #7 POTENCIOMETRIA ACIDO-BASEDocumento5 páginasPráctica #7 POTENCIOMETRIA ACIDO-BASEEstefanía Angel ClavijoAún no hay calificaciones
- Informe 3Documento8 páginasInforme 3DavidAún no hay calificaciones
- Valoracion Acido AcetilsalicilicoDocumento3 páginasValoracion Acido AcetilsalicilicoEstefania JacoboAún no hay calificaciones
- Cuadro Sinóptico de La Química AnalíticaDocumento1 páginaCuadro Sinóptico de La Química AnalíticaLarissaOliveraAún no hay calificaciones
- Acidos y Bases DebilesDocumento4 páginasAcidos y Bases DebilesMax LlamaAún no hay calificaciones
- Práctica # 2 Química Analítica IDocumento2 páginasPráctica # 2 Química Analítica ITatiana OrtegaAún no hay calificaciones
- Pauta Taller 5Documento4 páginasPauta Taller 5JPYAAún no hay calificaciones
- Constante de BasicidadDocumento1 páginaConstante de BasicidadSamantha Gamarra DominguezAún no hay calificaciones
- Determinación de La Constante de Equilibrio para Una Reacción Homogénea.Documento3 páginasDeterminación de La Constante de Equilibrio para Una Reacción Homogénea.ALexAún no hay calificaciones
- Chusmita Practica 4Documento8 páginasChusmita Practica 4Anonymous 7NfXJMQCMgAún no hay calificaciones
- Caratula 7 CerealesDocumento1 páginaCaratula 7 CerealesAnonymous 7NfXJMQCMgAún no hay calificaciones
- WDocumento3 páginasWAnonymous 7NfXJMQCMg0% (1)
- Procedimientos de Pruebas de CarneDocumento2 páginasProcedimientos de Pruebas de CarneAnonymous 7NfXJMQCMgAún no hay calificaciones
- Saponina Hoy PDFDocumento207 páginasSaponina Hoy PDFAnonymous 7NfXJMQCMgAún no hay calificaciones
- Leche 1 - Caracteristicas de La Leche - UptDocumento22 páginasLeche 1 - Caracteristicas de La Leche - UptAnonymous 7NfXJMQCMgAún no hay calificaciones
- Refrigeracion Tabla de VerdurasDocumento4 páginasRefrigeracion Tabla de VerdurasAnonymous 7NfXJMQCMgAún no hay calificaciones