Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Determinación de constantes de acididad de H3PO4
Cargado por
Anonymous 28dbytTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Determinación de constantes de acididad de H3PO4
Cargado por
Anonymous 28dbytCopyright:
Formatos disponibles
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
TITULACION DE MEZCLA DE H3PO4 Y DETERMINACION DE K1, K2 Y K3
1. FUNDAMENTO TEORICO
Acidopoliprotico:En cualquier ácido poliprótico, la ionización primaria es más
completa que la segunda y ésta a su vez más completa que la tercera y así
sucesivamente.Para un ácido triprótico, por ejemplo, K1> K2> K3
AcidoFosfórico: El ácido fosfórico (H3PO4), además de formar parte de
numerosos compuestos orgánicos (ácidos nucleicos, fosfolípidos, azúcares, etc.)
también se encuentra en forma libre, aunque en pequeña proporción
El ácido fosfórico tiene tres protones disociables según las reacciones:
Cada forma, molecular o iónica actúa como ácida respecto a la que tiene a su
derecha y como básica respecto a la que tiene a su izquierda. Se pueden
establecer, por tanto, tres equilibrios de disociación, cada uno con una constante
característica a 25ºC (figura de la derecha):
1 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
K1= 5,7 x 10-3 (pK1= 2,2)K2= 6,2 x 10-8 (pK2= 7,2)K3=2,2 x 10-13 (pK3=12,7)
Titulación del H3PO4 con una base:
Al inicio la adición de iones OH no incrementa de manera significativa el valor
del PH de la solución, hasta que casi todo el HCl sea neutralizado y el H3PO4 ha
cambiado a H2PO4.
H3PO4 + +OH- =======
H2PO4- + H 2O
Cuando incrementa la adición de OH- considerablemente el PH de la solución se
tendrá el primer punto equivalente en la titulación. El primer punto equivalente
se alcanza cuando ha reaccionado toda la mezcla convirtiéndose en H2PO4-.
H2PO4 + +OH- =======
HPO42- + H2O
El H2PO4- se convierte en HPO42- ; si se continúa añadiendo iones OH- , donde
estos reaccionaran con un segundo ion hidrogeno.
HPO42+OH- =======
PO4-+ H2O
Hasta que esta conversión sea casi incompleta solo habrá un cambio pequeño
del PH de la solución, después de la adición de la base (solución buffer). Solo al
alcanzar el segundo punto equivalente el PH de la solución se modificara de una
manera considerable.
2 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
El 3er hidrogeno solo reacciona parcialmente con los iones OH- dando PO4-.
PH metro:Es un equipo capaz de medir el potencial de una solución equipados
con dos electrodos con los cuales se puede determinar la actividad del ion
hidrogeno de una solución. Estos electrodos son:
- Ventajas del PH metro:
Nos da la lectura del Ph directamente.
Lecturas constantes e inmediatas.
Electrodos pequeños para poder acomodar
directamente.
Fácilmente adaptable para el registro y control del proceso
2. MATERIALES Y EQUIPO
Materiales: Equipo:
Soporte Universal. - Un PH- metro
Bureta
- Electrodos
Pinzas para Bureta
Matraz
Una pipeta
Una pro pipeta
Una bureta
Un vaso de 150ml
Una piceta
barrita del agitador magnética
3. DATOS
Volumen añadido y pH
Para H3PO4 Para H3PO4 y KH2PO4 Para H3PO4 y HCl
Volumen (mL) Ph Volumen (mL) Ph Volumen (mL) Ph
0 1.9 0 2.38 0 1.6
1 1.92 1 2.42 1 1.6
2 1.99 2 2.5 2 1.61
3 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
3 2.08 3 2.62 3 1.63
4 2.19 4.3 2.96 4 1.66
5 2.34 5 3.46 5 1.68
5.5 2.43 5.5 4.6 6 1.71
6 2.54 6.3 5.73 7 1.74
6.5 2.69 7 6. 8 1.77
7 2.9 8 624 9 1.82
7.5 3.25 9 6.42 10 1.86
8 4.47 10 6.6 11 1.93
8.5 11.2 6.78 12 2
9 5.91 12 6.92 13 2.1
9.5 6.16 13 7.05 14 2.23
10 6.33 13.5 7.16 15 2.45
10.5 6.46 14 7.26 16 2.92
11 6.59 14.5 7.37 16.5 3.86
11.5 6.71 15 7.48 17 5.15
12 6.82 15.5 7.68 17.5 5.59
12.5 6.92 16 7.9 18 5.82
13 7.02 16.5 8.36 18.5 6.01
13.5 7.13 17 9.05 19 6.16
14 7.24 17.5 9.74 19.5 6.3
14.5 7.36 18 10.03 20 6.42
15 7.48 18.5 10.3 21 6.65
15.5 7.62 19 10.46 22 6.86
16 7.82 19.5 10.69 23 7.07
16.5 8.06 20 10.74 24 7.32
17 8.48 20.5 10.84 25 7.69
17.5 9.41 21 10.92 26 8.56
18 10.04 22 11.04 26.5 9.35
18.5 10.38 23 11.12 27 9.82
19 10.63 24 11.2 27.5 10.14
19.5 10.82 25 11.25 28 10.36
20 10.99 25.5 11.27 29 10.68
20.5 11.12 26 11.29 30 10.9
21 11.22 26.5 11.32 31 11.05
21.5 11.31 27 11.33 32 11.16
22 11.39 28.1 11.37 33 11.25
22.5 11.45 29 11.39 34 11.33
23 11.51 - - 35 11.39
23.5 11.56 - - 36 11.45
4 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
24 11.6 - - 37 11.49
24.5 11.65 - - 38 11.53
25 11.69 - - 39 11.57
25.5 11.72 - - 40 11.6
26 11.76 - - 41 11.63
26.5 11.78 - - 42 11.66
27 11.82 - - 43 11.68
- - - - 44 11.72
- - - - 45 11.74
- - - - 46 11.76
- - - - 47 11.78
- - - - 48 11.79
- - - - 49 11.81
- - - - 50 11.83
Primera derivada:
Para H3PO4 Para H3PO4 y KH2PO4 Para H3PO4 y HCl
ΔVolumen/2 Δ pH /ΔV ΔVolumen/2 Δ pH /ΔV ΔVolumen/2 Δ pH /ΔV
0,5 0,02 0,5 0,04 0,5 0
1,5 0,07 1,5 0,08 1,5 0,01
2,5 0,09 2,5 0,12 2,5 0,02
3,5 0,11 3,65 0,26 3,5 0,03
4,5 0,15 4,65 0,71 4,5 0,02
5,25 0,18 5,25 2,28 5,5 0,03
5,75 0,22 5,9 1,41 6,5 0,03
6,25 0,3 6,65 0,39 7,5 0,03
6,75 0,42 7,5 0,24 8,5 0,05
7,25 0,7 8,5 0,18 9,5 0,04
7,75 2,44 9,5 0,18 10,5 0,07
8,25 1,26 10,6 0,15 11,5 0,07
8,75 1,62 11,6 0,17 12,5 0,1
9,25 0,5 12,5 0,13 13,5 0,13
9,75 0,34 13,25 0,22 14,5 0,22
10,25 0,26 13,75 0,20 15,5 0,47
10,75 0,26 14,25 0,22 16,25 1,88
11,25 0,24 14,75 0,22 16,75 2,58
11,75 0,22 15,25 0,40 17,25 0,88
12,25 0,2 15,75 0,44 17,75 0,46
5 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
12,75 0,2 16,25 0,92 18,25 0,38
13,25 0,22 16,75 1,38 18,75 0,3
13,75 0,22 17,25 1,38 19,25 0,28
14,25 0,24 17,75 0,58 19,75 0,24
14,75 0,24 18,25 0,54 20,5 0,23
15,25 0,28 18,75 0,32 21,5 0,21
15,75 0,4 19,25 0,46 22,5 0,21
16,25 0,48 19,75 0,10 23,5 0,25
16,75 0,84 20,25 0,20 24,5 0,37
17,25 1,86 20,75 0,16 25,5 0,87
17,75 1,26 21,5 0,12 26,25 1,58
18,25 0,68 22,5 0,08 26,75 0,94
18,75 0,5 23,5 0,08 27,25 0,64
19,25 0,38 24,5 0,05 27,75 0,44
19,75 0,34 25,25 0,04 28,5 0,32
20,25 0,26 25,75 0,04 29,5 0,22
20,75 0,2 26,25 0,06 30,5 0,15
21,25 0,18 26,75 0,02 31,5 0,11
21,75 0,16 27,55 0,04 32,5 0,09
22,25 0,12 28,55 0,02 33,5 0,08
22,75 0,12 - - 34,5 0,06
23,25 0,1 - - 35,5 0,06
23,75 0,08 - - 36,5 0,04
24,25 0,1 - 37,5 0,04
24,75 0,08 - - 38,5 0,04
25,25 0,06 - - 39,5 0,03
25,75 0,08 - - 40,5 0,03
26,25 0,04 - - 41,5 0,03
26,75 0,08 - 42,5 0,02
- - - - 43,5 0,04
- - - - 44,5 0,02
- - - - 45,5 0,02
- - - - 46,5 0,02
- - - - 47,5 0,01
- - - - 48,5 0,02
- - - - 49,5 0,02
Datos para la estandarización del NaOH (0.1N):
6 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
Grupo 1 Masa de ftalato acido de potasio (0.3 ± 0.05) g
Volumen de NaOH (15.0 ± 0.05) mL
Grupo 2 Masa de ftalato acido de potasio (0.3 ± 0.05) g
Volumen de NaOH (14.6 ± 0.05) mL
Grupo 3 Masa de ftalato acido de potasio (0.31 ± 0.05) g
Volumen de NaOH (17.2 ± 0.05) mL
Masa Molecular de (Ftalato) 204.23 /mol
3.1 Procesamiento de datos
Estandarización del NaOH
TEST Q: A continuación realizaremos la Prueba Q, para descartar el posible dato
dudoso (volumen gastado de en la estandarización):
Q (90% de confianza) Número de observaciones
0.94 3
- Ordenando de menor a mayor los datos:
14.6 (𝑣𝑎𝑙𝑜𝑟 𝑚𝑒𝑛𝑜𝑟), 15, 17.2 (𝑣𝑎𝑙𝑜𝑟 𝑚𝑎𝑦𝑜𝑟)
- Hallando la 𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 para el menor valor:
15 − 14.6
𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 = = 0.15𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 < 𝑄𝑡𝑎𝑏𝑢𝑙𝑎𝑑𝑎
17.2 − 14.6
- Hallando la 𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 para el mayor valor:
17.2 − 15
𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 = = 0.84𝑄𝑐𝑎𝑙𝑐𝑢𝑙𝑎𝑑𝑎 < 𝑄𝑡𝑎𝑏𝑢𝑙𝑎𝑑𝑎
17.2 − 14.6
7 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- Finalmente se realiza la comparación:
Como los valores son menores al 𝑄𝑡𝑎𝑏𝑢𝑙𝑎𝑑𝑎 ningún valor se rechaza.
- Para la estandarización del NaOH usamos una cantidad de Ftalato ácido de
potasio cumpliéndose en el punto de equilibrio:
#𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑭𝒕𝒂𝒍𝒂𝒕𝒐 𝒅𝒆 𝑷𝒐𝒕𝒂𝒔𝒊𝒐 = # 𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑵𝒂𝑶𝑯
𝑾𝑭𝒕𝒂𝒍𝒂𝒕𝒐 (𝑾𝑭𝒕𝒂𝒍𝒂𝒕𝒐 )(𝜽𝑭𝒕𝒂𝒍𝒂𝒕𝒐 )
= (𝑵. 𝑽)𝑵𝒂𝑶𝑯 𝑵𝑵𝒂𝑶𝑯 =
𝑷. 𝑬𝑭𝒕𝒂𝒍𝒂𝒕𝒐 (𝑴𝑭𝒕𝒂𝒍𝒂𝒕𝒐 )(𝑽𝑵𝒂𝑶𝑯 )
(0.3𝑔)(1)
- Dónde: (Ftalato) = 1 𝑁𝑁𝑎𝑂𝐻 = (204.23)(14.6)𝑥10−3 = 0.101 𝑁
- Para los otros datos:
Grupo 1 0.098 N
Grupo 3 0.088 N
- Sacando un promedio entre los 3 resultados se tiene:𝑵𝒑𝒓𝒐𝒎𝒆𝒅𝒊𝒐 = 𝟎. 𝟎𝟗𝟔 𝑵
Para la determinación de K1 , K2 Y K3
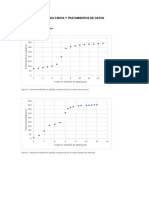
1. Solución de H3PO4 y KH2PO4: Grafica Volumen vs pH
8 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
12
10
8
pH
0
0 5 10 15 20 25 30 35
Volumen de NaOH (mL)
- Hallando los Volumenes experimentales en los punto de equilibrio para la
solución de H3PO4 titulada con NaOH usando el método de la primera
derivada se tiene:
2.50
2.00
1.50
Δ pH /ΔV
1.00
0.50
0.00
0 5 10 15 20 25 30
ΔVolumen/2
9 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- De las graficas se observan que los puntos de equilibrio están en los
siguientes volúmenes:
𝑉1 = 5.5 𝑚𝐿 𝑦 𝑉2 = 17 𝑚𝐿 ,
- Para poder determinar la [H3PO4] inicial empleamos los datos del primer
punto equivalente 1:
#𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑯𝟑𝑷𝑶𝟒 = # 𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑵𝒂𝑶𝑯
[𝑯𝟑 𝑷𝑶𝟒 ](𝑽𝑴𝟏 ) = [𝑵𝒂𝑶𝑯]. 𝑽𝑵𝒂𝑶𝑯
[𝑁𝑎𝑂𝐻]. 𝑉𝑁𝑎𝑂𝐻 (0.096𝑁) ∗ (5.5𝑚𝐿)
[𝐻3 𝑃𝑂4 ]𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = = = 0.053 𝑀
(𝑉𝑀1 ) 10𝑚𝐿
- La [H3PO4] que permanece en la solución luego que la reacción se ha producido
será la concentración inicial menos la concentración de ácido que ha
participado activamente en la reacción (vale decir aquella que ha reaccionado
con el volumen de NaOH añadido y que es además igual a la [H+]
[𝐻3𝑃𝑂4]𝑃𝑒𝑟𝑚𝑎𝑛𝑒𝑐𝑒 𝑒𝑛 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 = [𝐻3𝑃𝑂4]𝑖𝑛𝑖𝑐𝑖𝑎𝑙 − [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎
- Pero: [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 = [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 𝑐𝑜𝑛 𝑁𝑎𝑂𝐻 = [𝐻 + ]
- Si: Ph = 2.38 [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 = 10−2.38 = 4.169 ∗ 10−3 𝑀
[𝐻3𝑃𝑂4]𝑃𝑒𝑟𝑚𝑎𝑛𝑒𝑐𝑒 𝑒𝑛 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 = 0.053𝑀 − 4.169 ∗ 10−3 𝑀 = 0.049 𝑀
- Para calcular las constantes es necesario apoyarnos en las reacciones que se
van produciendo, es así que para determinar la primera constante tenemos,
que en el primer punto equivalente:
H3PO4 H2PO4- + H+
- Dónde: K1= [H2PO4-][ H+]/[H3PO4]
10 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- Así mismo, en el primer punto equivalente se cumple que: [H2PO4-] = [ H+]
- La constante de equilibro K1 será:
(4.169 ∗ 10−3 𝑀)(4.169 ∗ 10−3 𝑀)
𝐾1 = = 3.547 ∗ 10−4 𝑀
0.049 𝑀
𝑝(𝐾1) = 3.45
- Para poder determinar la concentración de NaH2PO4 ,el volumen empleado
de NaOH será igual a :(V2 -2V1)ml.
- Luego, en el punto de equivalencia 2 se tendrá que: (VM2= 10ml)
𝑬𝒒 − 𝒈 𝑲𝑯𝟐𝑷𝑶𝟒 = # 𝑬𝒒 − 𝒈 𝑵𝒂𝑶𝑯
[𝑲𝑯𝟐 𝑷𝑶𝟒 ](𝑽𝑴𝟐 ) = [𝑵𝒂𝑶𝑯]. [(𝑽𝟐 − 𝑽𝟏 ) − 𝑽𝟏]
- Reemplazando los valores tenemos:
[𝑁𝑎𝑂𝐻]. (𝑉2 − 2𝑉1 ) (0.096𝑁) ∗ (6 𝑚𝐿)
[𝐾𝐻2 𝑃𝑂4 ] = = = 0.058𝑀
(𝑉𝑀2 ) 10 𝑚𝐿
- La segunda reacción producida en el segundo punto equivalente es:
H2PO4- HPO4-2 + H+
- La constante de disociación será:K2= [HPO4-2][ H+]/[H2PO4-]
- Para poder determinar la segunda constante se hace uso del 2 punto
semiequivalente.En dicho punto se cumple que:[H2PO4-] = [HPO4-2]
- Finalmente, reemplazando tal afirmación en la ecuación; la segunda constante
quedará reducida a:K2= [ H+]
𝑉1+𝑉2
- Como el 2 punto semiequivalente está en 𝑉= = 11.25 ⟶ 𝐩𝐇 = 𝟔. 𝟖
2
11 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- Entonces:
𝑲𝟐 = 𝟏𝟎−𝟔.𝟖 = 𝟏. 𝟓𝟖𝟒 ∗ 𝟏𝟎−𝟕 𝑴 ⟶ 𝑝(𝐾2) = 6.8
2. Solución de H3PO4: Grafica Volumen vs pH
14
12
10
8
pH
0
0 5 10 15 20 25 30
Volumen añadido de NaOH (mL)
- Hallando los Volumenes experimentales en los punto de equilibrio para la
solución de H3PO4 titulada con NaOH usando el método de la primera
derivada se tiene:
3
2.5
2
ΔpH/ΔV
1.5
0.5
0
0 5 10 15 20 25 30
ΔVollumen /2
12 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- De las graficas se observan que los puntos de equilibrio están en los
siguientes volúmenes:𝑉1 = 8.5 𝑚𝐿 𝑦 𝑉2 = 17.5 𝑚𝐿 ,
- Para poder determinar la [H3PO4] inicial empleamos los datos del primer
punto equivalente 1:
#𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑯𝟑𝑷𝑶𝟒 = # 𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑵𝒂𝑶𝑯
[𝐻3 𝑃𝑂4 ](𝑉𝑀1 ) = [𝑁𝑎𝑂𝐻]. 𝑉𝑁𝑎𝑂𝐻
[𝑁𝑎𝑂𝐻]. 𝑉𝑁𝑎𝑂𝐻 (0.096𝑁) ∗ (8.5𝑚𝐿)
[𝐻3 𝑃𝑂4 ]𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = = = 0.082 𝑀
(𝑉𝑀1 ) 10𝑚𝐿
- La [H3PO4] que permanece en la solución luego que la reacción se ha producido
será la concentración inicial menos la concentración de ácido que ha
participado activamente en la reacción (vale decir aquella que ha reaccionado
con el volumen de NaOH añadido y que es además igual a la [H+]
[𝑯𝟑𝑷𝑶𝟒]𝑷𝒆𝒓𝒎𝒂𝒏𝒆𝒄𝒆 𝒆𝒏 𝒍𝒂 𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏 = [𝑯𝟑𝑷𝑶𝟒]𝒊𝒏𝒊𝒄𝒊𝒂𝒍 − [𝑯𝟑𝑷𝑶𝟒]𝒓𝒆𝒂𝒄𝒄𝒊𝒐𝒏𝒂
- Pero: [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 = [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 𝑐𝑜𝑛 𝑁𝑎𝑂𝐻 = [𝐻 + ]
- Si: Ph = 1.9 [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 = 10−1.9 = 0.013𝑀
[𝐻3𝑃𝑂4]𝑃𝑒𝑟𝑚𝑎𝑛𝑒𝑐𝑒 𝑒𝑛 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 = 0.082𝑀 − 0.013𝑀 = 0.069 𝑀
- Para calcular las constantes es necesario apoyarnos en las reacciones que se
van produciendo, es así que para determinar la primera constante tenemos,
que en el primer punto equivalente:
H3PO4 H2PO4- + H+
- Dónde: K1= [H2PO4-][ H+]/[H3PO4]
13 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- Así mismo, en el primer punto equivalente se cumple que: [H2PO4-] = [ H+]
- La constante de equilibro K1 será:
(0.013𝑀)(0.013𝑀)
𝐾1 = = 2.449 ∗ 10−3 𝑀
0.069 𝑀
- La segunda reacción producida en el segundo punto equivalente es:
H2PO4- HPO4-2 + H+
- La constante de disociación será:K2= [HPO4-2][ H+]/[H2PO4-]
- Para poder determinar la segunda constante se hace uso del 2 punto
semiequivalente.En dicho punto se cumple que: [H2PO4-] = [HPO4-2]
- Finalmente, reemplazando tal afirmación en la ecuación; la segunda constante
quedará reducida a:K2= [ H+]
𝑉1+𝑉2
- Como el 2 punto semiequivalenteesta en 𝑉 = = 13 𝑚𝐿 ⟶ 𝐩𝐇 = 𝟕. 𝟎𝟐
2
Entonces:
𝑲𝟐 = 𝟏𝟎−𝟕.𝟎𝟐 = 𝟗. 𝟓𝟓𝟎 ∗ 𝟏𝟎−𝟖 𝑴
3. Solución de H3PO4 y HCl: Grafica Volumen vs pH
14 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
14
12
10
8
pH
0
0 5 10 15 20 25 30 35 40 45 50 55
Volumen añadido de NaOH (mL
Usando el metodo de la primera derivada:
1.4
1.2
0.8
0.6
0.4
0.2
0
0 5 10 15 20 25 30 35 40 45 50
De la primera grafica hallamos los Volúmenes experimentales en el punto de
equilibrio para la solución de H3PO4 y HCl,titulada con NaOH usando el método
de la primera derivada :
V1= 16.5 ml con un pH1=3.86
15 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
V2= 26 ml con un pH2=8.56
Para poder determinar la [H3PO4] inicial debemos emplear los datos del primer
y segundo punto equivalente:
#𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑯𝟑𝑷𝑶𝟒 = # 𝑬𝒒𝒖𝒊𝒗𝒂𝒍𝒆𝒏𝒕𝒆 𝑵𝒂𝑶𝑯
[𝐻3 𝑃𝑂4 ](𝑉𝑀1 ) = [𝑁𝑎𝑂𝐻]. 𝑉𝑁𝑎𝑂𝐻
[𝐻3 𝑃𝑂4 ](𝑉𝑀1 ) = [𝑁𝑎𝑂𝐻]. (𝑉2 − 𝑉1)𝑁𝑎𝑂𝐻
[0.096].(26−16.5)𝑚𝑙𝑁𝑎𝑂𝐻
[𝐻3 𝑃𝑂4 ]𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = (10𝑚𝑙)
= 0.091M
Calculo de K1 del H3PO4:
Para calcular las constantes es necesario ayudarnos de las reacciones que se van
produciendo, es así que para determinar la primera constante tenemos, que en
el primer punto equivalente:
H3PO4 H2PO4- + H+
Dónde: K1= [H2PO4-][ H+]/[H3PO4]
Así mismo, sabemos que en el primer punto equivalente se deberá cumplir:
[H2PO4-] = [ H+]
También, la [H3PO4] que queda en la solución luego que la reacción se ha
producido será la concentración inicial menos la concentración de ácido que ha
participado activamente en la reacción es decir, aquella que ha reaccionado con
el volumen de NaOH añadido y igual a la [H+].
[𝐇𝟑𝐏𝐎𝟒]𝐏𝐞𝐫𝐦𝐚𝐧𝐞𝐜𝐞 𝐞𝐧 𝐥𝐚 𝐬𝐨𝐥𝐮𝐜𝐢ó𝐧 = [𝐇𝟑𝐏𝐎𝟒]𝐢𝐧𝐢𝐜𝐢𝐚𝐥 − [𝐇𝟑𝐏𝐎𝟒]𝐫𝐞𝐚𝐜𝐜𝐢𝐨𝐧𝐚
[𝐇𝟑𝐏𝐎𝟒]𝐫𝐞𝐚𝐜𝐜𝐢𝐨𝐧𝐚 = [𝐇 + ]
16 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
Hallando la [H+]
Si: pH = 1.6 [𝐻3𝑃𝑂4]𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛𝑎 = [𝐻 + ] = 10−1.6 = 0.025𝑀
Luego calculamos la concetracion de HClinical:
[𝐻𝐶𝑙](𝑉𝑀1 ) = [𝑁𝑎𝑂𝐻]. (2𝑉1 − 𝑉2)𝑁𝑎𝑂𝐻
[0.096]. (7𝑚𝑙)𝑁𝑎𝑂𝐻
[𝐻𝐶𝑙] = = 0.067𝑀
(10𝑚𝑙)
[𝑯𝟑𝑷𝑶𝟒]𝑷𝒆𝒓𝒎𝒂𝒏𝒆𝒄𝒆 𝒆𝒏 𝒍𝒂 𝒔𝒐𝒍𝒖𝒄𝒊ó𝒏 = 𝟎. 𝟎𝟗𝟏𝑴 − 𝟎. 𝟎𝟐𝟓𝑴 = 𝟎. 𝟎𝟔𝟔M
Entonces la primera contante será:
[𝐻2 𝑃𝑂4 − ][𝐻 + ] 𝟎.𝟎𝟐𝟓∗𝟎.𝟎𝟐𝟓
𝐾1 = = = 9.470x10-3
[𝐻3 𝑃𝑂4 ] 𝟎.𝟎𝟔𝟔
Luego para el cálculo de la segunda constante:K2
La segunda reacción producida en el segundo punto equivalente es:
H2PO4- HPO4-2 + H+
La constante de disociación será:
K2= [HPO4-2][ H+]/[H2PO4-]
Se sabe que en dicho punto se debe cumplir que: [H2PO4-] = [HPO4-2]
Entonces la segunda constante de equilibrio estará dada solo por la
concentración de hidrógenos:
K2= [ H+]
17 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
Hallando la [H+]:
El segundo punto semiequivalente está determinado por V = (V1+V2) / 2 y un
pH que se obtiene de la gráfica:
si pH= 6.76 entonces [𝐻 + ] = 10−6.76 = 𝟏. 𝟕𝟑𝟖 ∗ 𝟏𝟎−𝟕 𝑴
entonces:
K2= 𝟏. 𝟕𝟑𝟖 ∗ 𝟏𝟎−𝟕 𝑴
4. ANALISIS Y DISCUSIÓN DE RESULTADOS
- Con nuestros datos obtenidos para la estandarización se obtuvo el valor de
la concentración de NaOH igual a 0.101, pues resulto muy aproximado al
valor rotulado de O.1N.
- Para la calibración del PH metro se usó las soluciones buffer de tartrato
acido de potasio cuyas PH rotulados son de 4,01 ± 0.01 y de 7.00 ± 0.02,
obteniendo en nuestra lectura los valores de 4 y 7 respectivamente, con
esto podemos cas asegurar que el equipo esta calibrado.
¿En cuánto difieren los pk1 y pk2 de la solución trabajada en nuestra
experiencia (H3PO4 Y K2HPO4)?
valor teórico Valores
experimental
Pk1 2.2 3.45
Pk2 7.2 6.8
El primer valor difiere mucho respecto al valor teórico, pues podemos decir
que hubo un mal manejo en las mediciones del PH y de los volúmenes medidos.
- La concentraciones inícialesH3PO4 Y K2HPO4 halladas mediante nuestros
cálculos son de 0.053 y 0.058 respectivamente.
18 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- Para el cálculo del valor de K2, puesto que en el segundo punto equivalente
[H2PO4-] = [HPO4-2], entonces se deduce que el K2 solo dependerá de la
concentración de H+ , K2 =[ H+].
5. OBSERVACIONES
- Para la estandarización del NaOH usamos la solución de ftalato acido de
potasio y como indicador la fenolftaleína.
- Se estandarizo el PH metro con dos soluciones buffer de tartrato acido de
potásico; cuyas lecturas leídas fueron de PH igual a 4 y 7.
- El potenciómetro que se usó para hallar el PH de la solución a pesar de estar
calibrado, el dato de salida de PH tenía una variación, pero el rangode esta
variación era mínimo; notamos que nos proporcionaban los datos
inmediatamente.
6. CONCLUSIONES
- Una vez más comprobamos la importancia del ftalato ácido de potasio (KHP)
para estandarizarbases de Brønsted y en particular al hidróxido de sodio.
- Se comprobó las ventajas que nos ofrece el PH metro, como de
proporcionarnos directamente el PH, dándonos lecturas constantes e
inmediatas.
- En nuestro caso (mezcla de H3PO4 Y K2HPO4) se pudo hallar las constante
de K1 y K2; pues la solución buffer tiene efecto después de alcanzar el
primer punto equivalente.
7. APLICACIONES
APLICACIONES DEL ACIDO FOSFORICO:
- El ácido fosfórico es usado como regulador de pH en diferentes industrias,
como levaduras, cervezas, aceites y bebidas refrescantes.
- El ácido fosfórico técnico interviene en los tratamientos de fosfatado de
metales, siendo la industria automovilística su primer consumidor, y
asimismo, se emplea en los baños para el abrillantado del aluminio.
19 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
TITULACION DE MEZCLAS DE H3PO4 Y DETERMINACION DE K1, K2 Y 2012-I
K3
- El ácido fosfórico se utiliza para el blanqueo del caolín, mediante la
reducción y posterior eliminación de los iones férricos presentes en el
mineral.
- El ácido fosfórico se utiliza en la preparación de abonos y en el riego por
goteo. Es, además, el punto de partida para la obtención de fosfato
monoamónico, usado en fertirrigación y en abonos foliares.
8. REFERENCIAS BIBLIOGRAFICAS:
- Schenk, G.; Química Analítica Cuantitativa; Ed. CECSA. México 1984.
págs: 420-424
- http://www.quiminet.com/articulos/aplicaciones-del-acido-fosforico-
8718.htm
- Recursosbiblioteca.utp.edu.co/tesisdigitales/texto/54308H565.pdf
20 LABORATORIO DE ANALISIS QUIMICO CUANTITATIVO
También podría gustarte
- Titulacion de H3PO4 FinalDocumento20 páginasTitulacion de H3PO4 FinalVictor ManuelAún no hay calificaciones
- Calculos y Resultados Valoracion PotenciometricaDocumento15 páginasCalculos y Resultados Valoracion PotenciometricaAnonymous 28dbytAún no hay calificaciones
- Determinacion Potenciométrica Del Porcentaje de Carbonato de SodioDocumento4 páginasDeterminacion Potenciométrica Del Porcentaje de Carbonato de SodioNyraida ValleAún no hay calificaciones
- Curva de Titulación de La GlicinaDocumento7 páginasCurva de Titulación de La GlicinaFabiana OrdoñezAún no hay calificaciones
- Acidez y Complejos TerminadoiDocumento11 páginasAcidez y Complejos TerminadoiGustavo BalarezoAún no hay calificaciones
- Reporte 6 - Grupo 4Documento8 páginasReporte 6 - Grupo 4HESLER ADRIÁN GODOY CRUZAún no hay calificaciones
- AnaliticaaDocumento8 páginasAnaliticaaANAAún no hay calificaciones
- Titulacion de Mezclas de H3po4 y Determinacion de k1 k2 k3Documento19 páginasTitulacion de Mezclas de H3po4 y Determinacion de k1 k2 k3VICTOR ENRIQUE QUISPE SAMANEZAún no hay calificaciones
- Determinacion Del Acido FosforicoDocumento18 páginasDeterminacion Del Acido FosforicoChristopher JacksonAún no hay calificaciones
- Valoraciones PotenciometricasDocumento8 páginasValoraciones PotenciometricasAndres Felipe Franco HerreraAún no hay calificaciones
- Informe de Bioquímica #2Documento6 páginasInforme de Bioquímica #2Jennifer CordobaAún no hay calificaciones
- Laboratorio 4 Química AnalíticaDocumento13 páginasLaboratorio 4 Química Analíticagiovanni chinchillaAún no hay calificaciones
- Determinación de carbonato y bicarbonato mediante potenciometría ácido-baseDocumento9 páginasDeterminación de carbonato y bicarbonato mediante potenciometría ácido-baseLuisa GonzalezAún no hay calificaciones
- Titulación Potenciométrica de La CocacolaDocumento22 páginasTitulación Potenciométrica de La CocacolaRoberto Diaz100% (13)
- Práctica 3 Balance de Materia Con Reacción Química Hidratación de Anhídrido AcéticoDocumento15 páginasPráctica 3 Balance de Materia Con Reacción Química Hidratación de Anhídrido AcéticoLuis Miranda GonzalezAún no hay calificaciones
- Práctica #2Documento2 páginasPráctica #2RENATO JAIR COSTA MINGAAún no hay calificaciones
- Análisis de valoraciones ácido-base conductimétricas y potenciométricasDocumento21 páginasAnálisis de valoraciones ácido-base conductimétricas y potenciométricasGabrielaAún no hay calificaciones
- Reporte 2-Bioquimica-RevisadoDocumento7 páginasReporte 2-Bioquimica-RevisadoKatherine Suazo PazAún no hay calificaciones
- Práctica 3. Solución AmortiguadoraDocumento3 páginasPráctica 3. Solución AmortiguadoraJose Ramon Sanjuan TrejoAún no hay calificaciones
- Proyecto 1 Analitica 2 1Documento12 páginasProyecto 1 Analitica 2 1Oscar Andrade AvilaAún no hay calificaciones
- H 5-PrecipitaciónDocumento31 páginasH 5-Precipitacióncesar augusto torres gonzalesAún no hay calificaciones
- Analisis de Un Acido PoliproticoDocumento5 páginasAnalisis de Un Acido PoliproticoDavid Santiago SarchiAún no hay calificaciones
- Constate de AcidezDocumento13 páginasConstate de AcidezAli SmoakAún no hay calificaciones
- Práctica #01Documento4 páginasPráctica #01RENATO JAIR COSTA MINGAAún no hay calificaciones
- Práctica 7 Química AnalíticaDocumento12 páginasPráctica 7 Química AnalíticaFrancisco LazoAún no hay calificaciones
- Revisar Informe AnaliticaDocumento14 páginasRevisar Informe AnaliticaJose Daniel100% (1)
- Informe - Conductimetr ADocumento9 páginasInforme - Conductimetr ADiana JimenezAún no hay calificaciones
- Practica 9Documento7 páginasPractica 9belen rosasAún no hay calificaciones
- Bioquimica LabDocumento14 páginasBioquimica LabNorelkys MaldonadoAún no hay calificaciones
- Informe 9 AnaliticaDocumento14 páginasInforme 9 AnaliticaAnthonyAún no hay calificaciones
- Valoración Ácido Base H3PO4Documento3 páginasValoración Ácido Base H3PO4Osvaldo Almonaci CuevasAún no hay calificaciones
- Valoraciones 1Documento13 páginasValoraciones 1Zyanya TapiaAún no hay calificaciones
- Practica 3 Curvas de Congelacion PreDocumento11 páginasPractica 3 Curvas de Congelacion PreAntonio Martinez RamirezAún no hay calificaciones
- Determinación potenciométrica de H3PO4 y mezcla H3PO4-HClDocumento14 páginasDeterminación potenciométrica de H3PO4 y mezcla H3PO4-HClGabriel PalmaAún no hay calificaciones
- Informe 1 PotenciometríaDocumento14 páginasInforme 1 PotenciometríaprissAún no hay calificaciones
- OxigenacionDocumento11 páginasOxigenacionGuido PalazzoAún no hay calificaciones
- PH TeóricoDocumento2 páginasPH TeóricoViriAún no hay calificaciones
- Práctica 4 PDFDocumento22 páginasPráctica 4 PDFTatiana Pila FonsecaAún no hay calificaciones
- Informe Alcalinidad y DurezaDocumento13 páginasInforme Alcalinidad y DurezaAna Calabria0% (1)
- Practica 9Documento9 páginasPractica 9Gustavo CeratiAún no hay calificaciones
- Copia de Practica 10 EycDocumento12 páginasCopia de Practica 10 EycleticiaAún no hay calificaciones
- Diagrma Del Alumino y El AñejadoDocumento32 páginasDiagrma Del Alumino y El AñejadoHeidyJoenyRiveraRetamozoAún no hay calificaciones
- ObtenerArchivoActividadTareaDocumento14 páginasObtenerArchivoActividadTareaGabriela del Carmen Díaz SolísAún no hay calificaciones
- Relación entre volumen de NaOH y pH en titulación de H2PO4Documento1 páginaRelación entre volumen de NaOH y pH en titulación de H2PO4jairo guerreroAún no hay calificaciones
- Lab.2-Propiedades Iónicas de Un AminoácidoDocumento11 páginasLab.2-Propiedades Iónicas de Un AminoácidoKarolina Janeth RojasAún no hay calificaciones
- Tabla Fisiquimica TAREADocumento2 páginasTabla Fisiquimica TAREACesar Sánchez rodriguezAún no hay calificaciones
- Lab 5 Transistor Electronica Basica IDocumento12 páginasLab 5 Transistor Electronica Basica IDavid Ajhuacho IncaAún no hay calificaciones
- Practica 03Documento4 páginasPractica 03DAHANA CAROLINA VARGAS AGROTAAún no hay calificaciones
- Info-9-Fisico MARCO TEORICODocumento7 páginasInfo-9-Fisico MARCO TEORICOBryan LópezAún no hay calificaciones
- Informe Lab 5Documento16 páginasInforme Lab 5Daniel Hernandez PeñaAún no hay calificaciones
- Análisis de un ácido poliprótico mediante titulación pehachimétricaDocumento5 páginasAnálisis de un ácido poliprótico mediante titulación pehachimétricaSara Patiño GarciaAún no hay calificaciones
- Practica.5 FisicoQuimicaDocumento8 páginasPractica.5 FisicoQuimicaMonse BlanquelAún no hay calificaciones
- Determinación cuantitativa de ácido bórico en producto oftálmicoDocumento9 páginasDeterminación cuantitativa de ácido bórico en producto oftálmicoJorge KasiqAún no hay calificaciones
- Tabla de Datos Lab Instrumental 1Documento26 páginasTabla de Datos Lab Instrumental 1Alejandro QuilcaAún no hay calificaciones
- Guia de Ejercicios Titulacion Conductimetrica CalculosDocumento4 páginasGuia de Ejercicios Titulacion Conductimetrica CalculosNICOLAS ANDRES RUBILAR CASTILLOAún no hay calificaciones
- Determinación de constantes de acididad de H3PO4Documento18 páginasDeterminación de constantes de acididad de H3PO4Jose FernandezAún no hay calificaciones
- I Examen Op1Documento15 páginasI Examen Op1alextito_10_10Aún no hay calificaciones
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Suministro, Distribución y Evacuación Interior de Agua SanitariaDe EverandSuministro, Distribución y Evacuación Interior de Agua SanitariaAún no hay calificaciones
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Preparacion Del Anarajando II Falta Rendimiento DudaDocumento5 páginasPreparacion Del Anarajando II Falta Rendimiento DudaAnonymous 28dbytAún no hay calificaciones
- Experimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasDocumento7 páginasExperimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasAnonymous 28dbytAún no hay calificaciones
- Aea 123 FinishDocumento8 páginasAea 123 FinishAnonymous 28dbytAún no hay calificaciones
- Aplicación Industrial y RecomendacionesDocumento3 páginasAplicación Industrial y RecomendacionesAnonymous 28dbytAún no hay calificaciones
- Informe de Aldehidos y Cetonas II Terminado FinishDocumento19 páginasInforme de Aldehidos y Cetonas II Terminado FinishAnonymous 28dbytAún no hay calificaciones
- Preparacion Del Anarajando II AvanzandoDocumento4 páginasPreparacion Del Anarajando II AvanzandoAnonymous 28dbytAún no hay calificaciones
- Diagramas de Flujo Orga.2.Informe.3 Avanzando 3Documento7 páginasDiagramas de Flujo Orga.2.Informe.3 Avanzando 3Anonymous 28dbytAún no hay calificaciones
- Acido CitricoDocumento4 páginasAcido CitricoAnonymous 28dbytAún no hay calificaciones
- DIAGRAMA DE FLUJO Y Discusion de Resultados Jabon FinishDocumento5 páginasDIAGRAMA DE FLUJO Y Discusion de Resultados Jabon FinishAnonymous 28dbytAún no hay calificaciones
- Discusion de Resultados Jabon FinishDocumento4 páginasDiscusion de Resultados Jabon FinishAnonymous 28dbytAún no hay calificaciones
- Informe Determiancion de Hierro Por Dicromatometria TERMINADODocumento16 páginasInforme Determiancion de Hierro Por Dicromatometria TERMINADOAnonymous 28dbyt100% (1)
- Laboratorio de Aldehidos y Cetonas TerminadoDocumento20 páginasLaboratorio de Aldehidos y Cetonas TerminadoAnonymous 28dbytAún no hay calificaciones
- Laboratorio de Aldehidos y Cetonas TerminadoDocumento20 páginasLaboratorio de Aldehidos y Cetonas TerminadoAnonymous 28dbytAún no hay calificaciones
- Discusion de Resultados Jabon FinishDocumento4 páginasDiscusion de Resultados Jabon FinishAnonymous 28dbytAún no hay calificaciones
- Determinación de La Dureza Del AguaDocumento9 páginasDeterminación de La Dureza Del AguaAnonymous 28dbytAún no hay calificaciones
- Determinacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaDocumento6 páginasDeterminacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaAnonymous 28dbytAún no hay calificaciones
- Experimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasDocumento7 páginasExperimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasAnonymous 28dbytAún no hay calificaciones
- Labo 5Documento11 páginasLabo 5Anonymous 28dbytAún no hay calificaciones
- Calculos de Resultados Del Informe de HalurosDocumento6 páginasCalculos de Resultados Del Informe de HalurosAnonymous 28dbytAún no hay calificaciones
- Determinacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaDocumento6 páginasDeterminacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaAnonymous 28dbytAún no hay calificaciones
- Espectroscopia IR y UV de compuestos químicosDocumento10 páginasEspectroscopia IR y UV de compuestos químicosAnonymous 28dbytAún no hay calificaciones
- Laboratorio Organica II Final 2.0Documento13 páginasLaboratorio Organica II Final 2.0Anonymous 28dbytAún no hay calificaciones
- Calculos de Resultados Del Informe de HalurosDocumento6 páginasCalculos de Resultados Del Informe de HalurosAnonymous 28dbytAún no hay calificaciones
- Cálculos y ResultadosDocumento5 páginasCálculos y ResultadosAnonymous 28dbytAún no hay calificaciones
- Informe 3 de Analisis Quimico Terminado FINISH FinishDocumento15 páginasInforme 3 de Analisis Quimico Terminado FINISH FinishAnonymous 28dbytAún no hay calificaciones
- Labo 5Documento11 páginasLabo 5Anonymous 28dbytAún no hay calificaciones
- Informe 3 de Analisis Quimico Terminado FINISH FinishDocumento15 páginasInforme 3 de Analisis Quimico Terminado FINISH FinishAnonymous 28dbytAún no hay calificaciones
- RESULTADOS Y TRATAMIENTOS de DATOS y Discusion Terminado Que Corriga Enoc Sus CalculosDocumento6 páginasRESULTADOS Y TRATAMIENTOS de DATOS y Discusion Terminado Que Corriga Enoc Sus CalculosAnonymous 28dbytAún no hay calificaciones
- Temario CBDocumento12 páginasTemario CBAlfredo PonceAún no hay calificaciones
- DEFINICION DE PK, PH PDFDocumento15 páginasDEFINICION DE PK, PH PDFAladino AbbasAún no hay calificaciones
- TERMODINAMICADocumento94 páginasTERMODINAMICAarchivaldoAún no hay calificaciones
- ELECTROMETALURGIADocumento12 páginasELECTROMETALURGIA943164795Aún no hay calificaciones
- Semana 03 IIDocumento17 páginasSemana 03 IIYsaias PMAún no hay calificaciones
- Diagramas de EllinghamDocumento27 páginasDiagramas de EllinghambeburicoteritoAún no hay calificaciones
- Practica 4 Equilibrio QuimicoDocumento6 páginasPractica 4 Equilibrio QuimicoDanny RiveraAún no hay calificaciones
- 04 AzufreDocumento91 páginas04 AzufrePercy Villanueva RodriguezAún no hay calificaciones
- Tema 4Documento52 páginasTema 4Willmer AcostaAún no hay calificaciones
- Ets Teq 2022-1Documento2 páginasEts Teq 2022-1Erwin Joel Artigas LópezAún no hay calificaciones
- Efectos de los asfaltenos en la producción de petróleoDocumento17 páginasEfectos de los asfaltenos en la producción de petróleoLouse InnobaAún no hay calificaciones
- AVANZE 5 CarbonatacionDocumento19 páginasAVANZE 5 CarbonatacionYaritza Romero100% (1)
- Silabo Quimica Analitica - Ing - Sanitaria 2019 - IiDocumento5 páginasSilabo Quimica Analitica - Ing - Sanitaria 2019 - IiEsparraga Arevalo DiegoAún no hay calificaciones
- Equilibrio Quimico, Articulo CientificoDocumento4 páginasEquilibrio Quimico, Articulo CientificoErick BenavidesAún no hay calificaciones
- "Titulación Ácido-Base y Medida de pH"-7Documento13 páginas"Titulación Ácido-Base y Medida de pH"-7Jhon MármolAún no hay calificaciones
- Quimica Problemas y CuestionesDocumento37 páginasQuimica Problemas y CuestionesnicotroncosoarriagadaAún no hay calificaciones
- Cap IiDocumento31 páginasCap IiJosefina MarinelliAún no hay calificaciones
- Seminario Equilibrio Acido Base y Buffer - 2018Documento3 páginasSeminario Equilibrio Acido Base y Buffer - 2018fluter26Aún no hay calificaciones
- FLOTACIÓNDocumento50 páginasFLOTACIÓNEdwin Galvez TorresAún no hay calificaciones
- Consideraciones Cientificas de Polimorfos en ANDAS (1) .En - EsDocumento6 páginasConsideraciones Cientificas de Polimorfos en ANDAS (1) .En - EsemilyAún no hay calificaciones
- 1 Operaciones Con Transferencia de MasaDocumento15 páginas1 Operaciones Con Transferencia de MasaGIANCARLOAún no hay calificaciones
- Energía Libre de GibbsDocumento5 páginasEnergía Libre de GibbsGiovanni SalvadorAún no hay calificaciones
- TERMOQUIMICA PresentacionDocumento76 páginasTERMOQUIMICA Presentaciondavid morocho100% (1)
- Análisis GravimétricoDocumento30 páginasAnálisis GravimétricoErick Omar Hernandez ValenciaAún no hay calificaciones
- Termodinámica de Sistemas Heterogeneos (E)Documento12 páginasTermodinámica de Sistemas Heterogeneos (E)Oliver Ch CAún no hay calificaciones
- Ejercicios Sobre Equilibrio Quimico. PrimeraDocumento3 páginasEjercicios Sobre Equilibrio Quimico. Primeragjra1982100% (1)
- Cuestionario de Autoevaluación Práctico Del TPN°5 - Equilibrio Químico. (Cierra 18 - 08)Documento14 páginasCuestionario de Autoevaluación Práctico Del TPN°5 - Equilibrio Químico. (Cierra 18 - 08)p.c.106578Aún no hay calificaciones
- Post5 Termo2Documento8 páginasPost5 Termo2Valeria AlpucheAún no hay calificaciones
- Quimica AnaliticaDocumento18 páginasQuimica AnaliticaCamilo Pérez100% (1)
- Lab ROF-5Documento8 páginasLab ROF-5Liliana CalixtoAún no hay calificaciones