Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Universidad de Carabobo4
Universidad de Carabobo4
Cargado por
cra29Copyright:
Formatos disponibles
También podría gustarte
- Informe Practico: Microscopia de Los Aceros Al Carbono Enfriados LentamenteDocumento16 páginasInforme Practico: Microscopia de Los Aceros Al Carbono Enfriados LentamenteJuan Vicente Díaz100% (1)
- Ejercicios de DIFUSIÓN Guia 1Documento5 páginasEjercicios de DIFUSIÓN Guia 1Cinthya Peña RoqueAún no hay calificaciones
- 08 Practica - Secuencia de Operaciones-1Documento3 páginas08 Practica - Secuencia de Operaciones-1Jaime Alfonso Gonzalez Vivas50% (2)
- Ensayo de TempleDocumento10 páginasEnsayo de TempleRigoberto SánchezAún no hay calificaciones
- Medios para Evitar RechupesDocumento73 páginasMedios para Evitar RechupesgeoswaldAún no hay calificaciones
- Diagrama de Fases IsomorfosDocumento29 páginasDiagrama de Fases IsomorfosEMILIANO MAXIMO FUENTES ORTIZ100% (1)
- Informe Práctica 9 y 10. Tratamientos Térmicos y Templabilidad.Documento11 páginasInforme Práctica 9 y 10. Tratamientos Térmicos y Templabilidad.YuengHong100% (2)
- Fundiciones FerrosasDocumento9 páginasFundiciones FerrosasJoan CedeñoAún no hay calificaciones
- Informe #11 RecristalizacionDocumento12 páginasInforme #11 RecristalizacionGenrryLeonAún no hay calificaciones
- Informe 10 Lab de Materiales TemplabilidadDocumento6 páginasInforme 10 Lab de Materiales TemplabilidadAlexander Sanchez100% (1)
- Diagrama de FasesDocumento26 páginasDiagrama de FasesKevin YamunaqueAún no hay calificaciones
- Metalurgia Física Preguntas ExamenDocumento2 páginasMetalurgia Física Preguntas ExamenJuan Diego Falcon ChuraAún no hay calificaciones
- 2 Preparación de Probetas MetalográficasDocumento3 páginas2 Preparación de Probetas MetalográficasAbigail CovaAún no hay calificaciones
- 4 Unidad. EstequiometriaDocumento3 páginas4 Unidad. EstequiometriaFernanda FloresAún no hay calificaciones
- P5 TT. Diagrama CCTDocumento3 páginasP5 TT. Diagrama CCTCande Flores100% (1)
- Laboratorio Inclusiones 2Documento5 páginasLaboratorio Inclusiones 2Juan VillacisAún no hay calificaciones
- Informe Normalizado y RecocidoDocumento17 páginasInforme Normalizado y RecocidoChristian Puza100% (1)
- Catalizador, Tipo y Usos en La Fundicion y SiderurgiaDocumento5 páginasCatalizador, Tipo y Usos en La Fundicion y SiderurgiaBill C. Mercado Gamboa0% (1)
- Calculo de MazarotaDocumento4 páginasCalculo de MazarotaAnonymous wljFU7ri0% (1)
- Examen Parcial Fundicion 2020Documento3 páginasExamen Parcial Fundicion 2020Juan Diego Falcon Chura0% (1)
- Informe 1 Fundicion GrisDocumento10 páginasInforme 1 Fundicion GrisDennis Martinez LoaizaAún no hay calificaciones
- Ejercicios Resueltos Diagrama de Fases IES ValdehierroDocumento21 páginasEjercicios Resueltos Diagrama de Fases IES ValdehierroAnaAún no hay calificaciones
- Informe de Ensayo de CompresiónDocumento14 páginasInforme de Ensayo de CompresiónJarol Carrion SalvatierraAún no hay calificaciones
- Guia de Laboratorio de Metalografia I 2021Documento14 páginasGuia de Laboratorio de Metalografia I 2021Sergio RicardoAún no hay calificaciones
- Ataque QuimicoDocumento7 páginasAtaque QuimicoJuan Carlos BernalAún no hay calificaciones
- Practica Desbaste PDFDocumento6 páginasPractica Desbaste PDFPaola GonzalezAún no hay calificaciones
- Determinación de La Densidad de Dislocaciones A Partir Del Patrón de Difracción de Rayos XDocumento10 páginasDeterminación de La Densidad de Dislocaciones A Partir Del Patrón de Difracción de Rayos XAlejandro usma ladinoAún no hay calificaciones
- Guia Fenomenos #3-FUERZAS SOBRE SUPERFICIES PLANASDocumento9 páginasGuia Fenomenos #3-FUERZAS SOBRE SUPERFICIES PLANASYinethAún no hay calificaciones
- RevenidoDocumento3 páginasRevenidoedymiranda93Aún no hay calificaciones
- Recristalización y Recocido de BronceDocumento11 páginasRecristalización y Recocido de BronceGracielaGramyQHAún no hay calificaciones
- Primer Exanen Conformado de Metales 2013 - 2Documento9 páginasPrimer Exanen Conformado de Metales 2013 - 2Micky UltAún no hay calificaciones
- 4 Ataque QuimicoDocumento13 páginas4 Ataque QuimicoPABLO DIAZ ENRIQUEZAún no hay calificaciones
- Practica4 Corrosion Proceso EspontaneoDocumento12 páginasPractica4 Corrosion Proceso EspontaneoDiego Villanueva0% (1)
- Respuestas de Guia 4 FinalDocumento9 páginasRespuestas de Guia 4 FinalGregory GoncalvezAún no hay calificaciones
- Primer Examen de Transformación de Fases 2021-A Tema A (Autoguardado)Documento6 páginasPrimer Examen de Transformación de Fases 2021-A Tema A (Autoguardado)BLADIMIR CHARCA MERMAAún no hay calificaciones
- TermoDocumento1 páginaTermolexdaniloAún no hay calificaciones
- Clase 6Documento14 páginasClase 6Ale Calixto HermosillaAún no hay calificaciones
- Normalizado, Recocido y Relevado de EsfuerzosDocumento30 páginasNormalizado, Recocido y Relevado de EsfuerzosMIGUEL ANGEL SAMANO MORENOAún no hay calificaciones
- Informe de Metalografia Diego Tirado 2120369Documento11 páginasInforme de Metalografia Diego Tirado 2120369Anderson JuradoAún no hay calificaciones
- Introducción A La Siderurgia 2016Documento30 páginasIntroducción A La Siderurgia 2016Sebastian Andres MuñozAún no hay calificaciones
- Practica 2 Comportamiento MecánicoDocumento7 páginasPractica 2 Comportamiento MecánicoJose Antonio MartinezAún no hay calificaciones
- Informe de Laboratorio N°5-Ensayo de Tratameintos Termicos Del Acero-UnifimDocumento21 páginasInforme de Laboratorio N°5-Ensayo de Tratameintos Termicos Del Acero-UnifimJCarlos GutierrezAún no hay calificaciones
- CLASE SEMANA #02 Balance Chancado SoluciónDocumento21 páginasCLASE SEMANA #02 Balance Chancado SoluciónIsmael ValladolidAún no hay calificaciones
- Monografia de Tratamientos Termico Del AceroDocumento33 páginasMonografia de Tratamientos Termico Del AceroJonatanGalvanRojasAún no hay calificaciones
- Practica Ensayo JominyDocumento23 páginasPractica Ensayo JominyJose Jonas Alfaro0% (1)
- Informe Practico: Analisis MacroscopicoDocumento13 páginasInforme Practico: Analisis MacroscopicoJuan Vicente DíazAún no hay calificaciones
- RECOCIDO MiltonDocumento9 páginasRECOCIDO MiltonMilton HuamanchoqueAún no hay calificaciones
- Elaboración de Una Pieza Cerámica Por VaciadoDocumento13 páginasElaboración de Una Pieza Cerámica Por VaciadoKevin RosasAún no hay calificaciones
- Aleaciones de MagnesioDocumento10 páginasAleaciones de MagnesioIsaac ZTAún no hay calificaciones
- CobreadoDocumento6 páginasCobreadoElvis Steven Celis YzagaAún no hay calificaciones
- 1) Preparación de Una Probeta Metalografica y El Microscopio Métalografico2Documento10 páginas1) Preparación de Una Probeta Metalografica y El Microscopio Métalografico2Ricardo Chavez CordovaAún no hay calificaciones
- Laboratorio 2Documento36 páginasLaboratorio 2Mayte Olenka Miranda BandaAún no hay calificaciones
- Preparación de Probetas MetalográficasDocumento4 páginasPreparación de Probetas MetalográficasOriana MozoAún no hay calificaciones
- Practica 3 Endurecimiento Por Solucion SolidaDocumento9 páginasPractica 3 Endurecimiento Por Solucion SolidaBelinda CruzAún no hay calificaciones
- Informe Solidificacion 2Documento22 páginasInforme Solidificacion 2Valentina MoralesAún no hay calificaciones
- Serie 2012Documento5 páginasSerie 2012Joaquin Ureña0% (1)
- Práctica 9 Temple y RevenidoDocumento3 páginasPráctica 9 Temple y RevenidoFernando RodasAún no hay calificaciones
- Acero AISI 4140Documento19 páginasAcero AISI 4140Antonio GuíaAún no hay calificaciones
- Ensayo de Construccion de Diagramas de FasesDocumento10 páginasEnsayo de Construccion de Diagramas de FasesChristianQuirogaAún no hay calificaciones
- Como Hacer Diagramas de FaseDocumento9 páginasComo Hacer Diagramas de FaseArturo CollazosAún no hay calificaciones
- 1 Movimiento Rectilíneo de PartículasDocumento10 páginas1 Movimiento Rectilíneo de PartículasJavier Pulido VillanuevaAún no hay calificaciones
- Calculo de Sistema DirectoDocumento23 páginasCalculo de Sistema DirectoFranko Sanchez MendozaAún no hay calificaciones
- Perfil de Velocidades LEM II InformeDocumento8 páginasPerfil de Velocidades LEM II InformeAdrian CruzAún no hay calificaciones
- Varillas de Acero CorrugadoDocumento12 páginasVarillas de Acero CorrugadoAlvaro Pecho CardenasAún no hay calificaciones
- MEC221-Torsion Sesion 02AB-1Documento13 páginasMEC221-Torsion Sesion 02AB-1Jhon Humerez PairumaniAún no hay calificaciones
- Trabajo de Topografía Curvas de NivelDocumento33 páginasTrabajo de Topografía Curvas de Nivelmiguel angel tafurAún no hay calificaciones
- Materiales de Diseño para Un Puente PDFDocumento5 páginasMateriales de Diseño para Un Puente PDFSantiago IbarraAún no hay calificaciones
- TP 4 Modelos Atómicos BOHR y MMCADocumento2 páginasTP 4 Modelos Atómicos BOHR y MMCASentry BusterAún no hay calificaciones
- HIDROSTÁTICADocumento56 páginasHIDROSTÁTICASilvioChávez0% (1)
- AIREDocumento36 páginasAIREYefri FredAún no hay calificaciones
- Problemas QuimDocumento2 páginasProblemas QuimAnthoni Conco LoboAún no hay calificaciones
- Práctica de Infiltración - HidrologíaDocumento5 páginasPráctica de Infiltración - HidrologíaDiana Carolina PadillaAún no hay calificaciones
- Pruebas de Laboratorio Que Se Realizan A Los Agregados PetreosDocumento19 páginasPruebas de Laboratorio Que Se Realizan A Los Agregados PetreosRiioga Hiidekii100% (1)
- Memoria Estructural B Puente Huinchullay L 12.5MDocumento37 páginasMemoria Estructural B Puente Huinchullay L 12.5MCesar ChambiAún no hay calificaciones
- ........ Examen de Concreto CompletoDocumento73 páginas........ Examen de Concreto CompletoELISEO REMIGIO DE LA CRUZ AQUINOAún no hay calificaciones
- Primer TemaDocumento15 páginasPrimer TemaNeme VasquesAún no hay calificaciones
- Trabajo EnergiaDocumento32 páginasTrabajo EnergiaSteve Jordan Saavedra Farfan100% (1)
- Pmal 466 Op C 203 A Ultrasonido Tofd API 1104Documento5 páginasPmal 466 Op C 203 A Ultrasonido Tofd API 1104Jesus CondoriAún no hay calificaciones
- Campo Magnetico TerrestreDocumento7 páginasCampo Magnetico TerrestreAlejandro CampoAún no hay calificaciones
- Hoja de Fórmulas - Parcial 3 - Física 2Documento7 páginasHoja de Fórmulas - Parcial 3 - Física 2florenciafrondaAún no hay calificaciones
- Diferenciar Los Sistemas de Unidades de Medida v2Documento5 páginasDiferenciar Los Sistemas de Unidades de Medida v2Hervert Mateos Jose AngelAún no hay calificaciones
- PDF Tarea 1 Transferencia PDF - CompressDocumento53 páginasPDF Tarea 1 Transferencia PDF - CompressLaura JuarezAún no hay calificaciones
- Laboratorio de Mecánica de Suelos: Análisis Granulométrico Por Tamizado MTC E107-2000 / ASTM D - 422Documento5 páginasLaboratorio de Mecánica de Suelos: Análisis Granulométrico Por Tamizado MTC E107-2000 / ASTM D - 422luisfelipesanchezAún no hay calificaciones
- Quimica General: Unidad I - Clase Práctica 1 FechaDocumento4 páginasQuimica General: Unidad I - Clase Práctica 1 FechaMaria BenavidezAún no hay calificaciones
- Equivalencia de Los Enunciados HatsopoulasDocumento2 páginasEquivalencia de Los Enunciados Hatsopoulasdiego lopez choqueAún no hay calificaciones
- Actividad Gases 3Documento1 páginaActividad Gases 3raul olaveAún no hay calificaciones
- Ecuación de Bernoulli 2.1Documento8 páginasEcuación de Bernoulli 2.1alex variosAún no hay calificaciones
- Sistema de Lubricación en Los Motores de Combustion InternaDocumento10 páginasSistema de Lubricación en Los Motores de Combustion InternaJhordán CastañedaAún no hay calificaciones
- Determinacion de PHDocumento9 páginasDeterminacion de PHJeanpierLunaRosalesAún no hay calificaciones
- Modelos AtomicosDocumento2 páginasModelos AtomicosMario SebAún no hay calificaciones
Universidad de Carabobo4
Universidad de Carabobo4
Cargado por
cra29Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Universidad de Carabobo4
Universidad de Carabobo4
Cargado por
cra29Copyright:
Formatos disponibles
UNIVERSIDAD DE CARABOBO.
FACULTAD DE INGENIERIA.
ESCUELA DE INGENIERÍA MECÁNICA.
DEPARTAMENTO DE MATERIALES Y PROCESOS DE FABRICACIÓN.
LABORATORIO DE MATERIALES.
Práctica No.: 01.
Título de la Práctica: Análisis Térmico y Diagramas de Equilibrio.
Nombre y Apellidos:
Cédula de Identidad:
Grupo: 01
Profesor:
Preparador:
Observaciones:
26 DE DICIEMBRE DEL 2014
1. INTRODUCCIÓN
Una fase, en un material y en términos de microestructura, es una región que difiere de otra en
estructura y/o composición. Los diagramas de fases son representaciones graficas ---a varias
temperaturas, presiones y composiciones--- de las fases que están presentes. [1]
Las curvas de enfriamiento de aleaciones metálicas son graficas de temperatura versus tiempo
obtenidas en sistemas controlados que muestran cómo cambian la temperatura de un metal fundido o
aleación en el tiempo cuando se enfría lentamente en un sistema en equilibrio. La pendiente obtenida
corresponde a la velocidad de enfriamiento. Debido a que durante el enfriamiento del metal fundido
empiezan a ocurrir cambios como la solidificación del metal y los cambios alotrópicos, las velocidades
de enfriamiento se modifican en cada uno de esos procesos y por tanto cambia la pendiente de la curva
de enfriamiento, debido a que cada proceso requiere de un valor determinado de energía para poder
realizarse. [2]
Los diagramas de equilibrios son la representación gráfica de la temperatura en función de la
composición química (normalmente el % en peso) de una aleación binaria. De manera práctica indica
qué fases predominan en cada una de las temperaturas en función de la composición. Da mucha
información de la micro-estructura de una aleación cuando se enfría lentamente (en equilibrio) a
temperatura ambiente. Además, en un diagrama de fase se pueden observar los cambios que se producen
en la micro-estructura y en las fases cuando varía la temperatura. Hay que recordar de nuevo que
la micro-estructura final afecta notablemente las propiedades mecánicas. Los diagramas de fase son
representaciones gráficas de las fases que existen en un sistema de materiales a varias temperaturas,
presiones y composiciones. Los diagramas, en su mayoría, se han construido en condiciones de equilibrio
(Los diagramas de equilibrio de fases se determinan mediante la aplicación de condiciones
de enfriamiento lento), y son utilizados por ingenieros y científicos para entender y predecir muchos
aspectos del comportamiento de los materiales. [3]
En un diagrama de equilibrio deben identificarse siempre:
Temperatura de fundición de los metales puros.
Línea de liquidus.
Línea de solidus.
Línea de solvus.
Temperatura de la reacción eutéctica (si la hay).
Máxima solubilidades a la temperatura del eutéctico.
Máximas de las fases (por convención se utilizan letras arábicas para metales puros y letras del
alfabeto griego para soluciones solidas homogéneas). [2]
Por lo cual conocer la temperatura a la cual comienzan a fundirse diferentes fases. Los equilibrios
de fase y sus respectivos diagramas de fase en sistemas multicomponentes tienen aplicaciones
importantes en química, geología y ciencia de los materiales. La ciencia de materiales estudia la
estructura, propiedades y aplicaciones de los materiales científicos y tecnológicos. [4]
2. OBJETIVOS
2.1 Objetivo General:
Construir el diagrama de equilibrio de la aleación Plomo-Estaño a partir de los puntos de cambio
de pendientes reflejados en las curvas de enfriamiento de la aleación.
2.2 Objetivos Específicos:
Reconocer los diferentes tipos de curvas de enfriamiento y analizar el origen de los cambios en cada
una de ellas.
Analizar los datos obtenidos de las curvas de enfriamiento y su importancia.
Tabular los puntos identificados en las curvas de enfriamiento de la aleación.
Graficar los puntos tabulados en un sistema de Temperatura Vs % de la compasión de la aleación
(Plomo-Estaño)
Construir el diagrama de equilibrio de la aleación Plomo-Estaño atreves de la unión de los puntos
por medio de una curva suave.
Idéntica los elementos y características presente en el diagrama de equilibrio Plomo-Estaño.
Aplicar la regla de la palanca para la determinación de la compasión química de las faces presentes.
3. LISTA DE MATERIALES Y EQUIPO
3.1 Materiales.
Papel Milimetrado de una apreciación de un 1mm.
Calculadora CASIO modelo FX-570ES.
Regla de 30 CM de una apreciación de un 1mm.
Curvas de enfriamiento de la aleación Plomo-Estaño.
Coles y Marcadores.
4. PROCEDIMIENTO ESPERIMENTAL
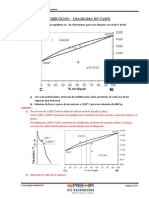
4.1 Actividad Nº1: Punto de cambio de pendiente.
Analizar las curvas de enfriamiento de la aleación (Plomo-Estaño) entregadas anteriormente por el
profesor a cargo de la sección del laboratorio de materiales.
Identificar los puntos de cambio de pendiente que se observaban en las curvas de enfriamiento de la
aleación con la finalidad de tabular estos puntos para forma una tabla datos.
4.2 Actividad Nº2: Diagrama de Fases Pb-Sb.
Graficar los puntos tabulados anteriormente en un sistema de Temperatura Vs Porcentaje de variación
de composición de los elementos en un papel milimetrado, en este caso la aleación Plomo-Estaño.
Unir los puntos graficados siguiendo un orden en específico para obtener el diagrama de equilibrio
Plomo-Estaño, después se indicó los elementos presentes en el diagrama como las líneas de Liquidus,
Solidus, Solvus y las fases presentes en cada zona del diagrama.
4.3 Actividad Nº3: Cantidades relativas y composición químicas.
Ubicar en el diagrama de Plomo-Estaño el punto al cual se le quiere determinar la compasión química
y cantidades relativas de cada fase presente.
Aplicar si es necesario la regla de la palanca para hallar la cantidad relativa de los elementos de la
aleación Plomo-Estaño.
Compare con el diagrama teórico correspondiente (Plomo-Estaño).
5. RESULTADOS OBTENIDOS
5.1 Actividad Nº1: Puntos de Cambio de pendiente.
Tabla 1. Tabla de tabulación de los puntos de cambio de pendiente de las curvas de enfriamiento Plomo-Estaño.
5.2 Actividad Nº2: Construcción de diagrama de equilibrio de Plomo-Estaño.
5.3 Actividad Nº3: Cantidades relativas y composición química.
La ecuación (1) representa la ecuación de la regla de la palanca el cual es el método empleado para
conocer el porcentaje de fase sólida y líquida presentes en una aleación de una cierta concentración
cuando se encuentra a una determinada temperatura [5],mientras que la ecuación (2) es resultado de un
razonamiento lógico. Las ecuaciones son:
% α = (bop) / (lti) *100 (1)
% L = 100 - % α (2)
Donde:
%α = Porcentaje de alfa (solido) presente en una fase.
%L= Porcentaje de líquido presente en una fase.
bop = Brazo opuesto de la palanca, esto quiera decir que para calcular el valor de α entonces la
distancia que hay es desde el punto de estudio hasta la fase opuesta a calcular en este caso la de
liquidus.
lti = longitud total de la isoterma.
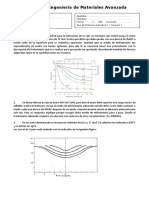
Imagen 1. Diagrama binario con fases sólida y líquida, con la representación de la isoterma (LS)
Determine la Composición química y cantidades relativas para 35% Sn a 230°c
Composición Química:
Se traza la isoterma a la temperatura de 230°c y se ven los cortes de esta con la línea de liquidus
y solidus. En este caso la composición a esa temperatura es:
α = 10 % Sn – 90 % Pb
L = 48 % Sn – 52 % PB
Cantidades Relativas:
Aplicando las ecuaciones (1) y (2), se obtiene:
% 230°c α = (48-35) / (48-10)*100
% α =34,21
% L =100- % α
% L = 65,79
Determine la compasión química y cantidades relativas para 85% a 210°c
Composición Química:
Nuevamente se traza la isoterma pero esta vez a una temperatura de 210°c y se ven los cortes
de esta con la línea de liquidus y solidus. En este caso la composición a esa temperatura es:
β = 98 % Sn – 2% Pb
L = 72 % Sn – 28 % PB
Cantidades Relativas:
Nuevamente se aplicando las ecuaciones (1) y (2), se obtiene:
% β = (72-85) / (72-98)*100
% β =50
% L =100- % β
% L = 50
6. ANALISIS DE RESUSTADOS
6.1 Actividad No. 1: Puntos de cambio de pendiente.
Los cambios de pendientes en las curvas de enfriamiento de aleación Plomo-Estaño representa
los cambio de velocidad de enfriamiento de la aleación fundida, esto se debe a que para cambio de
fase el material necesita una energía requerida y por ende una velocidad requerida para realizar la
misma.
6.2 Actividad No. 2: Construcción de diagrama de equilibrio.
Una vez finalizado el diagrama de equilibrio Plomo-Estaño:
Se Observó las fases que se presentan durante el enfriamiento.
Se pudo determinar el punto eutéctico y las zonas Hipoeutectica e Hipereutectica en el diagrama.
Se identificaron las máximas solubilidades a temperatura eutéctica.
6.3 Actividad No.3: Cantidades relativas y Composición química.
En la sección a esta actividad, cuando se situó el punto que representa la composición química
del Plomo-Estaño en la fase α + L para calcular cantidades relativas de los elementos, dicho punto
estaba más cercano a la línea de liquidus; eso quiere decir que su composición en cantidades
relativas tiende a ser más líquida que sólida y en efecto fue así cuando se hicieron los cálculos
requerido para afirmar dicha aseveración también se pudo determinar fácilmente la composición
química a esa temperatura y porcentaje de aleación específicamente . En la sección de β, el punto
que representaba la composición química de la aleación en la fase β + L tendía a estar más cerca la
línea liquidus y realizando los cálculos pertinentes se obtuvo que su composición en cantidades
relativas era más iguales en parte liquidada y solidad.
7. CONCLUSIONES
El diagrama de equilibrio presento ser muy útil ya que en él se pudo representar de una manera
coherente, ordenada y representativa las fases presentes cuando se deja enfriar de forma lenta una
aleación fundida de Plomo-Estaño.
El diagrama de equilibrio proporciono información de interés para cálculos específicos en el área de
estudio de la aleación Plomo-Estaño tales como composición química y cantidades relativas, que
comúnmente se usa en el área de ingeniería.
Las curvas de enfriamiento índico que tan rápido se enfrió la aleación Plomo-Estaño.
Se obtuvo los puntos de fusión de cada elemento de la aleación Plomo-Estaño a partir del diagrama
de equilibrio.
8. BIBLIOGRAFIA
[1]William F. Smith, JavadHashemi (2006). “Fundamentos de la Ciencia e Ingeniería de Materiales”.
Editorial McGraw-Hill. México D.F, México. Capítulo 8, Pág. 428.
[2]Militza J. Iriza Castro, “Manual de Practicas del Laboratorio de Materiales”, Venezuela Universidad
de Carabobo Facultad de Ingeniería Publicaciones, Pág. 1-5.
[3] Smith, William F, Hashemi, Javad – 4A ED, Fundamentos de la ciencia e ingeniería de materiales.
Editorial McGraw-Hill. México D.F, México. Capítulo 8, Pág. 334-348.
[4]Ana Ramírez “Diagrama de Equilibrio” http://www.monografias.com/trabajos96/diagramas-
equilibrio/diagramas-equilibrio.shtml. Fecha: 25/11/2014, hora: 3:00 pm.
[5]http://datateca.unad.edu.co/contenidos/401536/leccin_23_regla_de_la_palanca_inversa.html.
Fecha 23/11/2014, hora 5:00 pm.
También podría gustarte
- Informe Practico: Microscopia de Los Aceros Al Carbono Enfriados LentamenteDocumento16 páginasInforme Practico: Microscopia de Los Aceros Al Carbono Enfriados LentamenteJuan Vicente Díaz100% (1)
- Ejercicios de DIFUSIÓN Guia 1Documento5 páginasEjercicios de DIFUSIÓN Guia 1Cinthya Peña RoqueAún no hay calificaciones
- 08 Practica - Secuencia de Operaciones-1Documento3 páginas08 Practica - Secuencia de Operaciones-1Jaime Alfonso Gonzalez Vivas50% (2)
- Ensayo de TempleDocumento10 páginasEnsayo de TempleRigoberto SánchezAún no hay calificaciones
- Medios para Evitar RechupesDocumento73 páginasMedios para Evitar RechupesgeoswaldAún no hay calificaciones
- Diagrama de Fases IsomorfosDocumento29 páginasDiagrama de Fases IsomorfosEMILIANO MAXIMO FUENTES ORTIZ100% (1)
- Informe Práctica 9 y 10. Tratamientos Térmicos y Templabilidad.Documento11 páginasInforme Práctica 9 y 10. Tratamientos Térmicos y Templabilidad.YuengHong100% (2)
- Fundiciones FerrosasDocumento9 páginasFundiciones FerrosasJoan CedeñoAún no hay calificaciones
- Informe #11 RecristalizacionDocumento12 páginasInforme #11 RecristalizacionGenrryLeonAún no hay calificaciones
- Informe 10 Lab de Materiales TemplabilidadDocumento6 páginasInforme 10 Lab de Materiales TemplabilidadAlexander Sanchez100% (1)
- Diagrama de FasesDocumento26 páginasDiagrama de FasesKevin YamunaqueAún no hay calificaciones
- Metalurgia Física Preguntas ExamenDocumento2 páginasMetalurgia Física Preguntas ExamenJuan Diego Falcon ChuraAún no hay calificaciones
- 2 Preparación de Probetas MetalográficasDocumento3 páginas2 Preparación de Probetas MetalográficasAbigail CovaAún no hay calificaciones
- 4 Unidad. EstequiometriaDocumento3 páginas4 Unidad. EstequiometriaFernanda FloresAún no hay calificaciones
- P5 TT. Diagrama CCTDocumento3 páginasP5 TT. Diagrama CCTCande Flores100% (1)
- Laboratorio Inclusiones 2Documento5 páginasLaboratorio Inclusiones 2Juan VillacisAún no hay calificaciones
- Informe Normalizado y RecocidoDocumento17 páginasInforme Normalizado y RecocidoChristian Puza100% (1)
- Catalizador, Tipo y Usos en La Fundicion y SiderurgiaDocumento5 páginasCatalizador, Tipo y Usos en La Fundicion y SiderurgiaBill C. Mercado Gamboa0% (1)
- Calculo de MazarotaDocumento4 páginasCalculo de MazarotaAnonymous wljFU7ri0% (1)
- Examen Parcial Fundicion 2020Documento3 páginasExamen Parcial Fundicion 2020Juan Diego Falcon Chura0% (1)
- Informe 1 Fundicion GrisDocumento10 páginasInforme 1 Fundicion GrisDennis Martinez LoaizaAún no hay calificaciones
- Ejercicios Resueltos Diagrama de Fases IES ValdehierroDocumento21 páginasEjercicios Resueltos Diagrama de Fases IES ValdehierroAnaAún no hay calificaciones
- Informe de Ensayo de CompresiónDocumento14 páginasInforme de Ensayo de CompresiónJarol Carrion SalvatierraAún no hay calificaciones
- Guia de Laboratorio de Metalografia I 2021Documento14 páginasGuia de Laboratorio de Metalografia I 2021Sergio RicardoAún no hay calificaciones
- Ataque QuimicoDocumento7 páginasAtaque QuimicoJuan Carlos BernalAún no hay calificaciones
- Practica Desbaste PDFDocumento6 páginasPractica Desbaste PDFPaola GonzalezAún no hay calificaciones
- Determinación de La Densidad de Dislocaciones A Partir Del Patrón de Difracción de Rayos XDocumento10 páginasDeterminación de La Densidad de Dislocaciones A Partir Del Patrón de Difracción de Rayos XAlejandro usma ladinoAún no hay calificaciones
- Guia Fenomenos #3-FUERZAS SOBRE SUPERFICIES PLANASDocumento9 páginasGuia Fenomenos #3-FUERZAS SOBRE SUPERFICIES PLANASYinethAún no hay calificaciones
- RevenidoDocumento3 páginasRevenidoedymiranda93Aún no hay calificaciones
- Recristalización y Recocido de BronceDocumento11 páginasRecristalización y Recocido de BronceGracielaGramyQHAún no hay calificaciones
- Primer Exanen Conformado de Metales 2013 - 2Documento9 páginasPrimer Exanen Conformado de Metales 2013 - 2Micky UltAún no hay calificaciones
- 4 Ataque QuimicoDocumento13 páginas4 Ataque QuimicoPABLO DIAZ ENRIQUEZAún no hay calificaciones
- Practica4 Corrosion Proceso EspontaneoDocumento12 páginasPractica4 Corrosion Proceso EspontaneoDiego Villanueva0% (1)
- Respuestas de Guia 4 FinalDocumento9 páginasRespuestas de Guia 4 FinalGregory GoncalvezAún no hay calificaciones
- Primer Examen de Transformación de Fases 2021-A Tema A (Autoguardado)Documento6 páginasPrimer Examen de Transformación de Fases 2021-A Tema A (Autoguardado)BLADIMIR CHARCA MERMAAún no hay calificaciones
- TermoDocumento1 páginaTermolexdaniloAún no hay calificaciones
- Clase 6Documento14 páginasClase 6Ale Calixto HermosillaAún no hay calificaciones
- Normalizado, Recocido y Relevado de EsfuerzosDocumento30 páginasNormalizado, Recocido y Relevado de EsfuerzosMIGUEL ANGEL SAMANO MORENOAún no hay calificaciones
- Informe de Metalografia Diego Tirado 2120369Documento11 páginasInforme de Metalografia Diego Tirado 2120369Anderson JuradoAún no hay calificaciones
- Introducción A La Siderurgia 2016Documento30 páginasIntroducción A La Siderurgia 2016Sebastian Andres MuñozAún no hay calificaciones
- Practica 2 Comportamiento MecánicoDocumento7 páginasPractica 2 Comportamiento MecánicoJose Antonio MartinezAún no hay calificaciones
- Informe de Laboratorio N°5-Ensayo de Tratameintos Termicos Del Acero-UnifimDocumento21 páginasInforme de Laboratorio N°5-Ensayo de Tratameintos Termicos Del Acero-UnifimJCarlos GutierrezAún no hay calificaciones
- CLASE SEMANA #02 Balance Chancado SoluciónDocumento21 páginasCLASE SEMANA #02 Balance Chancado SoluciónIsmael ValladolidAún no hay calificaciones
- Monografia de Tratamientos Termico Del AceroDocumento33 páginasMonografia de Tratamientos Termico Del AceroJonatanGalvanRojasAún no hay calificaciones
- Practica Ensayo JominyDocumento23 páginasPractica Ensayo JominyJose Jonas Alfaro0% (1)
- Informe Practico: Analisis MacroscopicoDocumento13 páginasInforme Practico: Analisis MacroscopicoJuan Vicente DíazAún no hay calificaciones
- RECOCIDO MiltonDocumento9 páginasRECOCIDO MiltonMilton HuamanchoqueAún no hay calificaciones
- Elaboración de Una Pieza Cerámica Por VaciadoDocumento13 páginasElaboración de Una Pieza Cerámica Por VaciadoKevin RosasAún no hay calificaciones
- Aleaciones de MagnesioDocumento10 páginasAleaciones de MagnesioIsaac ZTAún no hay calificaciones
- CobreadoDocumento6 páginasCobreadoElvis Steven Celis YzagaAún no hay calificaciones
- 1) Preparación de Una Probeta Metalografica y El Microscopio Métalografico2Documento10 páginas1) Preparación de Una Probeta Metalografica y El Microscopio Métalografico2Ricardo Chavez CordovaAún no hay calificaciones
- Laboratorio 2Documento36 páginasLaboratorio 2Mayte Olenka Miranda BandaAún no hay calificaciones
- Preparación de Probetas MetalográficasDocumento4 páginasPreparación de Probetas MetalográficasOriana MozoAún no hay calificaciones
- Practica 3 Endurecimiento Por Solucion SolidaDocumento9 páginasPractica 3 Endurecimiento Por Solucion SolidaBelinda CruzAún no hay calificaciones
- Informe Solidificacion 2Documento22 páginasInforme Solidificacion 2Valentina MoralesAún no hay calificaciones
- Serie 2012Documento5 páginasSerie 2012Joaquin Ureña0% (1)
- Práctica 9 Temple y RevenidoDocumento3 páginasPráctica 9 Temple y RevenidoFernando RodasAún no hay calificaciones
- Acero AISI 4140Documento19 páginasAcero AISI 4140Antonio GuíaAún no hay calificaciones
- Ensayo de Construccion de Diagramas de FasesDocumento10 páginasEnsayo de Construccion de Diagramas de FasesChristianQuirogaAún no hay calificaciones
- Como Hacer Diagramas de FaseDocumento9 páginasComo Hacer Diagramas de FaseArturo CollazosAún no hay calificaciones
- 1 Movimiento Rectilíneo de PartículasDocumento10 páginas1 Movimiento Rectilíneo de PartículasJavier Pulido VillanuevaAún no hay calificaciones
- Calculo de Sistema DirectoDocumento23 páginasCalculo de Sistema DirectoFranko Sanchez MendozaAún no hay calificaciones
- Perfil de Velocidades LEM II InformeDocumento8 páginasPerfil de Velocidades LEM II InformeAdrian CruzAún no hay calificaciones
- Varillas de Acero CorrugadoDocumento12 páginasVarillas de Acero CorrugadoAlvaro Pecho CardenasAún no hay calificaciones
- MEC221-Torsion Sesion 02AB-1Documento13 páginasMEC221-Torsion Sesion 02AB-1Jhon Humerez PairumaniAún no hay calificaciones
- Trabajo de Topografía Curvas de NivelDocumento33 páginasTrabajo de Topografía Curvas de Nivelmiguel angel tafurAún no hay calificaciones
- Materiales de Diseño para Un Puente PDFDocumento5 páginasMateriales de Diseño para Un Puente PDFSantiago IbarraAún no hay calificaciones
- TP 4 Modelos Atómicos BOHR y MMCADocumento2 páginasTP 4 Modelos Atómicos BOHR y MMCASentry BusterAún no hay calificaciones
- HIDROSTÁTICADocumento56 páginasHIDROSTÁTICASilvioChávez0% (1)
- AIREDocumento36 páginasAIREYefri FredAún no hay calificaciones
- Problemas QuimDocumento2 páginasProblemas QuimAnthoni Conco LoboAún no hay calificaciones
- Práctica de Infiltración - HidrologíaDocumento5 páginasPráctica de Infiltración - HidrologíaDiana Carolina PadillaAún no hay calificaciones
- Pruebas de Laboratorio Que Se Realizan A Los Agregados PetreosDocumento19 páginasPruebas de Laboratorio Que Se Realizan A Los Agregados PetreosRiioga Hiidekii100% (1)
- Memoria Estructural B Puente Huinchullay L 12.5MDocumento37 páginasMemoria Estructural B Puente Huinchullay L 12.5MCesar ChambiAún no hay calificaciones
- ........ Examen de Concreto CompletoDocumento73 páginas........ Examen de Concreto CompletoELISEO REMIGIO DE LA CRUZ AQUINOAún no hay calificaciones
- Primer TemaDocumento15 páginasPrimer TemaNeme VasquesAún no hay calificaciones
- Trabajo EnergiaDocumento32 páginasTrabajo EnergiaSteve Jordan Saavedra Farfan100% (1)
- Pmal 466 Op C 203 A Ultrasonido Tofd API 1104Documento5 páginasPmal 466 Op C 203 A Ultrasonido Tofd API 1104Jesus CondoriAún no hay calificaciones
- Campo Magnetico TerrestreDocumento7 páginasCampo Magnetico TerrestreAlejandro CampoAún no hay calificaciones
- Hoja de Fórmulas - Parcial 3 - Física 2Documento7 páginasHoja de Fórmulas - Parcial 3 - Física 2florenciafrondaAún no hay calificaciones
- Diferenciar Los Sistemas de Unidades de Medida v2Documento5 páginasDiferenciar Los Sistemas de Unidades de Medida v2Hervert Mateos Jose AngelAún no hay calificaciones
- PDF Tarea 1 Transferencia PDF - CompressDocumento53 páginasPDF Tarea 1 Transferencia PDF - CompressLaura JuarezAún no hay calificaciones
- Laboratorio de Mecánica de Suelos: Análisis Granulométrico Por Tamizado MTC E107-2000 / ASTM D - 422Documento5 páginasLaboratorio de Mecánica de Suelos: Análisis Granulométrico Por Tamizado MTC E107-2000 / ASTM D - 422luisfelipesanchezAún no hay calificaciones
- Quimica General: Unidad I - Clase Práctica 1 FechaDocumento4 páginasQuimica General: Unidad I - Clase Práctica 1 FechaMaria BenavidezAún no hay calificaciones
- Equivalencia de Los Enunciados HatsopoulasDocumento2 páginasEquivalencia de Los Enunciados Hatsopoulasdiego lopez choqueAún no hay calificaciones
- Actividad Gases 3Documento1 páginaActividad Gases 3raul olaveAún no hay calificaciones
- Ecuación de Bernoulli 2.1Documento8 páginasEcuación de Bernoulli 2.1alex variosAún no hay calificaciones
- Sistema de Lubricación en Los Motores de Combustion InternaDocumento10 páginasSistema de Lubricación en Los Motores de Combustion InternaJhordán CastañedaAún no hay calificaciones
- Determinacion de PHDocumento9 páginasDeterminacion de PHJeanpierLunaRosalesAún no hay calificaciones
- Modelos AtomicosDocumento2 páginasModelos AtomicosMario SebAún no hay calificaciones