Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Actividad Gases 3
Cargado por
raul olaveDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Actividad Gases 3
Cargado por
raul olaveCopyright:
Formatos disponibles
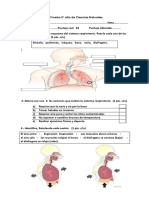
ACTIVIDAD DE GASES 3
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, 78 g de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, 78 g de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número ocupa 10 litros bajo una presión de 730
de moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número de ocupa 10 litros bajo una presión de 730
moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
Los milímetros de Hg equivalentes a 2.5 atm son: Una cantidad determinada de C6H6 ocupa un 6. Una determinada masa de nitrógeno
volumen de 1250 ml a 20º C y 1 torr, el número ocupa 10 litros bajo una presión de 730
de moléculas del compuesto será: mmHg. Determinar el volumen de la
si de dióxido de carbono se encuentran en misma masa de gas a presión normal si la
condiciones de temperatura y presión ambiente de 5. Una muestra de gas neón se encuentra a 800 temperatura permanece constante.
20º C y 560mmHg respectivamente, el volumen a 0º torr ocupa un volumen de 3,450 ml a una
C y 1 atm de presión será: temperatura de 20°C. ¿Cuál es la temperatura 7. Si 3, de cierto compuesto gaseoso
3. Si 400 ml de un gas pesan 0,536 g en condiciones para que la presión cambie a 1,5 atm y el ocupan un volumen de 3L a 50º C y 747
normales, ¿Cuál es su peso molecular? volumen a 4 L? mmHg, la masa molecular del compuesto
será:
También podría gustarte
- AnÁlisis Bromatológico de La CarneDocumento12 páginasAnÁlisis Bromatológico de La Carnealonso100% (1)
- Examen Parcial - FISICA B1 - FNDocumento6 páginasExamen Parcial - FISICA B1 - FNRichard Cruz100% (1)
- Guía Leyes GasesDocumento3 páginasGuía Leyes GasesSonia SanhuezaAún no hay calificaciones
- Guía de Leyes de Los GasesDocumento3 páginasGuía de Leyes de Los Gasescristian diazAún no hay calificaciones
- Taller de Gases IdealesDocumento2 páginasTaller de Gases Idealestkk ppioupAún no hay calificaciones
- Ejercicios de AplicaciónDocumento2 páginasEjercicios de AplicaciónJhogen Eduardo Escalante PérezAún no hay calificaciones
- Ejercicios de AplicaciónDocumento2 páginasEjercicios de AplicaciónJhogen Eduardo Escalante PérezAún no hay calificaciones
- Ejercicios GasesDocumento1 páginaEjercicios GasesLaura RomeroAún no hay calificaciones
- Guia Gases IdealesDocumento1 páginaGuia Gases IdealesChristian Navarrete FerrerAún no hay calificaciones
- Actividad Estado GaseosoDocumento2 páginasActividad Estado GaseosoBruno Rivera ChupillonAún no hay calificaciones
- CUESTIONARIO GasestDocumento3 páginasCUESTIONARIO GasestNatalyPomaPerezAún no hay calificaciones
- Leyes de Gases (50ej)Documento2 páginasLeyes de Gases (50ej)AlexisAún no hay calificaciones
- Taller Leyes GasesDocumento1 páginaTaller Leyes Gasesgeralfandino100% (1)
- Problemas GasesDocumento1 páginaProblemas Gasesevelin mamaniAún no hay calificaciones
- Ejercicios III Parcial F.E 4Documento5 páginasEjercicios III Parcial F.E 4Profesor Denis VijilAún no hay calificaciones
- Giua de Gases 2022Documento6 páginasGiua de Gases 2022HUGO IBAÑEZAún no hay calificaciones
- Taller GasesDocumento2 páginasTaller GasesNatalia TorresAún no hay calificaciones
- Problemas Leyes de Los GasesDocumento2 páginasProblemas Leyes de Los GasesEl GreckoAún no hay calificaciones
- Taller Leyes+gases+perfectosDocumento2 páginasTaller Leyes+gases+perfectosAlejandro PalacioAún no hay calificaciones
- Ejercicios Ley de Los GasesDocumento4 páginasEjercicios Ley de Los GasesRuben FerAún no hay calificaciones
- Mas Ejercicios de GasesDocumento2 páginasMas Ejercicios de GasesDario de los SantosAún no hay calificaciones
- Ejercicios de Leyes de Los GasesDocumento4 páginasEjercicios de Leyes de Los GasesB. Aguilar Oscar0% (1)
- Gases IdealesDocumento4 páginasGases IdealesYenifer Flach LeiriaAún no hay calificaciones
- Tarea 1°PDocumento2 páginasTarea 1°PGaby Garcia Guerrero0% (1)
- Taller de GasesDocumento2 páginasTaller de GasesYerania Sanchez0% (1)
- Problemario de GasesDocumento2 páginasProblemario de GasesLuis FloresAún no hay calificaciones
- 1101 - 1104 - Ciencias Naturales - Química 2 - Rafaelsilva PDFDocumento2 páginas1101 - 1104 - Ciencias Naturales - Química 2 - Rafaelsilva PDFPRIETO MOLINA CAROL VANESA ESTUDIANTEAún no hay calificaciones
- Taller Ley de Los GasesDocumento3 páginasTaller Ley de Los GasesSTICH26Aún no hay calificaciones
- Problemas GasesDocumento13 páginasProblemas GasesAriel BernalAún no hay calificaciones
- Ejercicios de Gases IdealesDocumento1 páginaEjercicios de Gases IdealesExon TorresAún no hay calificaciones
- Ejercicios Gases QuimicosDocumento4 páginasEjercicios Gases QuimicoselwueboAún no hay calificaciones
- Ejercicios Leyes de Los GasesDocumento2 páginasEjercicios Leyes de Los GasesAngela tmAún no hay calificaciones
- Ejercicios ResultosDocumento2 páginasEjercicios ResultosCurruchiche Cali Josias JoelAún no hay calificaciones
- Ejercicios (2) GasesDocumento2 páginasEjercicios (2) GasesaliroestayAún no hay calificaciones
- Práctica de Química Práctica de QuímicaDocumento1 páginaPráctica de Química Práctica de QuímicaEver Mamani QuispeAún no hay calificaciones
- Gases IdealesDocumento2 páginasGases IdealesLisseth HarumiAún no hay calificaciones
- Dilatacion de Los GasesDocumento8 páginasDilatacion de Los GasesNathanael GranadosAún no hay calificaciones
- Giua de Gases 2022 AlgoDocumento8 páginasGiua de Gases 2022 AlgoHUGO IBAÑEZAún no hay calificaciones
- Ejercicios Repaso Todas Las Leyes 2021Documento1 páginaEjercicios Repaso Todas Las Leyes 2021Maria Pia Morales RiveroAún no hay calificaciones
- 1.2. Manual de TareasDocumento10 páginas1.2. Manual de TareasRaphael Gutierrez DelgadoAún no hay calificaciones
- Problemas de GasesDocumento2 páginasProblemas de GasesWilliam Molano100% (1)
- Leyes de Los GasesDocumento52 páginasLeyes de Los GasesCesar Caranqui AñazcoAún no hay calificaciones
- Ejercicios Combinados de GasesDocumento1 páginaEjercicios Combinados de GasesCatherine AlmendralesAún no hay calificaciones
- Ejercicios Sencillos Gases IdealesDocumento4 páginasEjercicios Sencillos Gases IdealesCastillo AnaAún no hay calificaciones
- Guía de Problemas de GasesDocumento2 páginasGuía de Problemas de GasesEsmeAún no hay calificaciones
- Estado GaseosoDocumento2 páginasEstado Gaseosomiguel0lenizAún no hay calificaciones
- 4 - Banco de PreguntasDocumento3 páginas4 - Banco de PreguntasJannet KeithAún no hay calificaciones
- Ley de Los Gases Ideales o Ecuacion de Estado PDFDocumento2 páginasLey de Los Gases Ideales o Ecuacion de Estado PDFDaniel SarriaAún no hay calificaciones
- EjerciciosdefisicoqumicaDocumento5 páginasEjerciciosdefisicoqumicaMariela Roque FloresAún no hay calificaciones
- Actividad Gases 4Documento1 páginaActividad Gases 4raul olaveAún no hay calificaciones
- Gases Ideales PDFDocumento2 páginasGases Ideales PDFPaul LeonAún no hay calificaciones
- Práctico #1 Gases IdealesDocumento36 páginasPráctico #1 Gases Ideales5B RODRIGUEZ SALVATIERRA FABRICIOAún no hay calificaciones
- 4 Gases 2020 TallerDocumento2 páginas4 Gases 2020 Talleredinson SuarezAún no hay calificaciones
- Taller Pre-Parcial. Ciencias 8Documento1 páginaTaller Pre-Parcial. Ciencias 8merry101013Aún no hay calificaciones
- GasesDocumento3 páginasGasesLuis F. González AñezAún no hay calificaciones
- Ejercicios de GasesDocumento1 páginaEjercicios de GasesDario de los SantosAún no hay calificaciones
- 01 - Ejercitario de GasesDocumento13 páginas01 - Ejercitario de GasesAraceli UllónAún no hay calificaciones
- Gases T. Autonomo 39645Documento2 páginasGases T. Autonomo 39645Carlos ManuelAún no hay calificaciones
- Problemas de Gases Tema 2Documento1 páginaProblemas de Gases Tema 2MiriamAún no hay calificaciones
- Actividad Gases 4Documento1 páginaActividad Gases 4raul olaveAún no hay calificaciones
- Balanceo de EcuacionesDocumento18 páginasBalanceo de Ecuacionesraul olaveAún no hay calificaciones
- .Estados de Agregacion PlasmaDocumento6 páginas.Estados de Agregacion Plasmaraul olave100% (1)
- Ana Maria ZapataDocumento1 páginaAna Maria Zapataraul olaveAún no hay calificaciones
- Matriz Química Segundo Periodo AcademicoDocumento1 páginaMatriz Química Segundo Periodo Academicoraul olaveAún no hay calificaciones
- Actividades 30% QUÍMICADocumento2 páginasActividades 30% QUÍMICAraul olaveAún no hay calificaciones
- 2.1 Conceptos Basicos de MotivaciónDocumento11 páginas2.1 Conceptos Basicos de MotivaciónJohannAún no hay calificaciones
- Pacífico Cotizador VIAPDocumento3 páginasPacífico Cotizador VIAPJose Miguel Vera VasquezAún no hay calificaciones
- Infecciones de Transmisión SexualDocumento3 páginasInfecciones de Transmisión SexualNito ValleAún no hay calificaciones
- Lideres y LiderasgoDocumento5 páginasLideres y LiderasgosoulbeatAún no hay calificaciones
- Diseño de Nanodispositivos IIDocumento4 páginasDiseño de Nanodispositivos IIMARCOS ALEJANDRO RODRIGUEZ RODRIGUEZAún no hay calificaciones
- MagnesioDocumento2 páginasMagnesioSayori GorgoritaAún no hay calificaciones
- Cancionero Del AlmaDocumento25 páginasCancionero Del AlmaPaul Andres Beltrán CastilloAún no hay calificaciones
- Cesarea BovinosDocumento6 páginasCesarea BovinosSebastian E. Oyarzún MuñozAún no hay calificaciones
- Ogunda SheDocumento6 páginasOgunda SheFabrício GonçalvesAún no hay calificaciones
- El ConectomaDocumento144 páginasEl ConectomaMaarco Antonio Mejía Mori100% (3)
- TERCERIZACIÓNDocumento8 páginasTERCERIZACIÓNAngela AlsinaAún no hay calificaciones
- Actividad Del Agua en MicrobiologíaDocumento40 páginasActividad Del Agua en MicrobiologíaLesli Guerrero100% (2)
- PYT Informe Final Proyecto ChocoringaDocumento206 páginasPYT Informe Final Proyecto ChocoringaDUO FNTAún no hay calificaciones
- Tipos de AislamientosDocumento4 páginasTipos de AislamientosBrigitte MaldonadoAún no hay calificaciones
- Caso Clinico FobiasDocumento5 páginasCaso Clinico FobiasKarina QJAún no hay calificaciones
- Taller BM UnidMultyRecircDocumento2 páginasTaller BM UnidMultyRecircJuan Fer CastroAún no hay calificaciones
- Fundamentos de Sismología (1° Parte)Documento21 páginasFundamentos de Sismología (1° Parte)xrichacoxAún no hay calificaciones
- T Uleam 05 0005Documento146 páginasT Uleam 05 0005Zantiago CMAún no hay calificaciones
- Rotulado nutricional-ANMATDocumento10 páginasRotulado nutricional-ANMATOlga WesterAún no hay calificaciones
- Nom 001 Sede 2005Documento784 páginasNom 001 Sede 2005bibiana8593Aún no hay calificaciones
- Hoja de Datos de Seguridad 3M Petrifilm Placa para Salmonella ExpressDocumento9 páginasHoja de Datos de Seguridad 3M Petrifilm Placa para Salmonella ExpressJose LopezAún no hay calificaciones
- PRUEBA DE 5° AÑO CIENCIAS NATURALES ADocumento5 páginasPRUEBA DE 5° AÑO CIENCIAS NATURALES Ajeannettediaz100% (2)
- Puerperio InmediatoDocumento1 páginaPuerperio Inmediatoanon-551395100% (2)
- Tarea Semana 5 InvestigacionDocumento13 páginasTarea Semana 5 InvestigacionAgustín figueroaAún no hay calificaciones
- Informe de Derivación de La Estudiante A. N. R. P.Documento2 páginasInforme de Derivación de La Estudiante A. N. R. P.hernanrene23Aún no hay calificaciones
- 126 Las Drogas y Los Adolescentes Lo Que Los Padres 0001 PDFDocumento304 páginas126 Las Drogas y Los Adolescentes Lo Que Los Padres 0001 PDFBrenda Cárcamo MonteroAún no hay calificaciones
- Flores e Insectos ComestiblesDocumento18 páginasFlores e Insectos ComestiblesJaimeMarquezAún no hay calificaciones
- 04 Guia OrificiosDocumento7 páginas04 Guia OrificiosAdrian Muñoz GonzalesAún no hay calificaciones