Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Usos y aplicaciones del cromo en aleaciones y compuestos
Cargado por
angieDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Usos y aplicaciones del cromo en aleaciones y compuestos
Cargado por
angieCopyright:
Formatos disponibles
1. Consultar algunos usos del cromo.
RTA: El uso principal del cromo está en aleaciones con hierro, níquel o cobalto con
lo que se aumenta la dureza, tenacidad y resistencia a la corrosión. En los aceros
inoxidables, el cromo constituye 10% o más de la composición final.
A causa de su dureza, una aleación de Cr-Co-W se usa para herramientas de corte. El
cromo depositado electrolíticamente proporciona un acabado brillante, duro y
resistente a la corrosión por lo que se ha utilizado durante mucho tiempo en la
industria del automóvil aunque ya ha sido reemplazado por los plásticos.
Otro uso importante es, en forma de cromita, como material refractario debido a su
alto punto de fusión, su pequeña dilatación térmica y la estabilidad de su estructura
cristalina.
Las sales de cromo se usan para colorear el vidrio, el cuero y como catalizadores. El
CrO2 se usa en cintas magnéticas.
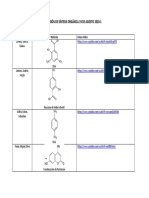
2. Realice el diagrama de la estructura de los diferentes compuestos de coordinación
obtenidos.
https://pubchem.ncbi.nlm.nih.gov/compound/91873229#section=Top
3. Proponer la síntesis de un compuesto de coordinación de cromo.
RTA: otra alternativa es partiendo del cromato que se encuentra en un estado de
oxidación +6 este puede ser reducido a un estado +3 (cromito) por medio de un metal
(zinc) y un medio ácido, cuando se tiene la reducción esto facilita la formación de
enlace con los ligando, hay que tener en cuenta cierto parámetros como temperatura,
agitación, las cantidades de reactivos entre otras para para que la formación del cristal
sea la indicada.
4. Definir:
Compuestos de coordinación cinéticamente inertes
Su velocidad de descomposición es muy baja. Tampoco existe un convenio
establecido, pero en muchas ocasiones se considera un complejo inerte aquél que es
capaz de ser aislado y caracterizado en atmósfera oxidante, y sus propiedades se
mantienen constantes con el tiempo.
Los tipos de reacción en los cuales puede participar los compuestos de
coordinación.
Algunas reacciones pueden ser el intercambio de ligando, descomposicion termica,
aumento del numero de ligando, reacciones fotoquimicas, nucleofila de ligando
entre otras
5. Diseñe la estructura de cada sal.
Sal de mohr o Sulfato de amonio y hexaacuohierro (II), [𝐹𝑒 (𝐻2𝑂)6] (𝑁𝐻4)2(𝑆𝑂4)2: Las sales
de mohr forman cristales monoclínicos
Triacuotrioxalatoferrato (III) de potasio, 𝐾3 [𝐹𝑒 (𝐶2𝑂4)3] ∙3𝐻2𝑂
El complejo de ferrioxalato tiene una simetría (octaédrica) molecular D3, dentro de la cual el centro
de hierro es octaédrico.
6. ¿Cuáles son los usos de cada uno de los compuestos coordinados preparados?
Sal de mohr:
En química analítica, esta sal es la fuente preferida de iones ferrosos ya que el sólido
tiene una larga vida útil, siendo resistente a la oxidación. Esta estabilidad se extiende
algo a las soluciones que reflejan el efecto del pH sobre la pareja redox ferrosa /
férrica. Esta oxidación ocurre más fácilmente a pH alto. Los iones de amonio hacen
que las soluciones de la sal de Mohr sean ligeramente ácidas, lo que ralentiza este
proceso de oxidación. El ácido sulfúrico comúnmente se agrega a las soluciones para
reducir la oxidación a hierro férrico. Se usa en el dosímetro de Fricke para medir altas
dosis de rayos gamma.
Triacuotrioxalatoferrato (III) de potasio, 𝐾3 [𝐹𝑒 (𝐶2𝑂4)3] ∙3𝐻2𝑂
La demanda de oxígeno y está vinculado con los tintes sintéticos, actinometría
química, es decir, la medida del flujo de luz.
7. Diseñe un método para la determinación del metal de transición presente en las sales
asignada
Primera síntesis: para el Fe+2 con el ligando de cianuro en medio acido diluido forma el color
azul Prusia (precipitado)
Segunda síntesis: Se puede determinar por medio de descomposición térmica a temperaturas
de 113°C pierde las 3 moléculas de agua y a 296°C descompone en un complejo de hierro
+2, el oxalato de potasio y CO2
Para la determinación de Fe+3 se puede realizar por medio del ion SCN- ya que al estar
presente el Fe+3 produce un color rojo sangre o (tess de cloruro férrico)
8. ¿Cuáles son las fuentes minerales comunes de cobre?
RTA: El cobre podemos obtenerlo de diversos alimentos:
Legumbres: lentejas, garbanzos, judías, etcétera.
Alimentos integrales y cereales.
Frutos secos.
Hígado, vísceras.
Marisco.
Ciruelas y pasas.
Hígado, vísceras.
Depósitos naturales
9. ¿Qué aplicaciones tienen los complejos de cobre en las diferentes áreas de la ciencia?
RTA:
está siendo usado en estudios médicos por su inhibición en múltiples
enfermedades (antimicrobial, antiviral, antiinflamatorio, agentes
antitumorales e inhibidores enzimáticos, antioxidante, efectos controladores
en el ADN)
10. ¿Cuáles son los métodos fisicoquímicos sencillos se pueden utilizar para caracterizar
el compuesto formado? ¿Qué tipo de información se obtiene a partir de estos
métodos?
IR: produce un espectro que es la “huella digital” de cada compuesto, en el grafico se
muestran las vibraciones de sus enlaces, al ser expuesta la muestra a la región infrarroja se
produce cambio en las vibraciones de los átomos de la molécula excitándolos, para luego ser
revertidos a su estado original de menor energía emitiendo fotones que capturados por el
detector los convierte en una señal que se transcribe en un espectro.
También podría gustarte
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Laboratorio de Química Inorgánica Ii-Informe I Sal de MöhrDocumento23 páginasLaboratorio de Química Inorgánica Ii-Informe I Sal de MöhrAna CarolinaAún no hay calificaciones
- Compuestos de Coordinacion de Niquel PrácticaDocumento14 páginasCompuestos de Coordinacion de Niquel PrácticaUbariel BecerraAún no hay calificaciones
- Informe 1 Compuestos de Coordinacion deDocumento3 páginasInforme 1 Compuestos de Coordinacion devalentina vargasAún no hay calificaciones
- Informe 2Documento8 páginasInforme 2Fercho Rojas RamosAún no hay calificaciones
- Preparación de AlumbreDocumento8 páginasPreparación de AlumbreKATHERINE LISET ORTIZ PATERNINA ESTUDIANTE ACTIVO100% (1)
- Informe I Compuestos Coordinación 2018 1Documento8 páginasInforme I Compuestos Coordinación 2018 1DanielAngelPeñaBohorquezAún no hay calificaciones
- Soluciones ReguladorasDocumento9 páginasSoluciones ReguladorasJhonatan Albert Alban Narvaez100% (1)
- Informe 6 COMPLEJOS DE COBRE Carol y Paola PDFDocumento15 páginasInforme 6 COMPLEJOS DE COBRE Carol y Paola PDFcarolm1p100% (1)
- Informe Laura RojasDocumento9 páginasInforme Laura Rojaslaura rojasAún no hay calificaciones
- Compuestos de CoordinaciónDocumento41 páginasCompuestos de CoordinaciónAlejandro Briceño100% (1)
- Práctica 2A Sintesis y Caracterización de Un Complejo de CobaltoDocumento6 páginasPráctica 2A Sintesis y Caracterización de Un Complejo de CobaltoJuanpa MosqueraAún no hay calificaciones
- Síntesis de Trioxalatomanganato (III) de PotasioDocumento3 páginasSíntesis de Trioxalatomanganato (III) de PotasioGICELAAún no hay calificaciones
- Cloruro de CobreDocumento5 páginasCloruro de Cobrekrmeli_21100% (3)
- Examen Preliminar P - CLOROANILINADocumento4 páginasExamen Preliminar P - CLOROANILINAAlejandra ZeaAún no hay calificaciones
- Preinforme Practica Isomeros Nitro y NitritoDocumento5 páginasPreinforme Practica Isomeros Nitro y Nitritoferney romerocaperaAún no hay calificaciones
- CobaltoDocumento7 páginasCobaltoLuz Marina Peña MorajxkfjjkkzkfAún no hay calificaciones
- Alquilación de Friedel-CraftsDocumento7 páginasAlquilación de Friedel-CraftsSika CorreaAún no hay calificaciones
- Sintesis y Estudio de Isomeros de Enlace PDFDocumento14 páginasSintesis y Estudio de Isomeros de Enlace PDFjacobo galicinoAún no hay calificaciones
- Preparacin de Anhdrido 9,10-DihidroantracenoDocumento15 páginasPreparacin de Anhdrido 9,10-DihidroantracenoMaribel Urrea Pelayo50% (2)
- Lab.4 OrgDocumento8 páginasLab.4 OrgElvis RenzoAún no hay calificaciones
- Yodometría-Determinación concentración Na2S2O3-hipoclorito sodioDocumento8 páginasYodometría-Determinación concentración Na2S2O3-hipoclorito sodioSthefanía Elizabeth TisalemaAún no hay calificaciones
- Síntesis y Análisis de Un Compuesto de Oxalato de AluminioDocumento5 páginasSíntesis y Análisis de Un Compuesto de Oxalato de AluminioJulian Arango100% (2)
- Práctica 1 Isomería Óptica y GeométricaDocumento3 páginasPráctica 1 Isomería Óptica y Geométricadoblea2Aún no hay calificaciones
- Síntesis e isómeros geométricos de compuestos de CoordinaciónDocumento6 páginasSíntesis e isómeros geométricos de compuestos de CoordinaciónsandraAún no hay calificaciones
- Informe de Complejos de NiquelDocumento2 páginasInforme de Complejos de NiquelMc PiryxAún no hay calificaciones
- Química Analítica Sesion 9Documento29 páginasQuímica Analítica Sesion 9RandleMcmurphiAún no hay calificaciones
- ComplejosDocumento41 páginasComplejosMartin GonzalezAún no hay calificaciones
- Práctica 08 - OxigenoDocumento3 páginasPráctica 08 - OxigenoJ S.TAún no hay calificaciones
- Isomeros FinalDocumento5 páginasIsomeros FinalJohanna GalanAún no hay calificaciones
- Síntesis de cloruro de terc-butilo por reacción SN1Documento6 páginasSíntesis de cloruro de terc-butilo por reacción SN1Eliana picoAún no hay calificaciones
- Practica #4 Metodo de JobDocumento11 páginasPractica #4 Metodo de JobSERGIO ARMANDO BLANCO MERCADOAún no hay calificaciones
- Ácido Cinámico FINALDocumento8 páginasÁcido Cinámico FINALAndres Felipe Vargas GaviriaAún no hay calificaciones
- PermanganometríaDocumento3 páginasPermanganometríaAndrea DexireAún no hay calificaciones
- Teoría Ácidos y Bases Blandos y DurosDocumento2 páginasTeoría Ácidos y Bases Blandos y Durosfama_20Aún no hay calificaciones
- Purificación ácido benzóicoDocumento5 páginasPurificación ácido benzóicoWR SalasAún no hay calificaciones
- Practica 4. IR y AE de Complejos de CuX y MDMSODocumento7 páginasPractica 4. IR y AE de Complejos de CuX y MDMSODavid MstAún no hay calificaciones
- #3-Grupos Puntuales de Simetria PDFDocumento29 páginas#3-Grupos Puntuales de Simetria PDFBielka Pérez ʚïɞ100% (2)
- Labo Cetonas y Aldehidos 5Documento7 páginasLabo Cetonas y Aldehidos 5Alfredo GsAún no hay calificaciones
- Practica 8Documento2 páginasPractica 8Daniel G. Simón M.Aún no hay calificaciones
- Preparacion de Un Coloide - Propiedades Clásicas.Documento7 páginasPreparacion de Un Coloide - Propiedades Clásicas.omariluapAún no hay calificaciones
- 4-Informe (Giraldo, Garzón, Silgado)Documento5 páginas4-Informe (Giraldo, Garzón, Silgado)Daniel Gerardo Silgado CortazarAún no hay calificaciones
- Previo Practica 1 Obtencion de Halogenuros de AlquiloDocumento8 páginasPrevio Practica 1 Obtencion de Halogenuros de AlquiloAlvarado Fernández Juan CarlosAún no hay calificaciones
- Sal de FrémyDocumento1 páginaSal de FrémyArmando MnAún no hay calificaciones
- PRACTICO 5 EstereoquímicaDocumento2 páginasPRACTICO 5 Estereoquímicaariel yana morga0% (1)
- TP NRO 4 labIIDocumento12 páginasTP NRO 4 labIIJose TorreaniAún no hay calificaciones
- Formación y estabilidad de compuestos de coordinaciónDocumento13 páginasFormación y estabilidad de compuestos de coordinaciónandrea yuilanaAún no hay calificaciones
- Determina Fe cementoDocumento2 páginasDetermina Fe cementoAndy FaustoAún no hay calificaciones
- Informe #03 Isomeros GeometricosDocumento7 páginasInforme #03 Isomeros GeometricosJoHana BolañosAún no hay calificaciones
- PRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Documento11 páginasPRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Oscar UrielAún no hay calificaciones
- Recristalización de Alumbre y Sal de CocinaDocumento7 páginasRecristalización de Alumbre y Sal de CocinaMaryin QuimbayaAún no hay calificaciones
- ARGENTOMETRIADocumento6 páginasARGENTOMETRIAJosselyn RemacheAún no hay calificaciones
- Síntesis de acetato de cromo (II) con enlace cuádruple metal-metalDocumento5 páginasSíntesis de acetato de cromo (II) con enlace cuádruple metal-metalAndrea SilvaAún no hay calificaciones
- Obtencion de Acetileno y Propiedades de Alquinos y AlcanosDocumento5 páginasObtencion de Acetileno y Propiedades de Alquinos y AlcanosLuisa ValenciaAún no hay calificaciones
- Isomeros GeometricosDocumento6 páginasIsomeros GeometricosSebastián Tovar Molina100% (1)
- Catalisis Tarea N5Documento4 páginasCatalisis Tarea N5PoolAún no hay calificaciones
- Preinforme N5 INORGANICA 2Documento5 páginasPreinforme N5 INORGANICA 2Angie OrtizAún no hay calificaciones
- Cuestionario Segundo HemisemestreDocumento9 páginasCuestionario Segundo HemisemestreAlejandro SanchezAún no hay calificaciones
- Preparacion de Trioxalato Cromato III de Potasio Trihidratado PDFDocumento7 páginasPreparacion de Trioxalato Cromato III de Potasio Trihidratado PDFJorge LuisAún no hay calificaciones
- Resultados de La Practica 4 de Quimica AnaliticaDocumento6 páginasResultados de La Practica 4 de Quimica AnaliticaGabriela Ramirez100% (1)
- Sesión Síntesis Agosto 19Documento2 páginasSesión Síntesis Agosto 19angieAún no hay calificaciones
- 2 Parcial EspectroDocumento19 páginas2 Parcial EspectroangieAún no hay calificaciones
- 1991-Texto Del Artículo-6768-1-10-20120228 PDFDocumento79 páginas1991-Texto Del Artículo-6768-1-10-20120228 PDFangieAún no hay calificaciones
- 92 402 1 PB PDFDocumento21 páginas92 402 1 PB PDFangieAún no hay calificaciones
- 92 402 1 PB PDFDocumento21 páginas92 402 1 PB PDFangieAún no hay calificaciones
- 174-Texto Del Artículo-9205-1-10-20161127 PDFDocumento21 páginas174-Texto Del Artículo-9205-1-10-20161127 PDFangieAún no hay calificaciones
- SGSST y Marco Legal 123Documento24 páginasSGSST y Marco Legal 123angieAún no hay calificaciones
- Dioses GriegosDocumento3 páginasDioses GriegosangieAún no hay calificaciones
- SOLUCIONARIODocumento4 páginasSOLUCIONARIOFabu Pt100% (1)
- Mezclas y C0mbinaci0nesDocumento5 páginasMezclas y C0mbinaci0neswellinton toribioAún no hay calificaciones
- Compromiso de Quimica 8°Documento1 páginaCompromiso de Quimica 8°Diana Del Pilar Chaustre DuranAún no hay calificaciones
- ESTEQUIOMETRIA-EJERCICIOSDocumento4 páginasESTEQUIOMETRIA-EJERCICIOSpeter100% (2)
- Tipos de electrodos 40cDocumento8 páginasTipos de electrodos 40cArianaLGAún no hay calificaciones
- Purificación Sulfato de Cobre - TP1 Química General e Inorganica I FCEN UBADocumento6 páginasPurificación Sulfato de Cobre - TP1 Química General e Inorganica I FCEN UBAFabricio F. TaringaAún no hay calificaciones
- Unidad Vii A. Cuanti 2019Documento10 páginasUnidad Vii A. Cuanti 2019Jorge SalomonAún no hay calificaciones
- Tablas para Determinar Minerales - FRANZ KEOBELLDocumento66 páginasTablas para Determinar Minerales - FRANZ KEOBELLYuri Jesus V.Aún no hay calificaciones
- 9.2.aceros EspecialesDocumento9 páginas9.2.aceros EspecialesRaul Alfredo Caballero ColmenaresAún no hay calificaciones
- Química del CarbonoDocumento3 páginasQuímica del Carbonoalbeiro dueña sAún no hay calificaciones
- Difluoruro de OxígenoDocumento2 páginasDifluoruro de OxígenoVanellope Sugar RushAún no hay calificaciones
- Lección 7 - Estructura de Algunos VidriosDocumento21 páginasLección 7 - Estructura de Algunos VidriosYuly RodriguezAún no hay calificaciones
- Electrólisis Del FlúorDocumento9 páginasElectrólisis Del FlúorPerlita ValenciaAún no hay calificaciones
- Dorado ElectroliticoDocumento11 páginasDorado ElectroliticoDaniel Humberto Hospina RiosAún no hay calificaciones
- Zincado ElectroliticoDocumento16 páginasZincado ElectroliticoGiancarlo Neyra VerdeAún no hay calificaciones
- Examen - (ACV-S04) Evaluación en Línea 3 - EPDocumento5 páginasExamen - (ACV-S04) Evaluación en Línea 3 - EPJose Carranza VasquezAún no hay calificaciones
- Anexo Estudio de CasoDocumento152 páginasAnexo Estudio de CasoKatherinOrtizAún no hay calificaciones
- Dioxido de CloroDocumento14 páginasDioxido de Clororosa perezAún no hay calificaciones
- Practica de AlcalinidadDocumento11 páginasPractica de AlcalinidadGuillermo Cielo SanchezAún no hay calificaciones
- Manual de Nomenclatura PDFDocumento30 páginasManual de Nomenclatura PDFCristina RamirezAún no hay calificaciones
- TermodinámicaCombustiónDocumento10 páginasTermodinámicaCombustiónLeonardo Daniel Romero VásquezAún no hay calificaciones
- EstequiometriaDocumento8 páginasEstequiometriaStevensAún no hay calificaciones
- Ensayo Al FuegoDocumento4 páginasEnsayo Al FuegoNereida Yesica Olortigue HuamanAún no hay calificaciones
- Producción de Nitrato Potásico - Textos CientíficosDocumento5 páginasProducción de Nitrato Potásico - Textos CientíficosDaru SanAún no hay calificaciones
- Manual de Preparacion de ReactivosDocumento33 páginasManual de Preparacion de ReactivosManuel Cruz ChacollaAún no hay calificaciones
- Tinción Con Hematoxilina EosinaDocumento5 páginasTinción Con Hematoxilina EosinaPablo VilchesAún no hay calificaciones
- Peróxidos y sus aplicacionesDocumento37 páginasPeróxidos y sus aplicacionesdethefayerAún no hay calificaciones
- Elementos químicos mono, di y trivalentesDocumento11 páginasElementos químicos mono, di y trivalentesMauricio YepezAún no hay calificaciones
- Proceso Productivo Cobre Codelco PDFDocumento1 páginaProceso Productivo Cobre Codelco PDFJimmy Junior Blas VenegasAún no hay calificaciones
- Tabla de Valencias, Cationes, Aniones y RadicalesDocumento1 páginaTabla de Valencias, Cationes, Aniones y RadicalesAlvaro RivasAún no hay calificaciones