Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Citocromo Oxidasa
Citocromo Oxidasa
Cargado por
SandraIrkGallardoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Citocromo Oxidasa
Citocromo Oxidasa
Cargado por
SandraIrkGallardoCopyright:
Formatos disponibles
RESUMEN BIBLIOGRAFICO.
ENZIMA CITOCROMO OXIDAZA.
La enzima Citocromo oxidasa pertenece a la clase xido-reductasa
Descripcin
Enzima que cataliza el ltimo paso en la cadena de transporte electrnico. Est formada por
un dmero que se extiende desde la matriz hasta el espacio intermembrana o el citosol,
atravesando la membrana.
Reacciones en las que participa (se indica la ruta metablica):
Precursor/es
Fe+++
La enzima citocromo c oxidasa o complejo IV (nmero EC 1.9.3.1) es una protena
transmembrana que se encuentra incluida en bicapas lipdicas de bacterias y
en mitocondrias. Se trata de la ltima enzima de la cadena de transporte de electrones,
recibiendo un electrn de cada uno de las cuatro molculas de citocromo c; despus, los
transfiere a una molcula de oxgeno, reducindola a dos molculas de agua. Acoplada a
este proceso, se produce una translocacin de protones a travs de la membrana, lo cual
genera un gradiente electroqumico que la enzima ATP sintasa emplea para
sintetizar adenosn trifosfato (ATP).1
La reaccin catalizada por la enzima puede resumirse como sigue (el trmino: 4 H+fuera hace
referencia a protones expulsados al espacio intermembrana mitoncondrial)
4 Fe2+-citocromo c + 8 H+in + O2 4 Fe3+-citocromo c + 2 H2O + 4 H+
ESTRUCTURA.
Estructuralmente, el complejo IV es una protena integral de membrana que incluye
variosgrupos prostticos metlicos as como 13 subunidades, en mamferos. De estas 13,
diez estn codificadas por genes situados en el genoma nuclear y tres en el mitocondrial. El
complejo posee dos grupos hemo, un citocromo a y otro a3, as como dos centros de cobre
(uno denominado CuA y el otro CuB centers.2 En realidad, el citocromo a3 y el CuB forman
un centro binuclear en el cual se produce la reduccin del oxgeno molecular a agua.
El citocromo c, elemento anterior en la cadena de transporte de electrones (que est
reducido mediante el complejo citocromo bc1, tambin denominado complejo III), se une a
la citocromo c oxidasa en un lugar cercano al centro binuclear. Al acercarse, cede un
electrn, se oxida y regresa por tanto a su estado Fe+3. El CuA del complejo IV, que es quien
acepta ese electrn, lo cede a su vez al citocromo a, y ste al centro binuclear citocromo a3CuB. En este ltimo complejo los dos metales, el tomo de hierro y el de cobre, se
encuentran a 4.5 de distancia entre s y coordinan un ion hidrxido completamente
oxidado.
La cristalografa de rayos X arroja una inusual modificacin postraduccional de la
citocromo c oxidasa: el C6 de la Tyr 244 y el -N de la His240 (numeracin del complejo
en bovino). Este enlace es esencial en la acepcin de cuatro electrones del complejo
binuclear, pues son precisos estos cuatro para reducir el O2 a dos molculas de agua. El
mecanismo de reduccin podra estar basado en un estado intermediario perxido, que dara
lugar a la produccin de radicales superxido; la hiptesis ms aceptada es la rpida
reduccin del oxgeno molecular por acepcin de los cuatro electrones, lo que redundara
en la ruptura del enlace oxgeno-oxgeno.3
ALTERACONES GENETICAS.
Defectos que involucran una mutacion que altera la funcionalidad o la estructura de la
enzima, resultan en un desorden metabolico fetal muy fuerte. Estos problemas se
manifiestan en la infancia, y tienen efectos predominantes en tejidos con alta demanda de
energa (el cerebro, msculo, corazn). De entre las enfermedades clasificadas como
mitocondriales, las que son de origen en el ensamblado de la citocromo c oxidasa son las
ms graves.4
INTOXICACION POR CIANURO.
Cianuro (CN-) inhibe de manera competitiva el metabolismo aerbico al unirse al hemo
binuclear de la citocromo oxidasa c (CcO). Nitrito de amilo (C5H11ONO) y nitrito de sodio
(NaNO2) son contrarios a la toxicidad del cianuro en parte por oxidacin de la hemoglobina
en metahemoglobina, la cual entonces recoge el cianuro. Se piensa que la generacin de
mHb es el mecanismo principal por el cual NO2- es antagnico al cianuro. Por el otro lado,
NO2- puede atravesar una biotransformacin para generar oxido ntrico (NO), el cual
entonces se vuelve directamente antagnico a la inhibicin del citocromo oxidasa por
cianuro. En un estudio de antagonismo mediado por nitrito en contra de la inhibicin de la
fosforilacin oxidativa por cianuro fue examinada en clulas dopaminrgicas N27de ratas.
NaNO2 produjo incremento dependiente de tiempo y concentracin de los niveles de NO en
toda la clula y mitocondria. El recogedor de NO, PTIO (2-fenil-4,4,5,5,tetrametilimidazol-1-oxil 3-oxido) revirti este cambio en el incremento mitocondrial y
celular de NO. El NO generado de NaNO2 disminuye el consumo de oxigeno de la clula e
inhibe la actividad de la CcO. PTIO revirti la inhibicin mediada por NO, y as entreg
fuerte evidencia de que NO media la accin de NaNO2. Bajo condiciones similares, KCN
inhibe el estado celular del consumo oxgeno en estado 3 y la actividad de la CcO.
Pretratamiento con NaNO2 revirti la inhibicin tanto para el consumo de oxigeno como
para la actividad de la CcO. El antagonismo del NaNO2 contra el cianuro fue bloqueado por
pretratamiento con el recogedor de NO: PTIO. Con lo que concluyeron en que
NaNO2 antagoniza el cianuro en su inhibicin de la CcO generando NO el cual interacta
directamente con el sitio de accin del KCN a CcO para revertir la toxicidad. In vivo,
adems de esto tambin se forma la mHb como se menciono antes.
Otras anotaciones sobre el mecanismo de inhibicin por NO es que es controlada por el
flujo de electrones a travs de la cadena respiratoria, terminando en un derivado nitrito o
un compuesto nitroso. De relevancia para la patofisiologa celular es que el mecanismo que
conlleva al nitrito, tambin lleva a una degradacin oxidativa, protegiendo a las clulas de
la toxicidad del NO. Tambin es posible la intoxicacin con CO a la cadena respiratoria
mitocondrial en el punto de la CcO, aunque en humanos es algo que aun esta bajo estudios
el grado que esto alcanza. Otro inhibidor son las azidas (N3-), las cuales hasta ahora se han
demostrado, en enzimas bovinas, que potencian la unin de cianuro a la CcO. Otras
anotaciones sobre el mecanismo de inhibicin por NO es que es controlada por el flujo de
electrones a travs de la cadena respiratoria, terminando en un derivado nitrito o un
compuesto nitroso.
FOSFORILACION OXIDATIVA.
Sntesis de ATP impulsada por la transferencia de electrones hacia el O2. ste es el proceso
de transfusin de energa ms importante, junto con la fotofosforilacin, ya que son los
procesos que sintetizan la mayor cantidad de ATP en los organismos aerbicos. Los
electrones van a fluir desde intermediarios catablicos hacia el oxgeno para la formacin
de energa que lleva a la formacin de ATP a partir de ADP y Pi. As, las molculas
formadas en stos procesos se van a reoxidar, generando energa para la sntesis de ATP. La
glucosa en un sistema anaerbico va a formar dos molculas de ATP, NADH y piruvato.
ste piruvato en un sistema aerbico va a transformarse en acetil coA, que en el ciclo del
cido ctrico forma stas molculas transportadoras de electrones ( NADH y FADH2 ), as
como tambin los procesos de oxidacin de aminocidos que van a dar origen a stas
molc. reducidas, la oxidacin de c. grasos y posteriormente stas molculas que entran
tambin en algunos casos al ciclo del cido ctrico, van a entrar a la cadena respiratoria para
formar ATP y reducir al O2 para formar agua, recobrando posteriormente los
transportadores de electrones nuevamente oxidados. La formacin de piruvato ocurre en el
citosol, y stos procesos, tanto el ciclo del c. ctrico, y la oxidacin ocurren en el interior
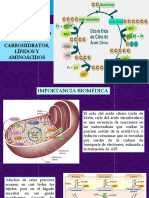
de la mitocondria. Las mitocondrias son organulos presentes en las clulas eucariotas.
Tienen una membrana externa y una interna altamente plegada, formando las crestas
mitocondriales. En el interior est la matriz mitocondrial, donde ocurre la oxidacin y el
ciclo de Krebs. En la membrana interna ocurre la fosforilacin oxidativa y se encuentra la
cadena transportadora de electrones. Entre ambas membranas existe el espacio
intermembrana. En la membrana interna tenemos los complejos que forman la cadena
transportadora de electrones y la enzima que va a formar ATP a partir de ADP y Pi. Existen
algunas enzimas asociadas a la membrana externa que participan en procesos como la
desaturacin de c. grasos, sntesis de fosfolpidos, y posee tambin algunas
monoaminooxidasas que participan en el metabolismo de los diacilgliceroles. En la matriz
mitocondrial estn las enzimas que participan en la oxidacin de los cidos grasos, en la
oxidacin de aminocidos y el complejo piruvato deshidrogensa. La membrana interna es
bastante permeable, sin embargo posee una permeabilidad selectiva a molculas pequeas y
a iones, los que pasan a travs de ella gracias a transportadores especiales. Est formada
aprox. por un 70 % de protenas y un 30% por lpidos, y es probablemente la membrana
biolgica ms rica en protenas. Aproximadamente la mitad de los componentes proteicos
que posee participan tanto en la cadena transportadora de electrones y en la fosforilacin
oxidativa.
BIBLIOGRAFIA
http://www.biopsicologia.net/fichas/fic-23-1.html
http://es.wikipedia.org/wiki/Citocromo_c_oxidasa
http://www.elergonomista.com/biologia/fos.htm
También podría gustarte
- Ciencias Naturales 6 Fisica y Quimica DiaioeducacionDocumento151 páginasCiencias Naturales 6 Fisica y Quimica DiaioeducacionTania Lira100% (1)
- Biología I Tema 3.2.5.3 Cadena RespiratoriaDocumento30 páginasBiología I Tema 3.2.5.3 Cadena RespiratoriaTita Oz100% (1)
- Apuntes Bioquimica Facultad de QuimicaDocumento31 páginasApuntes Bioquimica Facultad de QuimicaLuzAvAún no hay calificaciones
- GRAVEDAD ESPECIFICA GravaDocumento11 páginasGRAVEDAD ESPECIFICA Gravagabi2386Aún no hay calificaciones
- Examen Sustitutorio de BioquimicaDocumento4 páginasExamen Sustitutorio de BioquimicaAlexander RodasAún no hay calificaciones
- Carpeta AsfalticaDocumento20 páginasCarpeta AsfalticaRonny Antonio Quispe Suni100% (2)
- El Ciclo Del Ácido CítricoDocumento38 páginasEl Ciclo Del Ácido CítricoJoel Cruz100% (2)
- Taller EndomembranasDocumento9 páginasTaller EndomembranasPatty Lopez0% (1)
- Cuestionario Biosintesis de AminoacidosDocumento7 páginasCuestionario Biosintesis de AminoacidosLeandro Torres CalabiAún no hay calificaciones
- Lab Organica 13 - Detergentes y JabonesDocumento10 páginasLab Organica 13 - Detergentes y JabonesArmando Ibarra FernandezAún no hay calificaciones
- Ciclo Del Ácido Citrico KrebsDocumento50 páginasCiclo Del Ácido Citrico KrebsAde RendónAún no hay calificaciones
- GlucolisisDocumento26 páginasGlucolisisJhanethMamaniAún no hay calificaciones
- Guia de Repaso de Respiración CelularDocumento3 páginasGuia de Repaso de Respiración CelularIñigo Gómez100% (1)
- Metabolismo CatabolismoDocumento33 páginasMetabolismo CatabolismoFrancis A. Batarse0% (1)
- Ciclo Del Acido CitricoDocumento33 páginasCiclo Del Acido CitricoMabelizethAún no hay calificaciones
- 730E ComponentesDocumento85 páginas730E ComponentesOscar IbacetaAún no hay calificaciones
- Patologias en Revoques y RevestimientosDocumento45 páginasPatologias en Revoques y RevestimientosDavid Fernando Heredia Astete50% (2)
- T7. Cadena Respiratoria-CLAVDocumento53 páginasT7. Cadena Respiratoria-CLAVPaolo Gianfranco Luna Victoria GutierrezAún no hay calificaciones
- Tema 2. - Vía de Las Pentosas FosfatoDocumento9 páginasTema 2. - Vía de Las Pentosas FosfatoandrearosescarAún no hay calificaciones
- Serie 2° y 3° Ley de La TermodinamicaDocumento13 páginasSerie 2° y 3° Ley de La TermodinamicaSaul Morales100% (1)
- Amortiguadores FisiologicosDocumento11 páginasAmortiguadores Fisiologicosrojasjoel100% (1)
- Polisacaridos y ProteoglucanosDocumento8 páginasPolisacaridos y ProteoglucanosJosé Refugio Jaramillo PonceAún no hay calificaciones
- GA3 - Respiración CelularDocumento9 páginasGA3 - Respiración CelularPilin PilloAún no hay calificaciones
- Metabolismo Lìpidos 21-2Documento90 páginasMetabolismo Lìpidos 21-2Joel PMAún no hay calificaciones
- Perdidas de Calor en Tuberias Aisladas y Sin AislarDocumento10 páginasPerdidas de Calor en Tuberias Aisladas y Sin AislarMiguel Deodato Martínez LópezAún no hay calificaciones
- CalcioDocumento3 páginasCalcioflorenciarenieroAún no hay calificaciones
- Metabolismo. CH Química, GlicólisisDocumento96 páginasMetabolismo. CH Química, GlicólisisEnrique Avila100% (1)
- El Ciclo de KrebsDocumento3 páginasEl Ciclo de KrebsYair DanAún no hay calificaciones
- Ex Bioq Global 2012 RESUELTODocumento5 páginasEx Bioq Global 2012 RESUELTOVictor VitoriaAún no hay calificaciones
- Guia de Glucolisis y FermentaciónDocumento4 páginasGuia de Glucolisis y FermentaciónCesia HernándezAún no hay calificaciones
- GlucógenoDocumento5 páginasGlucógenoPaúl NúñezAún no hay calificaciones
- Presentacion. Ciclo CelularDocumento36 páginasPresentacion. Ciclo CelularRobertoMaciasAún no hay calificaciones
- Apuntes Ciclo CelularDocumento5 páginasApuntes Ciclo CelularCristina Sanz100% (1)
- VacuolasDocumento2 páginasVacuolasrussel100% (1)
- Taller de Glucolisis y Ciclo de KrebsDocumento7 páginasTaller de Glucolisis y Ciclo de KrebsJhonatan LujanAún no hay calificaciones
- Ciclo de KrebsDocumento5 páginasCiclo de KrebsAndresMendozaJimenezAún no hay calificaciones
- Via de La Pentosa-FosfatoDocumento18 páginasVia de La Pentosa-FosfatoMarieta MOreira PincayAún no hay calificaciones
- Via de Las Pentosas Fosfato y Nadph (Harvey Unidad 13)Documento8 páginasVia de Las Pentosas Fosfato y Nadph (Harvey Unidad 13)IlderAlvaradoAún no hay calificaciones
- Lípidos Apuntes PDFDocumento12 páginasLípidos Apuntes PDFProf. Víctor M. VitoriaAún no hay calificaciones
- Energia y Metabolismo, Glucolisis y FermentacionDocumento32 páginasEnergia y Metabolismo, Glucolisis y FermentacionMay ZamoraAún no hay calificaciones
- Metabolismo Del GlucógenoDocumento20 páginasMetabolismo Del Glucógenoqlawdya123Aún no hay calificaciones
- Cadena de Trasporte y Fosforilacion KKDocumento32 páginasCadena de Trasporte y Fosforilacion KKUriel AlvaradoAún no hay calificaciones
- Ciclo Del Acido Citrico1Documento62 páginasCiclo Del Acido Citrico1Bibiana Andrea PerezAún no hay calificaciones
- Presentacion de Cadena de Transporte de Electrones (Exposicion)Documento10 páginasPresentacion de Cadena de Transporte de Electrones (Exposicion)Felipe De Jesus NarvaezAún no hay calificaciones
- Cadena RespiratoriaDocumento5 páginasCadena RespiratoriaChristian Mendoza Esquivel100% (1)
- Retículo Endoplásmico Pi MZVDocumento29 páginasRetículo Endoplásmico Pi MZVCool BoyLVAún no hay calificaciones
- Replicación, Transcripción, TraducciónDocumento35 páginasReplicación, Transcripción, Traducciónruth escAún no hay calificaciones
- Expo Catabolismo y AnabolismoDocumento27 páginasExpo Catabolismo y AnabolismoMariana CCAún no hay calificaciones
- ADN y ARN, Resumen, Parte 1Documento4 páginasADN y ARN, Resumen, Parte 1Evelyn Nicols Aedo SanchezAún no hay calificaciones
- Manual de Neuro Que Todo Lo Sabe!Documento143 páginasManual de Neuro Que Todo Lo Sabe!Javier Ignacio Urrutia FigueroaAún no hay calificaciones
- Metabolismo SolucionesDocumento22 páginasMetabolismo SolucionesMario De Los SantosAún no hay calificaciones
- Bloque VDocumento24 páginasBloque VMarilin Lopez100% (1)
- Ejercicios Sobre Procesos MetabolicosDocumento17 páginasEjercicios Sobre Procesos MetabolicosMariana D ́OnofrioAún no hay calificaciones
- Citoesqueleto y Motilidad CelularDocumento33 páginasCitoesqueleto y Motilidad CelularFrancisco Hidalgo50% (2)
- Ciclo de KrebsDocumento48 páginasCiclo de KrebsVerónica LoaizaAún no hay calificaciones
- Sistema de EndomembranasDocumento27 páginasSistema de EndomembranasSofía TorresAún no hay calificaciones
- LIPIDOSDocumento5 páginasLIPIDOSVC?Aún no hay calificaciones
- Theodor SchwannDocumento7 páginasTheodor SchwannDavid JofreAún no hay calificaciones
- 12) Respiración CelularDocumento18 páginas12) Respiración CelularCesar Gianfranco Morales CamposAún no hay calificaciones
- Cancion Del Ciclo de KrebsDocumento1 páginaCancion Del Ciclo de KrebsTahic PAún no hay calificaciones
- Cadena Respiratoria y Fosforilacion OxidativaDocumento21 páginasCadena Respiratoria y Fosforilacion OxidativaViridiana GonzalezAún no hay calificaciones
- Resumen Ciclo de KrebsDocumento2 páginasResumen Ciclo de KrebsJ Andres WolfAún no hay calificaciones
- Test Opciones Múltiples Agua y Sales Minerales 1Documento2 páginasTest Opciones Múltiples Agua y Sales Minerales 1Prof. Víctor M. VitoriaAún no hay calificaciones
- Via de Las PentosasDocumento25 páginasVia de Las PentosasHKlaudyAún no hay calificaciones
- Organización Química de La CélulaDocumento78 páginasOrganización Química de La CélulaIsmael RamirezAún no hay calificaciones
- Secme 22442Documento32 páginasSecme 22442Erick Adrián Ramírez SantosAún no hay calificaciones
- Ubicación de La ClorofilaDocumento3 páginasUbicación de La ClorofilaTahic PAún no hay calificaciones
- MitocondriaDocumento5 páginasMitocondriaKevin Bravo SanchezAún no hay calificaciones
- Tabla Clasificacion SucsDocumento1 páginaTabla Clasificacion SucsPaola BravoAún no hay calificaciones
- Compuestos Orgánicos: Uso de ModelosDocumento26 páginasCompuestos Orgánicos: Uso de ModelosAlejandra Janice Juárez CabreraAún no hay calificaciones
- Propiedades Fisicas de Las Sustancias Ionicas, Covalentes, y Metalicas.Documento38 páginasPropiedades Fisicas de Las Sustancias Ionicas, Covalentes, y Metalicas.Bryan Fernando MurilloAún no hay calificaciones
- Vibrocompactador AmmanDocumento13 páginasVibrocompactador AmmanCARLOSAún no hay calificaciones
- Transformadores DispositivosDocumento11 páginasTransformadores DispositivosLuis AlvarezAún no hay calificaciones
- PR-041 Procedimiento Manejo de Residuos PeligrososDocumento18 páginasPR-041 Procedimiento Manejo de Residuos Peligrososcinthia nadalAún no hay calificaciones
- Diseño de Sistemas EstructuralesDocumento15 páginasDiseño de Sistemas EstructuralesMarlene Bernal SantosAún no hay calificaciones
- MANGANESO Luis GilDocumento4 páginasMANGANESO Luis GilRafael Calderon SilvaAún no hay calificaciones
- Catalogo GracoDocumento12 páginasCatalogo GracoHeather MurphyAún no hay calificaciones
- Guías de Trabajos Prácticos de FisicoquímicaDocumento30 páginasGuías de Trabajos Prácticos de FisicoquímicaMelina AlvezAún no hay calificaciones
- Anexo 4Documento10 páginasAnexo 4Alex Castro Escobar0% (1)
- Concretec. Ficha Técnica (2018)Documento8 páginasConcretec. Ficha Técnica (2018)Yisel AyalaAún no hay calificaciones
- Físico y Matemático ItalianoDocumento5 páginasFísico y Matemático ItalianoSantiago AlejandroAún no hay calificaciones
- Laboratorio 3 Calorimetria Fisica 2 FinalDocumento7 páginasLaboratorio 3 Calorimetria Fisica 2 FinalMax MelgarejoAún no hay calificaciones
- Resumen Chips de Yuca 2Documento25 páginasResumen Chips de Yuca 2Francisco SalasAún no hay calificaciones
- Manual de Mantenimiento Tableros de Distribución EléctricaDocumento19 páginasManual de Mantenimiento Tableros de Distribución Eléctricajuan david lopezAún no hay calificaciones
- 05 - Balance de Ecuaciones y Balance de Óxidos BásicosDocumento7 páginas05 - Balance de Ecuaciones y Balance de Óxidos Básicosgomeeztobi4ssAún no hay calificaciones
- Ciencias Sociales El SolDocumento5 páginasCiencias Sociales El Solramiro condoriAún no hay calificaciones
- Flujograma de Las Propiedades Quimicas de Los Carbohidratos, Universidad de AntioquiaDocumento1 páginaFlujograma de Las Propiedades Quimicas de Los Carbohidratos, Universidad de Antioquiam.suarezAún no hay calificaciones
- 1623 - Manuale Compressori 1 2 3 Cil 02 2023Documento20 páginas1623 - Manuale Compressori 1 2 3 Cil 02 2023Jorge ValenzuelaAún no hay calificaciones
- Ejerccios de Quimica Estequiometria Analitica EtcDocumento53 páginasEjerccios de Quimica Estequiometria Analitica EtcMaricielo KarolAún no hay calificaciones
- Puente CochalánDocumento16 páginasPuente CochalánAldair Zeña SamaméAún no hay calificaciones