Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reglas de Home Rothery
Cargado por
Juan Mejia BriseñoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Reglas de Home Rothery
Cargado por
Juan Mejia BriseñoCopyright:
Formatos disponibles
Reglas de Hume Rothery
Compuestos electrnicos.
Hume-Rothery observ que en el caso de las aleaciones de un metal del grupo IB (Cu, Ag, Au) con
un metal o elemento de los grupos IIB, IIIB, IVB, y a veces VB, las diversas faces intermetlicas se
suceden siempre en el mismo orden. Admitiendo que el componente IIB, .., etc., aporte a la red
un nmero de electrones igual a su electrovalencia positiva y el componente IB un electrn por
tomo, se tendr, si la fase contiene x tomos % del elemento IB y (100 x)% del otro
componente, de valencia electropositiva v, que la concentracin electrnica en electrones por
tomo es igual a
[ ( )]
As se encuentra 1.5 para , 21/13 para y 7/4 para . Se ve que al disolver un nmero creciente
de tomos IIB.., etc., en el componente IB, no se pasa de la relacin de aproximadamente 1.4
electrones por tomo en el caso de las soluciones slidas por sustitucin. La fase aparece con 21
electrones para 14 tomos y luego la con 21 electrones para 13 tomos y finalmente la con 21
electrones para 12 tomos. Ekman ha extendido estos resultado a las aleaciones de un metal del
grupo VIII o de las triadas Fe, Co, Ni; Ru, Rh, Pd; Os, Ir, Pt, con un metal de los grupos IIB, IIIB ,
etc., admitiendo que la aportacin electrnica del primer metal a la red es nula.
Ejemplo:
: CuZn, AgZn, AgCd, AgMg, AuZn, AuCd, MnZn3, FeAl, CoAl, NiAl, Cu5Sn
: Cu5Zn8, Ag5Nz8, Au5Zn8, Cu3Al, Cu31Si8, Cu31Sn8, Fe5Zn21, Pt5Zn21
: CuZn3, AuCd3, Ag5Al3, Cu3Si, Cu3Sn, MnZn7, FeZn7
Se advierte que el manganeso puede representar el papel de los metales del grupo VII.
Esta regla, que inicialmente fue emprica, se explica mediante las teoras modernas del estado
metlico: los compuestos que poseen determinada estructura que corresponde a una
determinada concentracin electrnica se denominan an compuestos electrnicos. Sus
propiedades muestran bien la diferencia que existe entre los compuestos intermetlicos y los
compuestos qumicos corrientes. En efecto, la analoga qumica entre dos metales, B y B, no
significa necesariamente que exista analoga en sus estructuras, incluso si las composiciones de las
fases, por ejemplo en las aleaciones del cobre y de los metales Cd y Zn, qumicamente muy
parecidos, sean idnticas: Cu5Zn8 y Cu5Cd8. En la malla cbica , los 52 tomos estn divididos en
4 grupos de posiciones equivalentes que contienen respectivamente 8, 8, 12 y 24 tomos; en el
caso del Cu5 Zn8 para esos grupos se tienen 8 + 12 tomos de Cu y para los otros de 8 + 24 tomos
de Zn, dispuestos ordenadamente. En el caso del Cu5Cd8, por el contrario, se tienen, por una
parte, 8 + 8 tomos de Cu 12 + 24 posiciones ocupadas por 32 tomos de Cd y 4 tomos de Cu
repartidos en forma desordenada.
Las aleaciones Cu-Cd difieren adems de las aleaciones Cu-Zn por la existencia de fases
suplementarias, ms complejas que las fases , y .
La estructura (en este caso ) no depende sino dbilmente de la naturaleza de los tomos que
ocupan una posicin determinada en la red: el tipo de red depende esencialmente de la
concentracin electrnica y no tanto de la composicin estequiomtrica. Sin embargo, Laves ha
demostrado que para ciertas fases de composicin AB2, la influencia de las dimensiones de los
tomos puede llegar a ser preponderante, la estructura que resulta depende de la relacin RA/RB.
Las fases intermetlicas, sean ordenadas o desordenadas, son en general duras y frgiles.
Notemos finalmente que el silicio, elemento de carcter predominante no metlico del grupo IV B,
unido a un verdadero metal como el magnesio, forma compuestos del tipo Mg2Si y una serie de
fases intermedias, que son duras y refractarias y cuya formacin al enfriar bruscamente aleaciones
industriales que contienen Si y Mg (duraluminios) aumenta considerablemente su dureza y la
carga de ruptura (el enfriamiento brusco se denomina en este caso temple estructural).
El sistema Mg-Si no contiene ms que un solo compuesto, Mg2Si, cuya estructura corresponde a
una red C.F. con el magnesio forma un eutctico que funde a 637.6 C y contiene 1.5 % d tomos
de Si.
Con el Si, el Si Mg2 forma un eutctico que funde a 960 C y contiene aproximadamente 55% de Si.
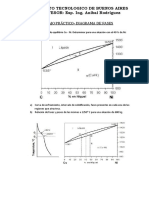
El diagrama del sistema Si-Mg se presenta en la figura 2.12
Las aleaciones Mg-Si que contiene aproximadamente 2% de Si poseen una carga de ruptura
prxima a los 25 kgf * mm2, superior a la del Mg, y un alargamiento relativo del 5% para esa
carga, muy inferior al valor correspondiente al Mg.
Las reglas de Hume-Rothery representan un conjunto de condiciones que deben cumplir las
soluciones slidas metlicas, para que tenga lugar la miscibilidad total entre los distintos
componentes. Dichas reglas establecen que:
1. La diferencia entre los radios atmicos debe ser inferior al 15 por 100.
2. La electronegatividad (capacidad del tomo para atraer un electrn) debe ser similar
3. Los dos metales deben poseer la misma estructura cristalina.
4. La valencia con la que actan debe ser la misma.
Ejemplo:
Si por ejemplo consideramos una solucin de Si en Al podemos averiguar a priori el grado
aproximado de solubilidad que presentar dicha solucin. Sabemos que:
Al Si
Radio atmico = 0,143 nm Radio atmico = 0,117 nm
Estructura cristalina = FCC Estructura cristalina =
estructura del diamante
(FCC con base)
Valencia = +3 Valencia = -4 DIFERENTE
Los tomos tienen una
electronegatividad similar
Los tomos tienen una
electronegatividad similar
No es la misma
Conclusin: Como podemos observar la solucin de Si en Al viola las reglas 1,3 y 4, es por esto que
no nos sorprender saber que el Si slo es soluble en Al en una proporcin inferior al 2%
(porcentaje atmico).
Miscibilidad: Miscibilidad es la habilidad de dos o ms sustancias lquidas para mezclarse entre s y
formar una o ms fases, o sea, mezcla es el conjunto de dos o ms sustancias puras.
=
=
=
La regla de que la relacin entre el nmero de electrones de valencia con el nmero de tomos en
una fase dada de un compuesto de electrones depende slo de la fase, y no en los elementos que
componen los compuestos.
Reglas de Hume- Rothery
1.- Elementos o compuestos deben presentar la misma estructura cristalina
(2 compuestos isoestructurales pueden no dar sol. Sl.)
2.- tomos o iones con radios similares
Diferencia -< 15 % metlicos
-< 30 % en inicos
3.- Deben tener electronegatividades similares
4.- Deben tener el mismo estado de oxidacin. (cermicos)
- Si cumplen todas => no necesariamente solubilidad total
- Si se cumple alguna condicin => solubilidad parcial
http://ocw.uc3m.es/ciencia-e-oin/tecnologia-de-materiales-industriales/material-de-clase-
1/Tema3-Defectos_los_materiales.pdf (28 de agosto de 2014)
Enuncie las reglas de Hume-Rothery y explique su significado. Se pueden aplicar a sistemas
cermicos?
Factor tamao:
Los tomos o iones deben tener un tamao semejante, con una diferencia de radio atmico no
mayor a 15%, para minimizar la deformacin de la red.
Estructura cristalina:
Los materiales deben tener la misma estructura cristalina; de lo contrario, se llegara a un punto en
el que se presenta una transicin de una fase a otra con una estructura distinta.
Valencia
Los iones deben tener la misma valencia; de no ser as, la diferencia de electrones de valencia
impulsa la formacin de compuestos, no de soluciones.
Electronegatividad:
Los materiales deben tener ms o menos la misma electronegatividad, de lo contrario se forman
compuestos.
3.
Cmo pueden los sistemas cermicos formar soluciones slidas?
Cuando elementos de estructura similares forman una fase qumicamente homognea. Tambin
cuando tienen estructuras cristalinas, radios inicos y valencia similares
http://es.scribd.com/doc/80942726/Ciencia-3
Objetivo de estudiar las Reglas de Home Rothery
Analizar como un sistema cristalino puede formar soluciones slidas en sistemas cermicos, se
deben satisfacer ciertas condiciones conocidas como Reglas de Hume Rothery.
Conclusiones:
Las reglas de Hume-Rothery representan un conjunto de condiciones que deben cumplir las
soluciones slidas.
Reglas De Hume Rothery
Objetivo:
Conocer las condiciones que deben cumplir una aleacin o un sistema cermico para que tenga
solubilidad slida ilimitada.
Reglas, las cuales son tericas
1.- Factor de tamao: los tomos o los iones deben tener tamao semejante, con una diferencia
de radio atmico no mayor al 15 %, para minimizar la deformacin de la red, es decir, minimizar, a
nivel atmico, las desviaciones causadas en las distancias interatmicas.
2.- Estructura cristalina: Los materiales deben tener la misma estructura cristalina; de lo contrario,
se llegar a un punto en el que se presenta una transicin de una fase a otra con una estructura
distinta.
3.- Valencia: los iones deben tener la misma valencia; de no ser as, la diferencia de electrones de
valencia impulsa la formacin de compuestos, no de soluciones.
4.- Electronegatividad: los tomos deben tener ms o menos la misma electronegatividad.
La electronegatividad es la afinidad hacia los electrones. Si las electronegatividades son
apreciablemente distintas, se forman compuestos, como cuando los iones sodio y cloro se
combinan y forman cloruro de sodio.
Estructura del MgO
Ejemplo
Reglas Hume Rothery para
KCl
K Cl
Diferencia de radio
atmico no mayor al 15 %,
2.314
0.905
Deben tener la misma
estructura cristalina
BCC CS cubicas
Los iones deben tener la
misma valencia
1+
1- Igual
los tomos deben tener la
misma electronegatividad
Menor
electronegatividad
Mayor
electronegatividad
No es la misma,
muy diferente
Conclusin: Como podemos observar la solucin de K en Cl viola las reglas 1 y 4,
Reglas Hume Rothery para
KCl
K Cl
Diferencia de radio
atmico no mayor al 15 %,
2.314
0.905
Deben tener la misma
estructura cristalina
BCC CS cubicas
Los iones deben tener la
misma valencia
1+
1- Igual
los tomos deben tener la
misma electronegatividad
Menor
electronegatividad
Mayor
electronegatividad
No es la misma,
muy diferente
Ejemplo:
Soluciones slidas cermicas de MgO
Puede aadirse NiO al MgO para producir una solucin slida. Qu otros sistemas cermicos es
probable que exhiban una solubilidad slida de 100% con MgO?
En este caso, se deben considerar aditivos de xido que tengan cationes metlicos con la misma
valencia y radio atmico que los cationes magnesio. La valencia del ion magnesio es de +2 y su
radio inico es de 0.66 . A partir del apndice B, algunas otras posibilidades en las que el catin
tiene una valencia de +2 incluyen las siguientes:
r (A)
[
]
Estructura Cristalina
Cd
+2
en CdO
47 NaCl
Ca
+2
en CaO
50 NaCl
Co
+2
en CoO
9 NaCl
Fe
+2
en FeO
12 NaCl
Sr
+2
en SrO
70 NaCl
Zn
+2
en ZnO
12 NaCl
Conclusiones:
Las reglas de Hume Rothery son necesarias pero no suficientes para determinar la solubilidad
slida ilimitada.
Definiciones
También podría gustarte
- Reglas de SolubilidadDocumento1 páginaReglas de SolubilidadManuel TecuaAún no hay calificaciones
- Reglas de Hume-RotheryDocumento1 páginaReglas de Hume-Rotherymanuel.carreon11Aún no hay calificaciones
- Transformacion MasivaDocumento8 páginasTransformacion MasivaCristián Andrés Vernet JaraAún no hay calificaciones
- Clase 8 Diagramas de FasesDocumento37 páginasClase 8 Diagramas de FasesJose BallesteroAún no hay calificaciones
- Latones RojosDocumento41 páginasLatones RojosAlejandra CedilloAún no hay calificaciones
- Transferencia de Masa Por ElectrodeposiciónDocumento15 páginasTransferencia de Masa Por ElectrodeposiciónBryan Martínez0% (1)
- Diagrama Hierro CobreDocumento5 páginasDiagrama Hierro Cobrevioleta molleturoAún no hay calificaciones
- Clase 18 Diagrama de Equilibrio EutecticoDocumento19 páginasClase 18 Diagrama de Equilibrio EutecticoJOSE VALENTIN FLORES RODRIGUEZAún no hay calificaciones
- Procesos de Refinacion SecundariaDocumento1 páginaProcesos de Refinacion SecundariaLuis100% (1)
- Procesos de Manufactura Preguntas de Repaso 4,5,6Documento9 páginasProcesos de Manufactura Preguntas de Repaso 4,5,6CarlosAlegriaLopezAún no hay calificaciones
- Curvas de EnfriamientoDocumento12 páginasCurvas de EnfriamientoFelix Javier Yepez Aguirre56% (9)
- Ingeniería en Materiales: Transiciones de FasesDocumento58 páginasIngeniería en Materiales: Transiciones de FasesRuiz Ramírez Juan AntonioAún no hay calificaciones
- Aputes de SolidifaciónDocumento37 páginasAputes de SolidifaciónCaballero RrzAún no hay calificaciones
- Segundo Reporte de Laboratorio de Química Inorgánica 1Documento6 páginasSegundo Reporte de Laboratorio de Química Inorgánica 1Anonymous NB1U5izAún no hay calificaciones
- Procesos de AceraciónDocumento12 páginasProcesos de AceraciónJorge HernandezAún no hay calificaciones
- Ensayo de Materiales: Defectos e ImperfeccionesDocumento21 páginasEnsayo de Materiales: Defectos e ImperfeccionesAlexis100% (1)
- Defectos en Estructuras CristalinasDocumento21 páginasDefectos en Estructuras CristalinasEsteban100% (1)
- Fundición Tarea 1 (2023-2)Documento4 páginasFundición Tarea 1 (2023-2)Ariadna VeraAún no hay calificaciones
- Estructuras MetalográficasDocumento8 páginasEstructuras MetalográficasErick Joel ClaudioAún no hay calificaciones
- Organizacion AtomicaDocumento43 páginasOrganizacion AtomicaGermán Edilberto50% (2)
- Diagrama de Fases CobreDocumento16 páginasDiagrama de Fases CobreMaria CuyaAún no hay calificaciones
- Cuadro Comparativo de CorrosionDocumento6 páginasCuadro Comparativo de CorrosionJuan Alejandro Herrera Huitron DSAún no hay calificaciones
- FCC y BCC FinalDocumento28 páginasFCC y BCC FinalOswaldo CarreonAún no hay calificaciones
- DiagramadefasesDocumento43 páginasDiagramadefasesquimicocad9891Aún no hay calificaciones
- Triptico MaterialesDocumento2 páginasTriptico MaterialesAnais DiazAún no hay calificaciones
- Formado de Metales y Trabajo Con LáminaDocumento11 páginasFormado de Metales y Trabajo Con LáminaLindo Pescadito100% (1)
- Informe 10 Fisicoquímica A IIDocumento20 páginasInforme 10 Fisicoquímica A IIFabianCcahuanaAymaAún no hay calificaciones
- Estructuras de Tipo AX, AmXnDocumento15 páginasEstructuras de Tipo AX, AmXncristiangggAún no hay calificaciones
- Diagramas de FaseDocumento41 páginasDiagramas de FaseHugo'SAún no hay calificaciones
- Imperfección de Los MaterialesDocumento7 páginasImperfección de Los MaterialesDaniel Mamani TiradoAún no hay calificaciones
- Capítulo 15Documento54 páginasCapítulo 15victor llallahu huamaniAún no hay calificaciones
- Taller Número 7 - MaterialesDocumento4 páginasTaller Número 7 - Materialeslina sofiaAún no hay calificaciones
- 4.8 Gibbs Duhem AplicacionDocumento18 páginas4.8 Gibbs Duhem AplicacionJose Demons Peña CarvajalAún no hay calificaciones
- Tema 5 - Difusión en SólidosDocumento20 páginasTema 5 - Difusión en Sólidosllll.cccAún no hay calificaciones
- Transformaciones en Materiales Amorfos y Por Condensacion PDFDocumento19 páginasTransformaciones en Materiales Amorfos y Por Condensacion PDFLeonivan Urbina AlmendraAún no hay calificaciones
- Constituyentes de Los AcerosDocumento3 páginasConstituyentes de Los Acerosandresandres83660100% (1)
- Ejercicios de Dislocaciones 2015Documento18 páginasEjercicios de Dislocaciones 2015Giancarlo Quevedo RodríguezAún no hay calificaciones
- Presentación 5 Difusión AtómicaDocumento38 páginasPresentación 5 Difusión AtómicaGustavo BarreraAún no hay calificaciones
- Circuitos MagnéticosDocumento9 páginasCircuitos Magnéticoscamila beltranAún no hay calificaciones
- Materiales MagneticosDocumento26 páginasMateriales MagneticosYessenia Huachaca CasquinaAún no hay calificaciones
- Diagramas de FaseDocumento18 páginasDiagramas de FaseMrhawks0991Aún no hay calificaciones
- TRABAJO PRÁCTICO Diagrama de FasesDocumento9 páginasTRABAJO PRÁCTICO Diagrama de FasesRodriguezAnibalAdrianAún no hay calificaciones
- Pila Galvanica Practica N 3Documento5 páginasPila Galvanica Practica N 3Katita ChascaAún no hay calificaciones
- Las Cajas Eléctricas y Sus AplicacionesDocumento10 páginasLas Cajas Eléctricas y Sus AplicacionesJordan MéndezAún no hay calificaciones
- Askeland Problemas Resueltos 4a EdDocumento4 páginasAskeland Problemas Resueltos 4a EdAldo MatusAún no hay calificaciones
- Tratamientos TermicosDocumento7 páginasTratamientos TermicosJorgeAntonioNegretMAún no hay calificaciones
- DF 04 Sistemas Binarios EutecticosDocumento26 páginasDF 04 Sistemas Binarios EutecticosLUIS ENRIQUE VILCA ESPINOZAAún no hay calificaciones
- Tema2 EnlaceAtomicoDocumento47 páginasTema2 EnlaceAtomicoMabel Pezo MeléndezAún no hay calificaciones
- Síntesis de Una PerovskitaDocumento6 páginasSíntesis de Una PerovskitaDiana LopezAún no hay calificaciones
- Ud11 - Estructura de Las Aleaciones PDFDocumento20 páginasUd11 - Estructura de Las Aleaciones PDFnagola10Aún no hay calificaciones
- Propiedades de Los Polvos MetálicosDocumento7 páginasPropiedades de Los Polvos MetálicosJose VargasAún no hay calificaciones
- Sistemas Peritecticos y PeritectoidesDocumento17 páginasSistemas Peritecticos y PeritectoidesAguilar JuanjoAún no hay calificaciones
- Fricción en Un Fluido y Transferencia de CalorDocumento11 páginasFricción en Un Fluido y Transferencia de CalorRonald AlbaradoAún no hay calificaciones
- A4 CAPÍTULO II 85a137 SISTEMAS BINARIOSDocumento53 páginasA4 CAPÍTULO II 85a137 SISTEMAS BINARIOSNegro YepezAún no hay calificaciones
- Exfq1 Enlace Quimico SolDocumento4 páginasExfq1 Enlace Quimico SolVeronica Simon OteroAún no hay calificaciones
- U5 IntDocumento27 páginasU5 IntLucas TorresAún no hay calificaciones
- 04 AleacionesDocumento27 páginas04 AleacionesPérez Domm EsaúAún no hay calificaciones
- Concepto de Enlace QuímicoDocumento4 páginasConcepto de Enlace QuímicoCarlos Emilio Castillo GuzmanAún no hay calificaciones
- Trabajo Práctico N2 .OcxDocumento11 páginasTrabajo Práctico N2 .OcxJoaquín MaliziaAún no hay calificaciones
- Formato de Ruta FormativaDocumento3 páginasFormato de Ruta FormativaJuan Mejia BriseñoAún no hay calificaciones
- Actividad 3Documento13 páginasActividad 3Juan Mejia BriseñoAún no hay calificaciones
- Cap 10 Chang2Documento12 páginasCap 10 Chang2Juan Mejia Briseño80% (20)
- Cap 10 ChangDocumento8 páginasCap 10 ChangJuan Mejia BriseñoAún no hay calificaciones
- Teoría de Enlace-Valencia (TEV)Documento26 páginasTeoría de Enlace-Valencia (TEV)Maik MendozaAún no hay calificaciones
- Unidad 1 CorregidaDocumento140 páginasUnidad 1 CorregidaChristian Sandokan de Larriva0% (1)
- Cuadernillo Bloque 1 - Sistemas Materiales y Estructura Atómica (1° Parte)Documento28 páginasCuadernillo Bloque 1 - Sistemas Materiales y Estructura Atómica (1° Parte)simon tieri hilmanAún no hay calificaciones
- ISOTOPOSDocumento9 páginasISOTOPOSwaldo briozoAún no hay calificaciones
- Tecnicas de CaracterizacionDocumento96 páginasTecnicas de CaracterizacionDianita DeviaAún no hay calificaciones
- Principios Basicos de RadiactividadDocumento111 páginasPrincipios Basicos de RadiactividadOmar Suarez OquendoAún no hay calificaciones
- Lectura Atomos y MoleculasDocumento14 páginasLectura Atomos y MoleculasLei100% (1)
- Leyes Fundamentales de La Quimica o Teoría AtómicaDocumento11 páginasLeyes Fundamentales de La Quimica o Teoría AtómicaYoel GutiérrezAún no hay calificaciones
- Universidad Del Valle Examen Unidad 2Documento2 páginasUniversidad Del Valle Examen Unidad 2Jorgito Bruno Mars EspejoAún no hay calificaciones
- Segunda Cartilla de TalleresDocumento37 páginasSegunda Cartilla de TalleresJohn EliasAún no hay calificaciones
- Carpeta de Recuperación - MarcoDocumento29 páginasCarpeta de Recuperación - MarcoYonathan Antonio Rios FerrelAún no hay calificaciones
- Antología Ciencias, Enfásis en Química.Documento48 páginasAntología Ciencias, Enfásis en Química.Cristian Enrique Torres Rodriguez75% (4)
- Guia Comprension Lectora Final - para CombinarDocumento6 páginasGuia Comprension Lectora Final - para CombinarprechochaAún no hay calificaciones
- Mario Quevedo Ribera Práctico Nro 1 ICP 413Documento12 páginasMario Quevedo Ribera Práctico Nro 1 ICP 413Mario Quevedo RiberaAún no hay calificaciones
- Materiales Semiconductores y La Junta PNDocumento18 páginasMateriales Semiconductores y La Junta PNArmando M. Díaz AlvaradoAún no hay calificaciones
- Química OrgánicaDocumento2 páginasQuímica OrgánicaZaray HuertasAún no hay calificaciones
- Silabo Quimica GeneralDocumento7 páginasSilabo Quimica GeneralAndy RojasAún no hay calificaciones
- QuimicaDocumento9 páginasQuimicakelly julieth quintero vidalAún no hay calificaciones
- Material de Estudio, Primer Parcial - Ciencia de Los Materiales. Ing. Mecanica.Documento30 páginasMaterial de Estudio, Primer Parcial - Ciencia de Los Materiales. Ing. Mecanica.FREDY SANTIAGO CHACAJ GARCIAAún no hay calificaciones
- Parte Determinacion de Hierro en Jarabe AntianemicoDocumento4 páginasParte Determinacion de Hierro en Jarabe Antianemicodiego flores gomezAún no hay calificaciones
- Problemas 1a PC 46884Documento3 páginasProblemas 1a PC 46884Lady Diana Ceron HuertaAún no hay calificaciones
- Triadas de DobereinerDocumento4 páginasTriadas de DobereinerAdrian ReyesAún no hay calificaciones
- Transmutación y AlquimiaDocumento2 páginasTransmutación y AlquimiaManik FrancoAún no hay calificaciones
- Plan de Estudio de Profesorado en Educacion BasicaDocumento34 páginasPlan de Estudio de Profesorado en Educacion BasicaSamanthaAún no hay calificaciones
- Taller Quimica y Fisica Clei 4Documento6 páginasTaller Quimica y Fisica Clei 4juan catañoAún no hay calificaciones
- Modelo Atómico de Dalton...Documento3 páginasModelo Atómico de Dalton...chinuezAún no hay calificaciones
- Nanotecnologia CromoDocumento4 páginasNanotecnologia CromoDaniel BarreraAún no hay calificaciones
- Guia de Atomo OctavoDocumento6 páginasGuia de Atomo Octavolaax_siuyenAún no hay calificaciones
- Ensayo Sobre Cargas.Documento5 páginasEnsayo Sobre Cargas.Dominic Guerra RíosAún no hay calificaciones
- Texto practicasElecyMag 2022-2-1Documento48 páginasTexto practicasElecyMag 2022-2-1elsy danae sampedro cruzAún no hay calificaciones