Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Configuración Electrónica y Propiedades Químicas
Cargado por
Carolina GomezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Configuración Electrónica y Propiedades Químicas
Cargado por
Carolina GomezCopyright:
Formatos disponibles
QUMICA DESCRIPTIVA INORGNICA
CONFIGURACIN ELECTRNICA Y PROPIEDADES QUMICAS MS IMPORTANTES DE LOS GRUPOS:
Alcalinos
Alcalinotrreos
Trreos o
Boroideos
Carbonoideos
Nitrogenoideos
Anfgenos
Halgenos
Config.
electrnica
ns1
ns2
ns2 np1
ns2 np2
ns2 np3
ns2 np4
ns2 np5
Carcter
metlico
metlico
no metlico,
semimetales
metlico
combinados,
salvo el N
no
metlico
combinado
libres el O y
el S
combinado
inico
inico
inico
no metlico,
semimetal,
metlico
combinados,
salvo el C
covalente,
inico para dos
no metlico,
semimetales
combinado
metlico
salvo el B
(semimetal)
libres, salvo
B y Al
covalente
covalente
covalente
bajos
medios
medios
elevados
altos
altos
muy altos
alta
fuertemente
reductores
alta
fuertemente
reductores
media
reductores,
salvo el B
media
media
inerte el N,
reductor el P
muy alta
muy
oxidantes
Compuestos
ms
importantes
hidrxidos
hidrxidos
aluminatos
alta
oxidante el
O
xidos,
hidrxidos,
sulfatos,
sulfuros
Reaccin
con agua
si;
desprenden
hidrgeno
s, muchas sales
insolubles
no
Estado
natural
Enlace ms
habitual
Potenciales
de
ionizacin
Reactividad
Carcter
redox
reductor el Si
xidos,
sulfuros
nitratos, fosfatos
haluros
si
HIDRGENO:
Estructura electrnica: 1s1.
Puede formar iones H- y H+.
Forma tres tipos de hidruros: inicos (NaH), covalentes (NH3) y metlicos (NiH2).
Se obtiene por electrolisis del agua o por accin de HCl (aq) sobre metales activos.
METALES ALCALINOS
Estructura electrnica externa: ns1 (n2)
Se caracterizan por su baja energa de ionizacin, baja electronegatividad y potencial estndar de
reduccin muy negativo.
Son los metales ms reactivos: reaccionan rpidamente con oxgeno, agua y halgenos.
Forman comnmente compuestos inicos.
El Na se prepara por electrolisis de NaCl fundido.
METALES ALCALINOTRREOS
Estructura electrnica externa: ns2 (n2)
Algo ms electronegativos que los alcalinos.
Su reactividad, menor que la de los alcalinos, aumenta con el nmero atmico de los elementos.
Salvo el Be forman compuestos inicos.
Se preparan por electrolisis de cloruros fundidos.
El CaCO3, presente en las rocas calizas, se descompone trmicamente en cal viva, CaO, y CO2.
METALES DE TRANSICIN
Los metales de transicin d completan los orbitales d. Suelen presentar una gran variedad de
nmeros de oxidacin.
Los metales de transicin f completan los orbitales f. Son los lantnidos y actnidos, cuyas
propiedades qumicas son semejantes.
ELEMENTOS DEL GRUPO DEL BORO
Estructura electrnica externa: ns2 np1.
Salvo el Boro, semimetlico, los dems son metales.
Muchos de los compuestos son covalentes. Forman compuestos inicos mediante el ion M3+.
El aluminio, el elementos ms importante del grupo, se obtiene por electrolisis de almina
(Al2O3) fundida.
ELEMENTOS DEL GRUPO DEL CARBONO
Estructura electrnica externa: ns2 np2.
Hay una transicin gradual en la naturaleza de estos elementos: en elemento no metlico (C), dos
semimetales (Si y Ge) y dos metales (Sn y Pb).
Son poco reactivos en condiciones ordinarias. En general reaccionan con el oxgeno, los
halgenos y los cidos fuertes y oxidantes.
El silicio, el germanio, el estao y el plomo se obtienen por reduccin de sus xidos.
El carbono forma dos xidos CO y CO2. La disolucin acuosa de este ltimo da lugar al cido
carbnico, H2CO3.
Los silicatos, en sus variadas estructuras, tienen como unidad estructura el tetraedro SiO4.
ELEMENTOS DEL GRUPO DEL NITRGENO
Estructura electrnica externa: ns2 np3.
El carcter metlico aumenta claramente con el nmero atmico de los elementos.
Son muy poco reactivos en condiciones ordinarias, y su reactividad aumenta con la temperatura.
El amoniaco, NH3, es una base dbil muy soluble en agua obtenida por sntesis de sus elementos
(proceso Haber).
El cido ntrico, HNO3, es un cido fuerte y oxidante.
El cido ortofosfrico, H3PO4, es un cido triprtico dbil.
ELEMENTOS DEL GRUPO DEL OXGENO
Estructura electrnica externa: ns2 np4.
El oxgeno, el azufre y el selenio son no metales; el teluro y el polonio, semimetales. El carcter
no metlico del grupo es superior al de los grupos del carbono y del nitrgeno, en general.
El oxgeno se combina prcticamente con todos los elementos formando xidos, perxidos y
superxidos.
El azufre, el selenio y el teluro se combinan con muchos metales y con halgenos.
El agua es anftera, a diferencia de H2S, H2Se y H2Te, cuyas disoluciones acuosas son cidas. Las
molculas de H2O, muy polares, se unen mediante enlaces de hidrgeno.
El cido sulfrico, H2SO4, es un cido fuerte, diprtico y deshidratante.
HALGENOS
Estructura electrnica externa: ns2 np5.
Constituye el grupo de elementos de mayor carcter no metlico del sistema de periodos.
Son agentes oxidantes enrgicos.
Se combinan prcticamente con todos los elementos.
Las disoluciones acuosas de HF, HCl, HBr y HI tienen carcter cido.
El flor y el cloro se obtienen por electrolisis. El bromo y el yodo se obtienen por oxidacin de
los iones Br- y I- del agua de mar.
GASES NOBLES
Estructura electrnica externa: ns2 np6 (n2). La del helio es 1s2.
Son muy estables, prcticamente inertes. Se conocen pocos compuestos de algunos de ellos.
PROPIEDADES QUMICAS MS IMPORTANTES DE LOS COMPUESTOS DE
HIDRGENO, OXGENO, NITRGENO Y AZUFRE:
HIDRUROS (H2O y NH3)
Agua (H2O): Disolvente universal, tiene enlaces de hidrgeno y es anftera.
Amoniaco (NH3): Tiene enlaces intermoleculares de hidrgeno, disuelto en agua se encuentra
como hidrxido amnico (NH4OH), es buen reductor, y se obtiene industrialmente por sntesis
directa (mtodo de Haber-Bosch):
N2 (g) + H2 (g) NH3 (g) H = -92,4 kJ
Las condiciones ms adecuadas para obtener un rendimiento mximo en el proceso, segn el
Principio de Le Chatelier, seran: bajas temperaturas y presiones elevadas. Pero a bajas
temperaturas las reacciones son muy lentas. Haber y Bosch propusieron unas condiciones
ptimas para esta reaccin de sntesis: temperaturas de 400-500 C y presiones de 800-1000
atm, adems de catalizadores adecuados. Como catalizador se utiliza magnetita (Fe 3O4)
mezclada con otros xidos (Al2O3, K2O, y CaO).
XIDOS (SO2, SO3, NO y NO2)
Dixido de azufre (SO2): Gas corrosivo, venenoso, irritante y contaminante. Es uno de los
responsables de la lluvia cida.
Trixido de azufre (SO3): Lquido oleoso y muy denso. Contaminante que se forma en los
ncleos urbanos e industriales. Es uno de los responsables de la lluvia cida.
Monxido de nitrgeno (NO): Materia prima para la obtencin del cido ntrico.
Dixido de nitrgeno (NO2): Gas venenoso y corrosivo, es un contaminante atmosfrico. Es
uno de los responsables de la descomposicin de la capa de ozono.
CIDOS (HCl, HNO3, H2SO4)
cido clorhdrico (HCl): El cido clorhdrico es una disolucin acuosa del gas cloruro de
hidrgeno (HCl). Es muy corrosivo y cido. Se emplea comnmente como reactivo qumico, se
trata de un cido fuerte que se disocia completamente en disolucin acuosa.
Su mezcla con cido ntrico en proporcin (1:3) se denomina agua regia, es capaz de oxidar al
oro y al platino disolvindolos. Es el cido inorgnico ms utilizado despus del sulfrico.
Industrialmente se obtiene por sntesis de sus elementos en una disolucin de cido clorhdrico
(H2 + Cl2 2 HCl), o por reaccin del cido sulfrico con el cloruro de sodio (H 2SO4 + 2 NaCl
Na2SO4 + 2 HCl)
A temperatura ambiente, el cloruro de hidrgeno es un gas incoloro a ligeramente amarillento,
corrosivo, no inflamable, ms pesado que el aire, de olor fuertemente irritante.
cido ntrico (HNO3): Lquido incoloro, soluble en agua en todas las proporciones. cido muy
fuerte de gran carcter oxidante.
Se obtiene industrialmente por el mtodo de Ostwald, descubierto en 1900, que parte del
amoniaco como materia prima para la obtencin de este cido.
La primera etapa es la oxidacin del amoniaco a 800 C en presencia de un catalizador de
platino:
4 NH3 + 5 O2 = 4 NO + 6 H2O
La segunda etapa es la oxidacin del NO al mezclarlo con aire:
2 NO + O2 = 2 NO2
Este dixido de nitrgeno se borbotea a travs del agua:
3 NO2 + H2O = 2 HNO3 + NO
El xido ntrico resultante retroalimenta el proceso en el paso 2.
El cido ntrico se emplea en la preparacin de nitratos que se utilizan como abonos
nitrogenados, en la obtencin de derivados orgnicos nitrados, algunos de los cuales se utilizan
en la fabricacin de explosivos (nitroglicerina), TNT o trilita, etc.). Tambin se usa para la
obtencin de plsticos, fibras, etc. y para recubrir metales (pasivazo).
Sus principales derivados son:
o Nitrato sdico: en la naturaleza se encuentra como nitrato de chile o caliche, y puede
obtenerse por reaccin entre el cido ntrico y el carbonato de sodio. Se usa como
conservante alimentario, en la industria del vidrio y para fabricar cerillas.
o Nitrato potsico: denominado salitre, se obtiene por reaccin de cido ntrico e hidrxido
de potasio. Es un componente de la plvora y se emplea como explosivo, fertilizante, en
medicina y en sntesis de colorantes.
o Nitrato de plata: Se encuentra en forma de cristales incoloros que oscurecen por accin de
la luz; se emplea en medicina, para platear objetos y, antiguamente, en fotografa.
cido sulfrico (H2SO4): Compuesto qumico de gran importancia industrial.
Caractersticas: soluble en agua, cido fuerte, oxidante y deshidratante.
Se obtiene industrialmente por los mtodos de las cmaras de plomo y por el mtodo de
contacto. En ambos procesos el dixido de azufre (SO2) es oxidado y disuelto en agua. El
dixido de azufre es obtenido mediante la incineracin azufre, tostando piritas (Bisulfuro de
Hierro), tostando otros sulfuros no ferrosos, o mediante la combustin de sulfuro de hidrogeno
(H2S) gaseoso.
o Mtodo de las cmaras de plomo: Este mtodo se introdujo en 1736 en Inglaterra, hoy da
su uso ha decado mucho. El proceso mezcla el SO2 con aire y vapor de agua en presencia de
xidos de nitrgeno que actuaban de catalizadores. Todo el proceso se realizaba en unas
cmaras revestidas de plomo para evitar la corrosin. La reaccin global es:
2 SO2 + O2 + H2O 2 H2SO4
Este cido tiene una riqueza del 60-70% y contiene abundantes impurezas. Se consume
prcticamente en la fabricacin de fertilizantes.
o Mtodo de contacto: Se utiliz por primera vez en 1900. Actualmente es el mtodo ms
empleado, pues permite obtener cido sulfrico de elevada pureza y concentracin (98%)
El SO2 obtenido se purifica bien, se lava con agua y luego con cido concentrado.
Posteriormente se oxida a SO3 con oxgeno del aire en presencia de un catalizador de
platino: 2 SO2 + O2 2 SO3
Esta etapa, aunque es exotrmica se realiza a 400C y se obtienen rendimientos del 98%.
El SO3 formado se introduce en una torre de absorcin donde se disuelve en cido sulfrico
del 98%, obtenindose cido sulfrico fumante. Tratando esta disolucin con cido sulfrico
diluido, se obtiene cido sulfrico concentrado (97-99%). No se trata directamente el SO 3
con agua porque el proceso es demasiado lento.
En cuanto a su inters industrial, el cido sulfrico se utiliza en la preparacin de fertilizantes
(sulfato amnico), en el refino de petrleo, en industrial textiles (seda artificial) y en
industrias orgnicas (pinturas, colorantes, plsticos). Tambin se usa para fabricar productos
qumicos (cidos clorhdrico y ntrico, sulfatos metlicos, etc.), para limpiar la herrumbre en
superficies de acero, en pilas y acumuladores, e incluso en fabricacin de explosivos.
Sus derivados ms importantes son los sulfatos, algunos de ellos son:
o Sulfato de bario, baritina, insoluble en agua, se emplea en pinturas, en industria textil
y de caucho.
o Sulfato de calcio: dihidratado es el yeso, se emplea como tiza, fertilizante, en la
construccin y en la fabricacin de papel.
o Sulfato de potasio: Slido incoloro que se emplea como fertilizante y en la
fabricacin de explosivos.
También podría gustarte
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Química inorgánica: Hidrógeno y sus propiedadesDocumento40 páginasQuímica inorgánica: Hidrógeno y sus propiedadesPedro Jacinto HerviasAún no hay calificaciones
- Propiedades de Los ElementosDocumento15 páginasPropiedades de Los ElementosGuadalupe RomerAún no hay calificaciones
- Resumen Solo de Teoria.Documento7 páginasResumen Solo de Teoria.Luis Junior Pereira MedinaAún no hay calificaciones
- Metales Grupos 1 y 2Documento30 páginasMetales Grupos 1 y 2feliped33d3d3Aún no hay calificaciones
- Clase 13 y 14 Sem 11 Elementos Del Grupo IDocumento54 páginasClase 13 y 14 Sem 11 Elementos Del Grupo IEliane AriasAún no hay calificaciones
- Presentación Nº4 OxigenoDocumento31 páginasPresentación Nº4 OxigenoOrtega Durán Abel JoséAún no hay calificaciones
- Alcalinos G1Documento46 páginasAlcalinos G1adrian3baqueAún no hay calificaciones
- Semana 4. METALES ALCALINOSDocumento32 páginasSemana 4. METALES ALCALINOSEvelin HPAún no hay calificaciones
- 16 y 17Documento65 páginas16 y 17جابریل جابریلAún no hay calificaciones
- Presentación GRUPO IDocumento17 páginasPresentación GRUPO IJoaquin LauriaAún no hay calificaciones
- Informe de NitrogenoidesDocumento9 páginasInforme de NitrogenoidesDatois TorresAún no hay calificaciones
- Agentes oxidantes y anfóteros en la corrosiónDocumento3 páginasAgentes oxidantes y anfóteros en la corrosiónalejandrodlcAún no hay calificaciones
- Estudio Cualitativo de La Reactividad de Los Metales Del Grupo IDocumento21 páginasEstudio Cualitativo de La Reactividad de Los Metales Del Grupo IAna Guadalupe SalazarAún no hay calificaciones
- Quimica Descriptiva AlxalinosDocumento30 páginasQuimica Descriptiva AlxalinosJHENY MARLENE LUNAAún no hay calificaciones
- Acido Nitrico InformeDocumento22 páginasAcido Nitrico InformeNirza Sanchez MejiaAún no hay calificaciones
- INSTITUTO POLITCNICO NACIONA1.docx APUNTES-TERCER PARCIALDocumento33 páginasINSTITUTO POLITCNICO NACIONA1.docx APUNTES-TERCER PARCIALsamantha galiciaAún no hay calificaciones
- Agentes R y ODocumento7 páginasAgentes R y OEduardo Camarena SullcaAún no hay calificaciones
- Agentes Oxidantes y ReductoresDocumento15 páginasAgentes Oxidantes y ReductoresJose CamposAún no hay calificaciones
- Elementos RepresentativosDocumento40 páginasElementos RepresentativosPablo Olmedo PalmaAún no hay calificaciones
- Quimica Iti 2122 T7Documento13 páginasQuimica Iti 2122 T7Daniel Segura 333Aún no hay calificaciones
- Práctica 9Documento9 páginasPráctica 9LidiaaurisAún no hay calificaciones
- QuimicaDocumento14 páginasQuimicatransportenasca.rojimAún no hay calificaciones
- Metales Alcalinos 21 - 21Documento94 páginasMetales Alcalinos 21 - 21Sonia Chamorro ArmasAún no hay calificaciones
- Ac - Nitrico PresentacionDocumento31 páginasAc - Nitrico PresentacionNirza Sanchez MejiaAún no hay calificaciones
- Cuestionario LaboratorioDocumento7 páginasCuestionario LaboratorioMary Angeles RemacheAún no hay calificaciones
- Propiedades Físicas de Los Metales AlcalinosDocumento6 páginasPropiedades Físicas de Los Metales AlcalinosShelsy SamudioAún no hay calificaciones
- OXÍGENO Metales y No MetalesDocumento3 páginasOXÍGENO Metales y No MetalesYoletzy VasquezAún no hay calificaciones
- Resumen CompletoDocumento44 páginasResumen CompletoAnto RodriguezAún no hay calificaciones
- Quimica DescriptivaDocumento88 páginasQuimica DescriptivaLazzaro MartínezAún no hay calificaciones
- Sustancias Simples y CompuestasDocumento13 páginasSustancias Simples y CompuestasMireya Rojas Silva100% (1)
- Carbono y AzufreDocumento14 páginasCarbono y AzufreYaoccelin RomeroAún no hay calificaciones
- Preguntas Informe Preparación Del Acido NítricoDocumento5 páginasPreguntas Informe Preparación Del Acido Nítricoangie yanethAún no hay calificaciones
- NOMENCLATURADocumento10 páginasNOMENCLATURAGeanpiero Touzet MálagaAún no hay calificaciones
- Anhídridos Del Fer Toapanta1Documento13 páginasAnhídridos Del Fer Toapanta1Yalesita CordovaAún no hay calificaciones
- Sexto GrupoDocumento9 páginasSexto GrupoLuis Alberto Apaza ArceAún no hay calificaciones
- 8.0 Elementos Grupo NitrogenoDocumento9 páginas8.0 Elementos Grupo NitrogenoEduardo Steven AmayoAún no hay calificaciones
- Características del hidrógenoDocumento27 páginasCaracterísticas del hidrógenoMateo SalemAún no hay calificaciones
- PRACTICA 9 IvanDocumento10 páginasPRACTICA 9 IvanIván CRAún no hay calificaciones
- Reacciones en Medio Acuoso Precipitacion y AcidobaseDocumento17 páginasReacciones en Medio Acuoso Precipitacion y AcidobaseJuank GutierrezAún no hay calificaciones
- Informe 8. - ESTUDIO DE LOS ELEMENTOS DE LOS GRUPOS IA Y IIA DE LA TABLA PERIÓDICADocumento27 páginasInforme 8. - ESTUDIO DE LOS ELEMENTOS DE LOS GRUPOS IA Y IIA DE LA TABLA PERIÓDICAANTHONY ALEXANDER HUAMAN VIVANCOAún no hay calificaciones
- SintesisDocumento7 páginasSintesisMiZhellRubyContrErazSalaZarAún no hay calificaciones
- 3er Exm RefinacionDocumento113 páginas3er Exm RefinacionKatherin Carhuas QuispeAún no hay calificaciones
- Practica 5 KevinDocumento7 páginasPractica 5 KevinFranks EspinozaAún no hay calificaciones
- 20 Ejemplos de HidrurosDocumento5 páginas20 Ejemplos de HidrurosJulio Cordoba33% (3)
- Clasificación de Óxidos - GasperínDocumento13 páginasClasificación de Óxidos - Gasperíndarkmarcus1Aún no hay calificaciones
- No Metales de ImportanciaDocumento108 páginasNo Metales de ImportanciaPol KzerAún no hay calificaciones
- AbundDocumento81 páginasAbundElizabeth Nina Villca100% (1)
- Agentes Oxidantes y ReductoresDocumento3 páginasAgentes Oxidantes y Reductoreslucero100% (1)
- Grupo 6 La Familia Del OxígenoDocumento90 páginasGrupo 6 La Familia Del OxígenoBrayan QuinteroAún no hay calificaciones
- Inf de Quimica5 Reacciones Oxido ReduccionDocumento6 páginasInf de Quimica5 Reacciones Oxido ReduccionEdgar Israel López AuquillaAún no hay calificaciones
- Volumetrias RedoxDocumento20 páginasVolumetrias RedoxBrayan ArévaloAún no hay calificaciones
- Quimica IFMADocumento28 páginasQuimica IFMAFabrizzio Saúl Mendizabal La TorreAún no hay calificaciones
- Análisis Cualitativo de Los Cationes Del Grupo V 1. ObjetivosDocumento7 páginasAnálisis Cualitativo de Los Cationes Del Grupo V 1. ObjetivosJhoelvis ChoqueAún no hay calificaciones
- Apuntes de Acidos y Bases Interés IndustrialDocumento4 páginasApuntes de Acidos y Bases Interés Industrialvialmapa5Aún no hay calificaciones
- Informe 4 HidrogenoDocumento8 páginasInforme 4 HidrogenoBryan Manuel Morillas PalaciosAún no hay calificaciones
- Tendencia de Grupos de Los Metales ActivosDocumento5 páginasTendencia de Grupos de Los Metales ActivosAndrea Salgado Erazo100% (1)
- NitrogenoidesDocumento11 páginasNitrogenoidesBryan Manuel Morillas PalaciosAún no hay calificaciones
- Elementos químicos (metales de transición): Níquel, Paladio y PlatinoDocumento29 páginasElementos químicos (metales de transición): Níquel, Paladio y PlatinoSaoly SaadaAún no hay calificaciones
- Configuración Electrónica y Propiedades QuímicasDocumento5 páginasConfiguración Electrónica y Propiedades QuímicasCarolina GomezAún no hay calificaciones
- Reacciones de Transferencia de ElectronesDocumento11 páginasReacciones de Transferencia de ElectronesDionyMilagrosAún no hay calificaciones
- Reacciones de Transferencia de ElectronesDocumento11 páginasReacciones de Transferencia de ElectronesDionyMilagrosAún no hay calificaciones
- Taxonomia de BloomDocumento1 páginaTaxonomia de BloomAtenas VallesAún no hay calificaciones
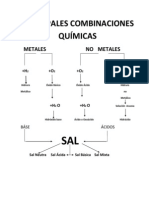
- Principales Combinaciones QuímicasDocumento2 páginasPrincipales Combinaciones QuímicasCarolina GomezAún no hay calificaciones
- SN1Documento15 páginasSN1Carolina GomezAún no hay calificaciones
- Ejercicios de Enlace QuimicoDocumento10 páginasEjercicios de Enlace QuimicoCarolina GomezAún no hay calificaciones
- Formación y Descomposición Del OzonoDocumento3 páginasFormación y Descomposición Del OzonoCarolina GomezAún no hay calificaciones
- Configuración Electrónica y Propiedades QuímicasDocumento5 páginasConfiguración Electrónica y Propiedades QuímicasCarolina GomezAún no hay calificaciones
- LFM32Documento24 páginasLFM32Jorge CalapuchaAún no hay calificaciones
- AlcanosDocumento4 páginasAlcanosCarolina GomezAún no hay calificaciones
- Tema 7Documento33 páginasTema 7Diana Paola BärränteAún no hay calificaciones
- Revision Complementacion Quimica Organica UnoDocumento37 páginasRevision Complementacion Quimica Organica UnoCarolina GomezAún no hay calificaciones
- Compuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónDocumento11 páginasCompuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónPao AngamarcaAún no hay calificaciones
- Compuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónDocumento11 páginasCompuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónPao AngamarcaAún no hay calificaciones
- Regla de HundDocumento94 páginasRegla de HundCarolina GomezAún no hay calificaciones
- Compuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónDocumento11 páginasCompuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónPao AngamarcaAún no hay calificaciones
- Formación del sistema educativo argentino: ¿producción de fuerza de trabajo o ciudadanosDocumento17 páginasFormación del sistema educativo argentino: ¿producción de fuerza de trabajo o ciudadanosSilvana GonzalezAún no hay calificaciones
- LFM32Documento24 páginasLFM32Jorge CalapuchaAún no hay calificaciones
- Hidrostatica e HidrodinamicaDocumento14 páginasHidrostatica e HidrodinamicaCarolina Gomez100% (1)
- Tema 11Documento7 páginasTema 11Carolina GomezAún no hay calificaciones
- MateriaDocumento1 páginaMateriaCarolina GomezAún no hay calificaciones
- 03 El Enlace CovalenteDocumento16 páginas03 El Enlace Covalentejonovoa100% (1)
- Curiosidades sobre el hidrógeno: el elemento más ligeroDocumento3 páginasCuriosidades sobre el hidrógeno: el elemento más ligeroCarolina GomezAún no hay calificaciones
- Fernandez, Lidia - Instituciones EducativasDocumento51 páginasFernandez, Lidia - Instituciones EducativasMauricio Ferreira78% (23)
- Ley de BraggDocumento4 páginasLey de BraggCarolina GomezAún no hay calificaciones
- Capítulo IIIDocumento5 páginasCapítulo IIICarolina GomezAún no hay calificaciones
- Revision Complementacion Quimica Organica UnoDocumento37 páginasRevision Complementacion Quimica Organica UnoCarolina GomezAún no hay calificaciones
- 11 IDocumento9 páginas11 ICarolina GomezAún no hay calificaciones