Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Exposicion Electroquimica
Cargado por
David Zarate Mansilla0 calificaciones0% encontró este documento útil (0 votos)
283 vistas44 páginasdodoododo
Título original
EXPOSICION ELECTROQUIMICA
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPT, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentododoododo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
283 vistas44 páginasExposicion Electroquimica
Cargado por
David Zarate Mansilladodoododo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 44
“DESARROLLO CIENTIFICO DE
LA ELECTROQUIMICA”
Por: Ing. César Paúl Ortiz Jahn
INTRODUCCION
• La finalidad de esta presentación es
mostrar el desarrollo de la electroquímica,
como ciencia dentro de la rama
tecnológica de la química, básicamente se
enfoca algunos conceptos fundamentales
de esta ciencia, la historia y sus
principales actores, cual es la relación con
otras disciplinas y algunos aspectos
filosóficos.
Que es la electroquímica
La Electroquímica es la ciencia que
comprende todos los fenómenos de la
Química en los que está involucrado el
transporte de cargas eléctricas bajo la
influencia de un campo eléctrico medible,
el cual es impuesto desde el exterior o es
desarrollado por el mismo sistema
Límite de fases metal solución
El potencial de electrodo
El potencial de electrodo medido
reproduce la diferencia de los
potenciales electroquímicos entre
el electrodo de trabajo y el
electrodo de referencia .
Celda de electrólisis y celda
galvánica
Historia de la electroquímica
Hace casi tres mil años, el filósofo griego
Aristóteles postuló que toda la materia se
comprende de cuatro elementos básicos:
la tierra, agua, aire, y fuego.
Las tecnologías eléctricas están basadas
en los fenómenos magnéticos y eléctricos.
Siglo XVI: William Gilbert, estableció la
diferencia entre el efecto magnético y la
electricidad estática
Siglo XVII: Otto van Guericke construye a
la primera máquina eléctrica.
Siglo XVIII: Francis Hauksbee, creó la
Luz de Neón. Stephen Gray y Jean
Desaguliers descubrieron la transmisión
de la corriente eléctrica. Charles François
y Cisternay Du Fay descubrieron dos tipos
de electricidad estática, y que las cargas
iguales se rechazan y que las cargas
diferentes se atraen.
Sir William Watson experimenta en 1747
la determinación de la velocidad de
electricidad. Nollet se reputa ser el que
primero aplicó el nombre de "Jarra de
Leyden" al primer dispositivo para
almacenar electricidad. El generador
desarrollado por Jesse Ramsden estaba
entre los primeros generadores
electrostáticos inventados, era usado con
fines médicos. Charles-Augustin de
Coulomb desarrolló la ley de atracción
electrostática en 1781.
En 1789 Franz Aepinus desarrolló un dispositivo
con las propiedades de un condensador. Luigi
Galvani concluyó que el tejido animal contiene
una fuerza innata, vital hasta ahora omitida que
él el denominó “electricidad animal” . Volta que
acuñó el término galvanismo.
Época temprana Siglo XIX: William Nicholson
tuvo éxito descomponiendo el agua en
hidrógeno y oxígeno por electrólisis. Johann
Ritter observó que se puede adherir el cobre,
fue el primer esfuerzo de galvanoplastia. William
Hyde Wollaston indicó que la pila de Volta era
eléctrica. William Cruickshank diseñó la primera
batería eléctrica capaz de producción de masa.
William Hyde Wollaston en asociación con
Smithson Tennant llevó a cabo
experimentos que permitieron la
producción de platino y metales del grupo
del platino. En 1809 Samuel Soemmering
desarrolló el primer telégrafo. Sir Humphry
Davy trabajó con la electrólisis, concluye
que la producción de electricidad en
celdas electrolíticas simples resulta de la
acción química y de la combinación
química que ocurre entre las sustancias
de carga opuesta.
William Hyde Wollaston hizo las mejoras a la
pila galvánica en 1813 o 1815. Hans Cristian
Ørsted descubrió el efecto magnético de
corrientes eléctricas en 1820. Robert Hare
desarrolló en 1820 el Deflagrador, una forma de
batería voltaica. André-Marie Ampère intentó
desarrollar una teoría combinada de electricidad
y magnetismo. En 1822 Peter Barlow construyó
un dispositivo que será considerado uno de los
primeros modelos de un motor eléctrico
abastecido por corriente continua. Se formuló la
ley de Ohm.
En 1829 Antoine-César Becquerel
desarrolló la Celda de Corriente Constante
que fue el precursor de la "Celda de
Daniell". Michael Faraday en 1832.
demostrar que todas las electricidades
tenían las mismas propiedades y causan
precisamente los mismos efectos. El
efecto importante era la descomposición
electroquímica. Sus experimentos llevaron
directamente a las dos leyes de Faraday
de electroquímica:
LAS LEYES DE FARADAY
La cantidad de una sustancia depositada
en cada electrodo de una celda
electrolítica es directamente proporcional
a la cantidad de electricidad que atraviesa
la celda.
Las cantidades de elementos diferentes
depositadas por una cantidad dada de
electricidad está en la proporción de sus
pesos equivalentes químicos
Época mediana Siglo XIX: Hippolyte Pixii,
construyó el primer dínamo de corriente
continua en 1832. William Sturgeon construyó
un motor eléctrico en 1832 e inventó el
conmutador. John Daniell en 1836, inventó una
celda primaria donde se eliminó el hidrógeno en
la generación de la electricidad. William Grove
produjo la primera celda combustible en 1839.
Alejandro Bain en 1846, reprodujo
electroquímicamente señales gráficas
convencionales usando papel empapado en
ferrocianuro potásico.
Isaak Adams Jr. fue pionero de la
electrodeposición de níquel. En 1859 Gastón
Planté sumergió placas de plomo en ácido
sulfúrico diluido y proporcionó corriente
repetidamente a través de ellos. En 1866,
Georges Leclanché patentó un nuevo sistema
que tuvo inmediatamente éxito.
Época posterior Siglo XIX: En 1869 Zénobe
Gramme inventó su primer dínamo de corriente.
Friedrich Kohlrausch en Alemania se centró en
determinar cómo la electricidad se conduce en
las soluciones. Svante August Arrhenius publicó
su tesis en 1884 sobre la conductibilidad
galvánica de electrólitos.
Paul Héroult en Francia y Charles M. Hall en los
Estados Unidos, en 1886, trabajaron sobre la
electrólisis de sales fundidas para la producción
de aluminio. Friedrich Ostwald, laureado Nóbel
de 1909, empezó su trabajo experimental en
1875, con una investigación en la ley de acción
de masas del agua respecto a los problemas de
afinidad química, con el énfasis especial en la
electroquímica y dinámica química. En 1894 él
dio la primera definición moderna de un
catalizador y se volvió su atención a las
reacciones catalíticas.
En 1889, Ludwig Mond y su asistente Charles
Langer describieron sus experimentos con la
celda de combustible de hidrógeno-oxígeno.
Carl Gassner produjo la primera celda "seca" en
1888. Hermann Nernst ha desarrollado la teoría
de la fuerza electromotriz de la celda voltaica en
1888. Él desarrolló los métodos para medir las
constantes dieléctricas y fue el primero en
mostrar que los solventes de constantes
dieléctricas altas promueven la ionización de
substancias. En 1898 Fritz Haber publicó su
libro de texto sobre la Electroquímica.
Época temprana Siglo XX: En 1904, H.
Friedenthal recomendó que la concentración de
ion de hidrógeno se use para caracterizar las
soluciones. El concepto de pH fue introducido
en 1909 por el químico danés Søren Sørensen
como una manera conveniente de expresar la
acidez, el logaritmo negativo de concentración
de ion de hidrógeno. En 1909, Robert Andrews
Millikan empezó una serie de experimentos para
determinar la carga eléctrica llevada por un solo
electrón. En 1911 Frederick Donnan estudió las
condiciones bajo las cuales se establece el
equilibrio entre dos soluciones electrolíticas
separadas por una membrana semipermeable
Jaroslav Heyrovský, el 10 de febrero de 1922, el
polarógrafo nació cuando generó la curva de
corriente-voltaje para una solución de 1 M
NaOH. Masuzo Shikata, construyó el primer
instrumento para el registro automático de
curvas polarográficas. En 1923, Johannes
Nicolaus Brønsted (Dinamarca) y Thomas
Martin Lowry (Inglaterra) publicaron la misma
teoría esencialmente sobre el comportamiento
de los ácidos y bases. Alexander Naumovich
Frumkin y sus colaboradores hicieron medidas
extensas de la adsorción de compuestos
orgánicos (isoterma de Frumkin).
Época mediana Siglo XX : James J. Drumm
inventó "la Batería de Tracción Drumm " (la
batería alcalina zinc-níquel) que fue empleado
para impulsar un tren del suburbio en Irlanda
con éxito (1932-1942). En 1932, las invenciones
por el ingeniero Francis Bacon resultó en el
primer dispositivo exitoso de celdas
combustible. El primer aparato electroforético
sofisticado se desarrolló en 1937 por Arne
Tiselius que le fue otorgado en 1948 el premio
Nóbel por su trabajo en la electroforesis de la
proteína. El Profesor Wiktor Kemula desarrolló
el electrodo de gota de mercurio colgante
(HMDE) (1950) que ayudaron a lanzar la
química electroanalítica moderna en Varsovia.
Principales actores en el desarrollo
de la electroquímica
Luigi Galvani (1737-1798)
Alessandro Giuseppe Volta (1745-1827)
Humphry Davy (1778-1829)
Michael Faraday (1791-1867)
Johann Wilhelm Ritter (1776-1810)
John Frederic Daniell (1790-1845)
La electroquímica y el desarrollo
de otras disciplinas científicas
Consecuencia de una única combinación de las
características diferenciables de las reacciones
electroquímicas.
Ellos pueden superar las limitaciones cinéticas
igualando a las temperaturas muy bajas y son
químicamente y estereoquímicamente
específicas. Esto lleva a las aplicaciones a la
síntesis química.
De importancia en el campo de la
nanotecnología.
La electroquímica juega un papel grande
actualmente en varias áreas bastante diversas,
como la química preparativa, química analítica,
almacenamiento de energía, conversión de
energía, bioquímica, química del estado sólida,
ciencia de los materiales, y microelectrónica.
. En las áreas más aplicadas, se usa para
fabricar materiales desde la escala
macroscópica a la escala microscópica, para
analizar con precisión las impurezas químicas,
entender y prevenir la corrosión de materiales a
las temperaturas bajas y sumamente altas,
sondear la función de células vivientes, y para
convertir la energía química en electricidad.
Aplicación industrial de la
electroquímica
Corrosión de los metales y métodos de
protección
Fuentes electroquímicas de la corriente
Quimiotrónica
Fabricación electroquímica de productos
químicos
Electrometalurgia y galvanotécnia
Métodos electroquímicos de análisis
Algunos aspectos de la filosofía
de la electroquímica
Sobre la descomposición de la electricidad
(Concepción de Michael Faraday) Philosophical
Transactions of the Royal Society, 1834
“La teoría que yo creo es una verdadera expresión de
los hechos de descomposición electroquímica, y qué yo
he detallado por consiguiente en una serie anterior de
estas Investigaciones, es tanto a la variación con
aquéllos previamente adelantado que yo encuentro la
más gran dificultad en establecer los resultados, cuando
yo pienso, correctamente, aunque limitado al uso de
condiciones que son corrientes con un cierto significado
aceptado”
“El término generalmente se ha aplicado a las
superficies de metal en el contacto con la sustancia
descomponiéndose; pero si filósofos generalmente lo
aplicarían también a las superficies de aire y agua
contra lo que yo he efectuado en la descomposición
electroquímica, está sujeto a la duda.”
“Muchos cuerpos son descompuestos directamente por
la corriente eléctrica, sus elementos estando
establecidos libres; a éstos yo propongo llamar el
electrolitos....”
“y de nuevo al introducir mi teoría de descomposición
electroquímica, que la acción de descomposición
química de una corriente es constante para una cantidad
constante de electricidad,….”
¿QUÉ PUEDE HACER LA
ELECTROQUÍMICA POR EL MEDIO
AMBIENTE?
V. García, J. González, E. Expósito, V. Montiel y A.
Aldaz, Departamento de Química-Física. Universidad
de Alicante. aldaz@ua.es
La transferencia de electrones de una molécula a otra, o
de una fase a otra, constituye uno de los procesos
básicos en el desarrollo de la vida y por ello es obvia su
implicación en cualquier proceso de tipo biológico que
ocurra en lo que conocemos en términos genéricos
como Medio Ambiente
La Electroquímica puede utilizarse en el desarrollo de
nuevos métodos y procesos encaminados a mejorar la
calidad de nuestro Medio Ambiente.
W.Konig en la primera mitad
del siglo XX, en Khujut
Rabuah, cerca de Bagdad.
En ellas encontró unas
vasijas, con un tubo de
cobre central en cuyo
interior había un cilindro de
hierro y todo ello estaba
unido con una mezcla
asfáltica. Al lado de las
vasijas se encontraban
diferentes conjuntos
cobre/hierro sin utilizar.
Una explicación plausible dada por Konig
fue que la vasija era en realidad una pila,
y las piezas de cobre y hierro, electrodos
de reserva, ya que si la vasija se llenaba
con un ácido orgánico, tal como ac.
acético (vinagre) o zumo de frutas cítricas,
la vasija producía una cierta corriente.
Si ello fuera cierto, el año 500 a.C. podría
fijarse como el del nacimiento de la
Electroquímica.
Célula Chemelec para
recuperación de metales.
Si sumergimos en el agua residual a tratar
un ánodo de aluminio y un cátodo de
hierro y aplicamos un determinado
potencial se producirá la disolución del
aluminio, con formación de iones Al+3
que, en condiciones adecuadas, formarán
una sal insoluble en forma de flóculos que
adsorberán a los compuestos orgánicos
presentes y a los iones metálicos
(electrocoagulación, ver fig.).
Electrodiálisis
Se ve clara la utilización medioambiental de la
electrodiálisis. Los efluentes con elevada carga
salina pueden ser tratados para lograr aguas
residuales de baja salinidad y la disolución
concentrada puede ser utilizada para recuperar,
si es interesante, la sal contenida en el efluente.
Además, mediante una ingeniosa mezcla de dos
procesos electródicos y una membrana se
puede regenerar el ácido y la base origen de la
sal.
CONCLUSION
La electroquímica es una de las ciencias
que emplea los criterios científicos de la
química y la electricidad, que han jugado
un rol muy importante en el desarrollo de
la ciencia y tecnología en los últimos
tiempos, además se prevé que aun nos
depare más sorpresas para el bienestar
de la humanidad.
Referencias bibliográficas
Svante Arrhenius: 1887, "On the Dissociation of
Substances Dissolved in Water".
Niels Bjerrum: artículo sobre soluciones de
electrolitos de electrolitos fuertes.
J. N. Brønsted: 1923 artículo sobre el concepto de
ácidos y bases.
P. Debye and E. Hückel: 1923 artículo sobre las
propiedades de las soluciones electrolito.
Michael Faraday: 1834 "On Electrical
Decomposition"
Hermann von Helmholtz: 1881 Faraday lecture on
Faraday and electricity.
Lord Kelvin (William Thomson): 1902 artículo sobre la
especulación de cargas discretas eléctricas.
Wilhelm Friedrich Ostwald: 1888 artículo que describe
la ley de la disolución.
Sören Sörensen: 1909 artículo en el cual introduce la
escala del pH.
Alessandro Volta: 1800, artículo sobre baterías
usando discos de plata y zinc.
V. García, J. González, E. Expósito, V. Montiel y A.
Aldaz, ¿Qué puede hacer la electroquímica por el
medio ambiente? Departamento de Química-Física.
Universidad de Alicante. aldaz@ua.es
Damaskín, B. B. y Petri, O. A., “Fundamentos de la
Electroquímica Teórica”, Editorial MIR, Moscú, 1981
GRACIAS
También podría gustarte
- Lab 4 Subgrupo Del CobreDocumento7 páginasLab 4 Subgrupo Del CobreMendoza RomeroAún no hay calificaciones
- Diagrama de Pourbaix Oro PeruDocumento1 páginaDiagrama de Pourbaix Oro PerutayzerozAún no hay calificaciones
- Piro - Unidad 1-2-3-4-5Documento240 páginasPiro - Unidad 1-2-3-4-5Dany MamaniAún no hay calificaciones
- Ejercicio Diagrama PourbaixDocumento8 páginasEjercicio Diagrama PourbaixAlejandra MirandaAún no hay calificaciones
- Previo Del Laboratorio 5Documento4 páginasPrevio Del Laboratorio 5Anthony Sergio Olazabal CardenasAún no hay calificaciones
- Formación de escorias: Diagramas ternarios y cuaternariosDocumento21 páginasFormación de escorias: Diagramas ternarios y cuaternariosBraulio Ala AndiaAún no hay calificaciones
- Tarea Sobre CeldasDocumento2 páginasTarea Sobre CeldasMaria Claudia MartinezAún no hay calificaciones
- PaperdeElectrica PDFDocumento155 páginasPaperdeElectrica PDFAnonymous eifTkAyDysAún no hay calificaciones
- 02 Termodinamica Metalurgica 2020Documento85 páginas02 Termodinamica Metalurgica 2020Alexander TRAún no hay calificaciones
- Cinética en Hidrometalurgia: Factores que Afectan la Velocidad de ReacciónDocumento21 páginasCinética en Hidrometalurgia: Factores que Afectan la Velocidad de ReacciónRodrigo Antonio Henriquez TapiaAún no hay calificaciones
- Diagrama Pourbaix H2O-CuDocumento9 páginasDiagrama Pourbaix H2O-CuJhuan Uchasara SihuayroAún no hay calificaciones
- Informe Final-ArenasDocumento13 páginasInforme Final-ArenasangieAún no hay calificaciones
- Monoeteres PoliglicolicosDocumento14 páginasMonoeteres PoliglicolicosFabian Andre Maquera AlcahuamanAún no hay calificaciones
- Calcopirita PDFDocumento4 páginasCalcopirita PDFLuis Cespedes NorambuenaAún no hay calificaciones
- Construcción de Una Celda de Electro-Obtención de CobreDocumento46 páginasConstrucción de Una Celda de Electro-Obtención de Cobredaniela bissa100% (1)
- Procesamiento de Minerales Termodinamica de Lixiviacion Del CobreDocumento6 páginasProcesamiento de Minerales Termodinamica de Lixiviacion Del CobreGiancarlo ColomaAún no hay calificaciones
- Horno de Copelacion Parabolico PDFDocumento1 páginaHorno de Copelacion Parabolico PDFARNOLD JOSE ALFONSO QUISPE GUERREROAún no hay calificaciones
- Estequiometria en El Alto Horno - Clase 8Documento6 páginasEstequiometria en El Alto Horno - Clase 8Will070707Aún no hay calificaciones
- DownloadDocumento244 páginasDownloadUlises Q. PumacharaAún no hay calificaciones
- Taller Reacciones InvariantesDocumento2 páginasTaller Reacciones InvariantesVictor MerlanoAún no hay calificaciones
- Origen y factores del petróleoDocumento3 páginasOrigen y factores del petróleoErnesto RamosAún no hay calificaciones
- Guía Del Laboratorio 4.electrodeposición Del CobreDocumento7 páginasGuía Del Laboratorio 4.electrodeposición Del CobrePaul Alvarez CuevaAún no hay calificaciones
- Informe 1 Fundicion y MoldeoDocumento8 páginasInforme 1 Fundicion y MoldeoCONTY YONDINY CRUZ SALCEDOAún no hay calificaciones
- m24. Recuperacion de Suelos de Relaves para Areas Verdes en La Planta Piloto Metalurgica de Yauris-UncpDocumento7 páginasm24. Recuperacion de Suelos de Relaves para Areas Verdes en La Planta Piloto Metalurgica de Yauris-UncpManuel DavilaAún no hay calificaciones
- Ejercicios Sobre Equilibrio Ionico (Acido-Base)Documento3 páginasEjercicios Sobre Equilibrio Ionico (Acido-Base)Camila MosqueraAún no hay calificaciones
- Cadmio y GalioDocumento14 páginasCadmio y GalioBraulio ala andiaAún no hay calificaciones
- LABORATORIO 3 PirometalurgiaDocumento18 páginasLABORATORIO 3 PirometalurgiaConnie PetersAún no hay calificaciones
- 3er.. CONSOLIDADO-A-MET - NUM 2020-IIDocumento2 páginas3er.. CONSOLIDADO-A-MET - NUM 2020-IIHenry Guerra SotomayorAún no hay calificaciones
- 01 Introduccion A Las Operaciones MetalurgicasDocumento19 páginas01 Introduccion A Las Operaciones MetalurgicasMaxiito BradlyAún no hay calificaciones
- Informe de Ingenieria ElectricaDocumento20 páginasInforme de Ingenieria ElectricadennisAún no hay calificaciones
- Guia 11 Electroquimica FinalDocumento9 páginasGuia 11 Electroquimica FinalJorge Ropón100% (1)
- I - Examen - Pirometalurgia - Laboratorio - SolucionDocumento15 páginasI - Examen - Pirometalurgia - Laboratorio - SolucionJersonPajueloCaballeroAún no hay calificaciones
- Metalurgia Física Preguntas ExamenDocumento2 páginasMetalurgia Física Preguntas ExamenJuan Diego Falcon ChuraAún no hay calificaciones
- Horno de CubiloteDocumento12 páginasHorno de CubiloteBranly Quispe OrelanoAún no hay calificaciones
- Ecologia y Ambiente IIDocumento138 páginasEcologia y Ambiente IIQ.S. ZomerAún no hay calificaciones
- Pirometalurgia Del HierroDocumento2 páginasPirometalurgia Del HierroHarold L. García RamírezAún no hay calificaciones
- Informe de Fisico Quimica Cinetica Figmm UniDocumento24 páginasInforme de Fisico Quimica Cinetica Figmm UniLuis Angel Paz SalazarAún no hay calificaciones
- Info 5 de Organo Esterificasion de Un AreaccionDocumento6 páginasInfo 5 de Organo Esterificasion de Un AreaccionsemaAún no hay calificaciones
- Examen 2 - 2020-2Documento3 páginasExamen 2 - 2020-2NEIL LUIS BAEZ ZAVALAAún no hay calificaciones
- Evaluación energética de hornos metalúrgicos UNASAM CuscoDocumento12 páginasEvaluación energética de hornos metalúrgicos UNASAM CuscoJOSEPH ABEL AYMA CUTIAún no hay calificaciones
- Estudio de la alotropía del hierro en aceros durante tratamientos térmicosDocumento5 páginasEstudio de la alotropía del hierro en aceros durante tratamientos térmicosElionay Sallo TupayachiAún no hay calificaciones
- Diagramas de fases Yazawa para fundición de cobreDocumento1 páginaDiagramas de fases Yazawa para fundición de cobrealrocke100% (1)
- Ejercicios PrácticosDocumento5 páginasEjercicios PrácticosRobinsonAún no hay calificaciones
- Cementacion de Cobre-CrisDocumento6 páginasCementacion de Cobre-CrisALEXANDER NAZARIO ACEVEDO SINCHEAún no hay calificaciones
- Volumetria de Cu PracticaDocumento6 páginasVolumetria de Cu PracticaJosemir Sanchez SurihuayllaAún no hay calificaciones
- Tarea Analisis Inst. Ayte Alvarez Franszua PDFDocumento4 páginasTarea Analisis Inst. Ayte Alvarez Franszua PDFFRANSZUA AYTE ALVAREZAún no hay calificaciones
- Informe 02 Pureza de Cianuro - Padilla Fabian Jean PaulDocumento16 páginasInforme 02 Pureza de Cianuro - Padilla Fabian Jean PaulAnonymous C0lBgO24i100% (1)
- Recuperación de Oro y Plata en Relaves de Cianuración de Concentrados Refractarios en La Zona de Calpa - ArequipaDocumento6 páginasRecuperación de Oro y Plata en Relaves de Cianuración de Concentrados Refractarios en La Zona de Calpa - ArequipaElionay Sallo TupayachiAún no hay calificaciones
- Manual de datos fisicoquímicos, termodinámicos y electroquímicosDocumento23 páginasManual de datos fisicoquímicos, termodinámicos y electroquímicosBryhan O. Enriquez TorresAún no hay calificaciones
- Pila Galvanica Practica N 3Documento5 páginasPila Galvanica Practica N 3Katita ChascaAún no hay calificaciones
- Termodinamica y HidrometalurgiaDocumento58 páginasTermodinamica y HidrometalurgiaAnselmo C. Ramirez0% (1)
- Caracterización mineralógica y grado de liberaciónDocumento12 páginasCaracterización mineralógica y grado de liberaciónYuli QlAún no hay calificaciones
- Análisis químico de aniones mediante reacciones cualitativasDocumento17 páginasAnálisis químico de aniones mediante reacciones cualitativasJimmy FiestasAún no hay calificaciones
- Concentración OH- disminuye 753 veces al agregar NH4ClDocumento3 páginasConcentración OH- disminuye 753 veces al agregar NH4ClMaycol AyalaAún no hay calificaciones
- Lab Electro Problema 3 P8Documento1 páginaLab Electro Problema 3 P8Monserrat LópezAún no hay calificaciones
- Diagrama de Proceso de HYL IIIDocumento7 páginasDiagrama de Proceso de HYL IIIArmando Martinez GAún no hay calificaciones
- Artes Metalurgicas IDocumento5 páginasArtes Metalurgicas IYimber Castillo Estrada100% (1)
- Recubrimiento ElectrolíticoDocumento10 páginasRecubrimiento Electrolíticoguns02Aún no hay calificaciones
- Fundamentos de ControlDocumento18 páginasFundamentos de ControlAnonymous MhuINvODnAún no hay calificaciones
- La curva de Bradley: evolución de la cultura de seguridad en el trabajoDocumento9 páginasLa curva de Bradley: evolución de la cultura de seguridad en el trabajoDavid Zarate MansillaAún no hay calificaciones
- Reduccion y OxidacionDocumento64 páginasReduccion y OxidacionLizeth Lazaro RuizAún no hay calificaciones
- Matriz - Conesa 2Documento24 páginasMatriz - Conesa 2David Zarate MansillaAún no hay calificaciones
- Procesos Electrolíticos Farádicos y No FarádicosDocumento2 páginasProcesos Electrolíticos Farádicos y No FarádicosDavid Zarate MansillaAún no hay calificaciones
- Sistema de GestionDocumento28 páginasSistema de GestionLizana AdielAún no hay calificaciones
- Costos mineros: CAPEX y OPEXDocumento39 páginasCostos mineros: CAPEX y OPEXDavid Zarate MansillaAún no hay calificaciones
- RepartoDocumento6 páginasRepartoDavid Zarate MansillaAún no hay calificaciones
- Pila DaniellDocumento3 páginasPila DaniellDavid Zarate MansillaAún no hay calificaciones
- 1 BbbhbbhbiugiDocumento7 páginas1 BbbhbbhbiugiDavid Zarate MansillaAún no hay calificaciones
- Practica 1 Pila DaniellDocumento6 páginasPractica 1 Pila DaniellDavid Zarate MansillaAún no hay calificaciones
- Simbolos de SeguridadDocumento17 páginasSimbolos de SeguridadDavid Zarate MansillaAún no hay calificaciones
- Pila DaniellDocumento3 páginasPila DaniellDavid Zarate MansillaAún no hay calificaciones
- Examen Tercer Parcial 2011 IIDocumento2 páginasExamen Tercer Parcial 2011 IIOscar Jean Paul Sullca RomeroAún no hay calificaciones
- Horario Fimm 2020-IDocumento2 páginasHorario Fimm 2020-IDavid Zarate MansillaAún no hay calificaciones
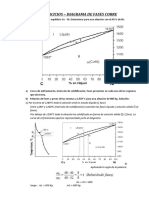
- Ejercicios Resueltos Diagrama de Fases COBREDocumento11 páginasEjercicios Resueltos Diagrama de Fases COBREDavid Zarate MansillaAún no hay calificaciones
- Informe BDocumento1 páginaInforme BDavid Zarate MansillaAún no hay calificaciones
- Informe ADocumento1 páginaInforme ADavid Zarate MansillaAún no hay calificaciones
- EXPOSICIONDocumento11 páginasEXPOSICIONDavid Zarate MansillaAún no hay calificaciones
- ALUMINIIO y SUS ALEACIONES PDFDocumento19 páginasALUMINIIO y SUS ALEACIONES PDFWendy GarciaAún no hay calificaciones
- 1Documento8 páginas1David Zarate MansillaAún no hay calificaciones
- Informe CDocumento1 páginaInforme CDavid Zarate MansillaAún no hay calificaciones
- Molinos - Siemens PDFDocumento268 páginasMolinos - Siemens PDFDavid Zarate MansillaAún no hay calificaciones
- Energia Del CarbonDocumento5 páginasEnergia Del CarbonDavid Zarate MansillaAún no hay calificaciones
- Cinetica de Tostacion Molibdenita PDFDocumento7 páginasCinetica de Tostacion Molibdenita PDFKeith TaylorAún no hay calificaciones
- Cementacion Del CobreDocumento7 páginasCementacion Del CobreDavid Zarate MansillaAún no hay calificaciones
- EQUILIBRIO QCO DosDocumento10 páginasEQUILIBRIO QCO DosDavid Zarate MansillaAún no hay calificaciones
- EQUILIBRIO QCO DosDocumento10 páginasEQUILIBRIO QCO DosDavid Zarate MansillaAún no hay calificaciones
- Energía de la biomasa: ventajas, producción y calderasDocumento8 páginasEnergía de la biomasa: ventajas, producción y calderasDavid Zarate MansillaAún no hay calificaciones
- Guia de Ejercicios Nº 2 OndasElecDocumento2 páginasGuia de Ejercicios Nº 2 OndasElecJavieraV.VillegasAngelAún no hay calificaciones
- Taller de Hidráulica IDocumento14 páginasTaller de Hidráulica ILuis Alberto GomezAún no hay calificaciones
- Termodinámica de la entropía en el Alka-SeltzerDocumento9 páginasTermodinámica de la entropía en el Alka-SeltzerNico Chavez MartinezAún no hay calificaciones
- Tamaño de Partícula mediante Dispersión Dinámica de LuzDocumento32 páginasTamaño de Partícula mediante Dispersión Dinámica de LuzEsteban Olvera MagañaAún no hay calificaciones
- Métodos de soldadura enDocumento18 páginasMétodos de soldadura endanielAún no hay calificaciones
- Diseño de intercambiador de calor para gasóleo y vapor de aguaDocumento9 páginasDiseño de intercambiador de calor para gasóleo y vapor de aguajosé jiménezAún no hay calificaciones
- Ejercicios ResistenciaDocumento32 páginasEjercicios ResistenciaDinoisCampuzanoLdsAún no hay calificaciones
- PreguntasSeleccionPrimerCorte WilliamEspitiaDocumento3 páginasPreguntasSeleccionPrimerCorte WilliamEspitiaWilliam EspitiaAún no hay calificaciones
- Informe de Lab. 3Documento5 páginasInforme de Lab. 3Kevin Farid Bailon RamosAún no hay calificaciones
- Curso Eficiencia Instalaciones ClimatizacionDocumento110 páginasCurso Eficiencia Instalaciones ClimatizacionColombianitoAún no hay calificaciones
- Perfil Potencial Espontaneo ListodocxDocumento4 páginasPerfil Potencial Espontaneo ListodocxMatiasAún no hay calificaciones
- Viscosidad Líquidos LaboratorioDocumento5 páginasViscosidad Líquidos LaboratorioEstefania MunozAún no hay calificaciones
- 4.5 Desgasificadores .0Documento6 páginas4.5 Desgasificadores .0jose carlos flores diaz100% (1)
- Electroquimica - Ley de FaradayDocumento22 páginasElectroquimica - Ley de FaradayHans LopezAún no hay calificaciones
- Termodinámica: Primera ley y procesos termodinámicosDocumento31 páginasTermodinámica: Primera ley y procesos termodinámicosdaniel andres encarnacion hurtado0% (1)
- Documentación TécnicaDocumento20 páginasDocumentación TécnicaflorfeldsbegAún no hay calificaciones
- Calor específico gases idealesDocumento100 páginasCalor específico gases idealesJabiuth Samara Ricaurte ArrietaAún no hay calificaciones
- Muscle Pump Manual, Spanish, VersionDocumento174 páginasMuscle Pump Manual, Spanish, VersionPedro Vilchez100% (1)
- Taller Torsión PDFDocumento3 páginasTaller Torsión PDFJuan de los riosAún no hay calificaciones
- Manual Tracer Pocketester LaMotte 1766 - Versión EspañolDocumento24 páginasManual Tracer Pocketester LaMotte 1766 - Versión EspañolAdrian Rodriguez Betancourt50% (2)
- Difusión de GasesDocumento17 páginasDifusión de GasesdannyAún no hay calificaciones
- Potencial eléctrico y campo eléctrico de cargas puntualesDocumento6 páginasPotencial eléctrico y campo eléctrico de cargas puntualesALVARO LUIS PINEDA HUAYCHOAún no hay calificaciones
- Prototipo TermodinamicaDocumento4 páginasPrototipo TermodinamicaManuel Alejandro PeñafielAún no hay calificaciones
- Flexo Compresión UniaxialesDocumento12 páginasFlexo Compresión UniaxialesDarwin PereiraAún no hay calificaciones
- Informe Final de Mantenimiento de ChillerDocumento9 páginasInforme Final de Mantenimiento de ChillerMiguel Marcelo PachecoAún no hay calificaciones
- MT Circuito RegenerativoDocumento3 páginasMT Circuito RegenerativoEsteban EderAún no hay calificaciones
- Permeabilidad Del SueloDocumento21 páginasPermeabilidad Del SueloMauricio ClarosAún no hay calificaciones
- HIPERESTÁTICADocumento8 páginasHIPERESTÁTICAzaida palaciosAún no hay calificaciones
- Importancia y usos de las olasDocumento4 páginasImportancia y usos de las olasDenis BrañezAún no hay calificaciones
- Diagrama de Equilibrio T - X.Y 1Documento4 páginasDiagrama de Equilibrio T - X.Y 1Luiggina Ugarte TassaraAún no hay calificaciones