0% encontró este documento útil (0 votos)
413 vistas14 páginasObtención de Cadmio y Galio en Metalurgia
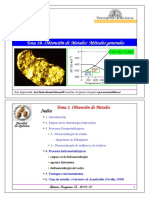
El cadmio se obtiene principalmente como subproducto del procesamiento y refinado del zinc metálico a partir de concentrados de mineral de sulfuro de zinc. El cadmio puede extraerse del mineral de zinc mediante procesos hidrometalúrgicos o pirometalúrgicos. En ambos procesos, el cadmio se separa del zinc a través de la volatilización, precipitación química, o electrolisis. El cadmio también puede recuperarse de los polvos de chimenea recolectados en fundiciones de plomo u cobre.
Cargado por
Braulio ala andiaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
413 vistas14 páginasObtención de Cadmio y Galio en Metalurgia
El cadmio se obtiene principalmente como subproducto del procesamiento y refinado del zinc metálico a partir de concentrados de mineral de sulfuro de zinc. El cadmio puede extraerse del mineral de zinc mediante procesos hidrometalúrgicos o pirometalúrgicos. En ambos procesos, el cadmio se separa del zinc a través de la volatilización, precipitación química, o electrolisis. El cadmio también puede recuperarse de los polvos de chimenea recolectados en fundiciones de plomo u cobre.
Cargado por
Braulio ala andiaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd