Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Citosol
Cargado por
giancarlo0 calificaciones0% encontró este documento útil (0 votos)
38 vistas10 páginasTítulo original
5. Citosol.pptx
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
38 vistas10 páginasCitosol
Cargado por
giancarloCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
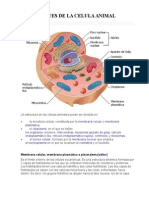
Citosol
Citosol
Las células eucariotas presentan núcleo, citoesqueleto, los
organoides que integran el sistema de endomembranas, las
mitocondrias, los cloroplastos (célula vegetal) y los peroxisomas.
Célula: núcleo y citoplasma
Citoplasma: citosol y el encerrado en el interior de los
organoides.
Citosol: verdadero medio interno celular, que se extiende desde
la envoltura nuclear hasta la membrana plasmática y que llena
el espacio no ocupado por el sistema de endomembranas, las
mitocondrias y los peroxisomas.
Componentes del citosol
Citoesqueleto (centrosoma con sus centriolos)
Enzimas (glucolisis)
Moléculas que conducen señales dentro de la célula
Elementos que dirigen la síntesis de proteínas celulares y
extracelulares (ribosomas, ARNm, ARNt), las chaperonas, los
proteasomas, las inclusiones, etc.
Inclusiones
Acumulación de grandes cantidades de macromoléculas
detectables con el microscopio.
Glicosomas: gránulos de glucógeno (hepatocitos y células
musculares estriadas) que miden entre 50 y 200 nm. “Proteínas
enzimáticas”
Triacilgliceroles: gotitas de grasa (hepatocitos y células musculares
estriadas). Adipocitos.
Pigmentos: lipofucsina (compuestos de fosfolípidos con proteínas,
de color marrón). “Pigmentos de desgaste”
Cristales de proteínas
Ribosomas
Estructuras ribonucleoproteicas muy complejas localizadas en su
mayoría en el citoplasma (mitocondrias y cloroplastos).
Las proteínas sintetizadas por los ribosomas citosólicos se dispersan
en el citosol, núcleo, sistema de endomembranas, las mitocondrias
y los peroxisomas.
Existen los péptidos de señal o señales de anclaje (una o varias
secuencias de unos pocos aminoácidos, ubicados en el extremo
amino, extremo carboxilo o punto intermedio de las propias
proteínas) quienes aseguran la llegada de las proteínas a sus
respectivos destinos.
Las chaperonas
Las proteínas son las moléculas que ejecutan la mayor parte de las
acciones que se producen en la célula. Para que esto sea posible,
necesitan adquirir una estructura tridimensional que permita la
función para la que han sido diseñadas. La mayor parte de las
veces, no pueden adquirir esta configuración por sí solas y
requieren la ayuda de unas proteínas especializadas denominadas
chaperonas moleculares. Existen multitud de chaperonas en la
célula, pero las familias más importantes se llaman hsp60, hsp70 y
hsp90. Estas ayudan a plegar la mayor parte de las proteínas
celulares.
Las hsp (heat shock protein) aumentan para asistir a las proteínas
desnaturalizadas (por el calor) para que vuelvan a plegarse.
Acompañan a las proteínas, previniendo sus plegamientos
prematuros y cuidando que sean correctos (lugar adecuado y
momento oportuno)
Las chaperonas
Hsp60: son polímeros y están integradas por 14 a 18 polipéptidos
denominadas chaperoninas, los cuales componen una estructura
cilíndrica en torno a un espacio central, adonde ingresa la proteína
que va a ser asistida.
Hsp70: son monomericas y poseen un surco en el que cabe sólo
una parte de la proteína asistida, de manera que se necesitan
varias chaperonas hsp70 para cada proteína.
Hsp90
Los proteasomas
Complejo enzimático de 700 kDa que degradan proteínas (mal
plegadas, dañadas o función concluida).
Es de forma cilíndrica y se compone de varias proteasas dispuestas en
torno a una cavidad central, adonde ingresa la proteína que va a ser
degradada. Presenta un “casquete” proteico (integrado por 20
polipeptidos reguladores).
Las proteínas a degradar deben ser “marcadas” por UBIQUITINAS
(polipéptidos citosolicos de 76 aa).
La primera ubiquitina es activada por E1 que la transfiere a E2, luego la
ligasa E3 ayuda a unir el complejo Ubiquitina E2 a la proteína a ser
degradada.
Este complejo es reconocido por los polipeptidos reguladores de uno
de los casquetes, los cuales separan a las ubiquitinas, deshacen el
plegamiento de las proteínas y la introduce en la cavidad del
proteasoma (consume ATP).
Gracias
También podría gustarte
- Aula 4 CitoplasmaDocumento18 páginasAula 4 Citoplasmamywnrj8r78Aún no hay calificaciones
- CitosolDocumento30 páginasCitosolapi-3806371100% (3)
- Resumen Fisiologia Unidad 1Documento7 páginasResumen Fisiologia Unidad 1maricelaAún no hay calificaciones
- Expo OrganelasDocumento38 páginasExpo OrganelasRicardo Fernando Garcia BolañosAún no hay calificaciones
- La Celula AnimalDocumento9 páginasLa Celula AnimalJuly CollantesAún no hay calificaciones
- Resumen Biología y Neurofisiología Del ComportamientoDocumento24 páginasResumen Biología y Neurofisiología Del ComportamientoNazza A. Fariña Portillo100% (1)
- Presentacion Proyecto de Biología Limpio Academico Celeste y Verde ClaroDocumento17 páginasPresentacion Proyecto de Biología Limpio Academico Celeste y Verde Clarolalogutierrez003Aún no hay calificaciones
- Teoría CelularDocumento3 páginasTeoría CelularLorena MartinaAún no hay calificaciones
- La Célula EucariotaDocumento22 páginasLa Célula EucariotaEmelyn Rodríguez TejadaAún no hay calificaciones
- Citosol 379384 Downloable 2204416Documento3 páginasCitosol 379384 Downloable 2204416Daniela Restrepo FlorAún no hay calificaciones
- MitocondriasDocumento26 páginasMitocondriasapi-3806371100% (1)
- TEMA 2 Nucleo, Ribsomas, RE, Sistesis Proteica. KerenDocumento4 páginasTEMA 2 Nucleo, Ribsomas, RE, Sistesis Proteica. KerenFrancisco PabonAún no hay calificaciones
- Trabajo Anatomía Julio Sandoval 5to Biologicas ADocumento13 páginasTrabajo Anatomía Julio Sandoval 5to Biologicas AJulio SandovalAún no hay calificaciones
- Célula Animal y VegetalDocumento44 páginasCélula Animal y VegetalNekkthor RhoudalesAún no hay calificaciones
- Citoes RE NecrosisDocumento17 páginasCitoes RE NecrosisHectorAún no hay calificaciones
- Retículo Endoplasmático RugosoDocumento4 páginasRetículo Endoplasmático RugosoC H Cruz CaballeroAún no hay calificaciones
- Semana 3 - BASES MOLECULARES 3Documento25 páginasSemana 3 - BASES MOLECULARES 3Alison YalleAún no hay calificaciones
- MitocondriasDocumento37 páginasMitocondriasSheysira Grace Capcha CabreraAún no hay calificaciones
- Tabla de Organelos de La Célula EucariotaDocumento2 páginasTabla de Organelos de La Célula EucariotaboucherryAún no hay calificaciones
- Partes de La Celula AnimalDocumento7 páginasPartes de La Celula AnimalDanilo Daniel López PérezAún no hay calificaciones
- Membrana PlasmaticaDocumento15 páginasMembrana PlasmaticaRubí Almaza GámezAún no hay calificaciones
- Tema 5Documento28 páginasTema 5PabloAún no hay calificaciones
- Tema 2Documento5 páginasTema 2María SerranoAún no hay calificaciones
- 4-CITOSOL (Biología Celular y Molecular)Documento3 páginas4-CITOSOL (Biología Celular y Molecular)Enrique Torres100% (1)
- BiologuiaDocumento2 páginasBiologuiabalbinAAún no hay calificaciones
- Trabajo Anatomía Julio Sandoval 5to Biologicas ADocumento13 páginasTrabajo Anatomía Julio Sandoval 5to Biologicas AJulio SandovalAún no hay calificaciones
- ProtoplasmaDocumento6 páginasProtoplasma10729noegmailcomAún no hay calificaciones
- RibosomaDocumento5 páginasRibosomaErnesto RomanAún no hay calificaciones
- La CelulaDocumento4 páginasLa CelulaKarolyne RealAún no hay calificaciones
- Continue: Organelos de La Célula Animal PDFDocumento3 páginasContinue: Organelos de La Célula Animal PDFJeanaime SamyAún no hay calificaciones
- Retículo Endoplasmático RugosoDocumento3 páginasRetículo Endoplasmático RugosoRomiglio AlejandroAún no hay calificaciones
- Célula Vegetal EucariotaDocumento24 páginasCélula Vegetal EucariotaYesselin Guisela Barrios BarriosAún no hay calificaciones
- Organelos CelularesDocumento7 páginasOrganelos CelularesRicardo RAún no hay calificaciones
- Apuntes de HistologiaDocumento19 páginasApuntes de Histologiad.fatyAún no hay calificaciones
- Célula AnimalDocumento11 páginasCélula AnimalLouis GerardoAún no hay calificaciones
- Celula EucariotaDocumento4 páginasCelula EucariotaDaniel SuarezAún no hay calificaciones
- Organelos CelularesDocumento38 páginasOrganelos Celularesyoselin gonzalezAún no hay calificaciones
- Tipos de CélulasDocumento6 páginasTipos de CélulasAidee GarcíaAún no hay calificaciones
- El Reticulo Endoplasmico Se Divide en Dos CompartimientosDocumento9 páginasEl Reticulo Endoplasmico Se Divide en Dos Compartimientosj05390% (1)
- Retículo Endoplasmático RugosoDocumento7 páginasRetículo Endoplasmático Rugosoarmando jeffryAún no hay calificaciones
- Estructura y Fisiología CelularDocumento28 páginasEstructura y Fisiología Celularsiranda100% (5)
- Biologia CelularDocumento21 páginasBiologia CelularBernardo Camilo LeidensAún no hay calificaciones
- Células Eucariotas y ProcariotasDocumento217 páginasCélulas Eucariotas y ProcariotasJesus AnayaAún no hay calificaciones
- Sistema de Endomembrana (Env. Nuclear, RER, REL y AG)Documento42 páginasSistema de Endomembrana (Env. Nuclear, RER, REL y AG)JosueOpazoGarro100% (2)
- Apuntes EneroDocumento84 páginasApuntes EneroLydia77 PastorAún no hay calificaciones
- MITOCONDRIAS EXPosicionDocumento10 páginasMITOCONDRIAS EXPosicionJosé Álvarez RoblesAún no hay calificaciones
- Células Procariotas y EucariotasDocumento14 páginasCélulas Procariotas y Eucariotassheila0517Aún no hay calificaciones
- Taller de Nivelación - BiologíaDocumento35 páginasTaller de Nivelación - Biologíajosefa yañez pardoAún no hay calificaciones
- Aparato de GolgiDocumento10 páginasAparato de GolgiJesica RamirezAún no hay calificaciones
- La Célula AnimalDocumento8 páginasLa Célula AnimalCeles TeAún no hay calificaciones
- Cuadro CelulaDocumento2 páginasCuadro CelulaJose Daniel Bravo AlanísAún no hay calificaciones
- Biologia CelularDocumento114 páginasBiologia Celularbelem martinezAún no hay calificaciones
- 3 - Células EucariotasDocumento65 páginas3 - Células EucariotasCris AcevedoAún no hay calificaciones
- Organización de La VidaDocumento5 páginasOrganización de La VidaXimena Navarro DominguezAún no hay calificaciones
- Célula AnimalDocumento15 páginasCélula Animalayelen quezadaAún no hay calificaciones
- Célula AnimalDocumento17 páginasCélula AnimalJUDITH ALONDRA TORRES HERNANDEZAún no hay calificaciones
- Retículo Endoplasmático RugosoDocumento4 páginasRetículo Endoplasmático Rugosogladys carrilloAún no hay calificaciones
- Unidad III Moleculas y Sistema Endomembranoso para EnvíoDocumento66 páginasUnidad III Moleculas y Sistema Endomembranoso para EnvíoDarwin Currea LozanoAún no hay calificaciones
- La Celula 2Documento23 páginasLa Celula 2fenix dota11Aún no hay calificaciones
- Caracteristicas de La CelulaDocumento22 páginasCaracteristicas de La CelulagiancarloAún no hay calificaciones
- 9 - Fisiologia Cardiovascular. Fisiopatologia de La Hipertension 2015 PDFDocumento13 páginas9 - Fisiologia Cardiovascular. Fisiopatologia de La Hipertension 2015 PDFgiancarloAún no hay calificaciones
- 7 Fisiologia de Las Valvulas y Tono Cardiaco y Shock Circulatorio 2015 UnmsmDocumento10 páginas7 Fisiologia de Las Valvulas y Tono Cardiaco y Shock Circulatorio 2015 UnmsmgiancarloAún no hay calificaciones
- 6 - FISIOLOGIA DE LA HEMOSTASIA 2015 UNMSM EnviarDocumento6 páginas6 - FISIOLOGIA DE LA HEMOSTASIA 2015 UNMSM EnviargiancarloAún no hay calificaciones
- Tejido de SecrecionDocumento7 páginasTejido de SecrecionKAREN JESSICA AGUILAR CHECAAún no hay calificaciones
- Segundos Mensajeros FarmacologíaDocumento15 páginasSegundos Mensajeros FarmacologíaJulio Granado Yance100% (1)
- Tema 3 LA CELULADocumento17 páginasTema 3 LA CELULASarahi alejandra Espejo TupaAún no hay calificaciones
- Mucosa BucalDocumento42 páginasMucosa BucalAnonymous 1tIQ72Aún no hay calificaciones
- Evolución BiológicaDocumento52 páginasEvolución BiológicaJefferson Andrade PereiraAún no hay calificaciones
- BIOLOGIADocumento14 páginasBIOLOGIAJodie LeónAún no hay calificaciones
- Naturales 8 Guía 6Documento4 páginasNaturales 8 Guía 6Leidy Martinez IbanezAún no hay calificaciones
- 1.2 La Célula Como Unidad Biológica Fundamental (Diego Chaparro) D-1Documento9 páginas1.2 La Célula Como Unidad Biológica Fundamental (Diego Chaparro) D-1diego chaparroAún no hay calificaciones
- Ensayo Palta Hass FernandoDocumento6 páginasEnsayo Palta Hass FernandoFERNANDO MAMANI QQUELCCAAún no hay calificaciones
- 3º Medio - Electivo Biología - Guía 3Documento9 páginas3º Medio - Electivo Biología - Guía 3Leslie VillalobosAún no hay calificaciones
- Produccion 1 Eje 3Documento7 páginasProduccion 1 Eje 3Jeison MaciasAún no hay calificaciones
- Crianza de Pollos Broiler PDFDocumento112 páginasCrianza de Pollos Broiler PDFAriel Navarro0% (2)
- Fundamentos de La Célula y El CitoplasmaDocumento5 páginasFundamentos de La Célula y El CitoplasmaLuis InfanteAún no hay calificaciones
- Ayuno Dr. Mercola - Por-Que-el-Ayuno-Intermitente-es-Muy-Recomendable PDFDocumento43 páginasAyuno Dr. Mercola - Por-Que-el-Ayuno-Intermitente-es-Muy-Recomendable PDFPolicena6944Aún no hay calificaciones
- Pa2 - 2020-1 CGQCDocumento2 páginasPa2 - 2020-1 CGQCJORDAN CASTILLON LUNASCOAún no hay calificaciones
- Krzystof Pomian - Memoria - Taducción Nicolás JavaloyesDocumento7 páginasKrzystof Pomian - Memoria - Taducción Nicolás JavaloyesNicolás JavaloyesAún no hay calificaciones
- Sesion 5 Ciencia y Tecnologia 5to Grado ListoDocumento3 páginasSesion 5 Ciencia y Tecnologia 5to Grado ListoVALENTINA GRANADOS MARTINEZAún no hay calificaciones
- Informe de Laboratorio #3 - División CelularDocumento9 páginasInforme de Laboratorio #3 - División CelularAlejandro HernándezAún no hay calificaciones
- Bioestimulacion Cutanea Con Plasma EnriqDocumento24 páginasBioestimulacion Cutanea Con Plasma Enriqpaola poppeAún no hay calificaciones
- INFORME DE LABORATORIO DE BIOLOGÍA: Intercambio de Materia Entre La Célula y El Medio ExternoDocumento18 páginasINFORME DE LABORATORIO DE BIOLOGÍA: Intercambio de Materia Entre La Célula y El Medio Externohhh12230% (1)
- EBR SEC - Matriz de Competencias Capacidades y Desempeños - CIENCIA Y TECNOLOGÍADocumento8 páginasEBR SEC - Matriz de Competencias Capacidades y Desempeños - CIENCIA Y TECNOLOGÍACarlos Alberto Agramonte ValerianoAún no hay calificaciones
- DENTINOGENESISDocumento2 páginasDENTINOGENESISMilenka VillegasEscobarAún no hay calificaciones
- Crecimiento Microbiano FinalDocumento15 páginasCrecimiento Microbiano Finalernesto 11Aún no hay calificaciones
- U2 6to Grado Integrado s5Documento11 páginasU2 6to Grado Integrado s5RenatoVargasSumosoAún no hay calificaciones
- Genética y Transmisión Por HerenciaDocumento8 páginasGenética y Transmisión Por HerenciaLuna MendesAún no hay calificaciones
- Von Uexkull J - Meditaciones Biologicas - La Teoria de La SignificacionDocumento171 páginasVon Uexkull J - Meditaciones Biologicas - La Teoria de La SignificacionSaturnino100% (2)
- Células Citotóxicas NaturalesDocumento10 páginasCélulas Citotóxicas NaturalesAndres Vanegas RojasAún no hay calificaciones
- Prácticas Del PI LABORATORIODocumento5 páginasPrácticas Del PI LABORATORIOmariadelmarmoredaAún no hay calificaciones
- Proyecto de Evaluacion de Fitohormonas para La Propagacion de Anturios-DennysDocumento18 páginasProyecto de Evaluacion de Fitohormonas para La Propagacion de Anturios-DennysDennys Cancino MorenoAún no hay calificaciones
- Biologia - UcacueDocumento26 páginasBiologia - UcacueIlianPlacenciaAún no hay calificaciones