0% encontró este documento útil (0 votos)
29 vistas13 páginasInforme de Laboratorio 5
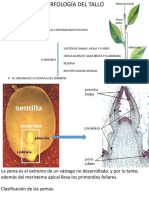
Este informe detalla la práctica de laboratorio sobre el reconocimiento de tejidos vasculares y secretores en plantas, enfocándose en el xilema y floema. Se realizaron cortes transversales de tallos de diferentes especies, como maíz y sauco, utilizando microscopía óptica para observar y describir las estructuras y su función. Además, se identificaron plantas con tejidos secretores, como Cannabis y papaya, que sintetizan compuestos útiles para la defensa y el metabolismo.
Cargado por
pieroramirez017Derechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
29 vistas13 páginasInforme de Laboratorio 5
Este informe detalla la práctica de laboratorio sobre el reconocimiento de tejidos vasculares y secretores en plantas, enfocándose en el xilema y floema. Se realizaron cortes transversales de tallos de diferentes especies, como maíz y sauco, utilizando microscopía óptica para observar y describir las estructuras y su función. Además, se identificaron plantas con tejidos secretores, como Cannabis y papaya, que sintetizan compuestos útiles para la defensa y el metabolismo.
Cargado por
pieroramirez017Derechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd