Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cat a Liz Adores
Cargado por
Stephanie AvilaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cat a Liz Adores
Cargado por
Stephanie AvilaCopyright:
Formatos disponibles
Prof.
Noemí Porcile
CATALIZADORES
Son sustancias que modifican la velocidad de una reacción química sin que ella misma sufra un
cambio químico permanente en el proceso.
Los catalizadores no inician las reacciones, en consecuencia si un sistema es termodinámicamente estable,
es inútil la búsqueda de un catalizador.
C 2 H 8 (g) + O 2 (g) CO 2 (g) + H 2 O (l )
Reactivos inestables si se incrementa la temperatura reaccionan. Productos estables porque no reaccionan entre si.
Los catalizadores se clasifican en:
• Aceleradores o catalizadores positivos. Disminuyen la E a.
• Inhibidores o catalizadores negativos. Aumentan la E a
Los catalizadores ofrecen un camino diferente para que se produzca una reacción química.
Un catalizador positivo provoca la formación de complejos activados que requieren menor energía de
activación que el formado por la reacción sin catalizar.
Al requerirse menor E a , la frecuencia de los choques eficaces se incrementa acelerándose así la reacción.
Para un catalizador negativo es todo a la inversa.
Los catalizadores son muy comunes, en la mayor parte de las reacciones que se realizan en el cuerpo
humano participan catalizadores
Por ejemplo el azúcar (sacarosa) se disuelve en agua a 37ºC, no se oxida con una velocidad significativa,
se puede recuperar prácticamente inalterado después de varios días. Pero el azúcar ingerido en el cuerpo
humano se oxida rápidamente y produce dióxido de carbono y agua.
C 12 H 22 O 11 (ac) + 12 O 2 (ac) 12 CO 2 (ac) + 11 H 2 O (l )
Esta oxidación en un sistema bioquímico es catalizada por una o más enzimas, proteínas que actúan para
catalizar reacciones bioquímicas específicas.
Se realiza un gran esfuerzo de investigación para encontrar métodos para inhibir o eliminar ciertos
catalizadores que promueven reacciones indeseables como la corrosión de los metales, el envejecimiento
o la caries dental.
Características de la acción catalítica
No se consumen, en la primera etapa forman con alguno de los reactivos un complejo activado, pero
siempre en la última etapa se regenera el catalizador.
No existe una relación estequiométrica entre los reactivos de un proceso y la cantidad de catalizador
empleado. Pequeñas cantidades de catalizador provocan la formación de cantidades considerables de
producto, por más catalizador que se ponga la reacción no va a ir más rápido, el catalizador se envenena,
se pierden sus propiedades.
Son específicos. Algunos son específicos respecto al tipo de reacción y otros lo son respecto al sustrato.
Por ejemplo en la hidrogenación de un alqueno o un alquino (adición de hidrógeno a un doble o triple
enlace entre carbonos) el platino es específico para la reacción pero no para el sustrato.
En cambio la maltasa es una enzima específica para provocar la hidrólisis de la maltosa (un azúcar), si
se agrega maltasa a la sacarosa no se produce ningún cambio en la velocidad de la hidrólisis de ésta, la
maltasa es específica respecto al sustato sobre el que actúa (maltosa). Por ejemplo sobre la lactosa actúa
la lactasa.
La catálisis también se puede clasificar en homogénea y heterogénea según que el catalizador esté o no
presente en la misma fase que los reactivos.
Por ejemplo (catalizador heterogéneo), una reacción entre moléculas en fase gaseosa puede ser catalizada
por un óxido metálico finamente dividido, en ausencia del catalizador la reacción transcurre lentamente ,
pero cuando el catalizador está presente la reacción se realiza con mayor rapidez sobre la superficie del
catalizador.
Un catalizador que se encuentra en la misma fase que los componentes de una reacción química , es un
catalizador homogéneo, por ejemplo, ya que el H 2 O 2 es un agente oxidante fuerte y puede ser nocivo para
las células, en la sangre y en el hígado de los mamíferos está presente una enzima, la catalasa, que
cataliza la descomposición del peróxido de hidrógeno (acuoso), en agua y oxígeno.
También podría gustarte
- Resumen 7 Hábitos de Los Adolescentes EfectivosDocumento35 páginasResumen 7 Hábitos de Los Adolescentes EfectivosYeroy Roynel100% (2)
- Evidencias Del Cruce Del Mar RojoDocumento32 páginasEvidencias Del Cruce Del Mar RojoJosé Rafael Mallén MallaAún no hay calificaciones
- Vino Costero LeydaDocumento13 páginasVino Costero LeydaLuis Maldonado SepulvedaAún no hay calificaciones
- PFC David Juberias FernandezDocumento160 páginasPFC David Juberias FernandezhectorjcrAún no hay calificaciones
- Aristoteles PDFDocumento162 páginasAristoteles PDFmax barrios pradoAún no hay calificaciones
- Sensores de OxigenoDocumento25 páginasSensores de OxigenoAndres Muñoz RosarioAún no hay calificaciones
- El Modelo PulsionalDocumento4 páginasEl Modelo PulsionalEsteban BoschAún no hay calificaciones
- Catalogo Tomco Valvulas PCV 2018Documento38 páginasCatalogo Tomco Valvulas PCV 2018Esteban BoschAún no hay calificaciones
- 5 ConferenciasDocumento6 páginas5 ConferenciasEsteban BoschAún no hay calificaciones
- Ficha Ortega - PulsionesDocumento6 páginasFicha Ortega - PulsionesEsteban BoschAún no hay calificaciones
- MEDIOEVO - Prof. ElizaldeDocumento7 páginasMEDIOEVO - Prof. ElizaldeEsteban BoschAún no hay calificaciones
- Foucault - Nietzsche Freud MarxDocumento1 páginaFoucault - Nietzsche Freud MarxEsteban BoschAún no hay calificaciones
- La Estructura de Las Revoluciones CientificasDocumento3 páginasLa Estructura de Las Revoluciones CientificasEsteban BoschAún no hay calificaciones
- GestaltDocumento65 páginasGestaltAnto FerriniAún no hay calificaciones
- ANTIGÛEDAD - Prof. ElizaldeDocumento10 páginasANTIGÛEDAD - Prof. ElizaldeEsteban BoschAún no hay calificaciones
- Que Es Un Autor-FOUCAULTDocumento5 páginasQue Es Un Autor-FOUCAULTEsteban BoschAún no hay calificaciones
- Publicidad Subliminal. Mito y RealidadDocumento12 páginasPublicidad Subliminal. Mito y Realidadjess_bejarAún no hay calificaciones
- GestaltDocumento65 páginasGestaltAnto FerriniAún no hay calificaciones
- GestaltDocumento65 páginasGestaltAnto FerriniAún no hay calificaciones
- John SearleDocumento2 páginasJohn SearleEsteban BoschAún no hay calificaciones
- DARWIN - Prof. ElizaldeDocumento4 páginasDARWIN - Prof. ElizaldeEsteban BoschAún no hay calificaciones
- DPC A TP 4 WatsonDocumento1 páginaDPC A TP 4 WatsonEsteban BoschAún no hay calificaciones
- Historia de La PsicologiaDocumento23 páginasHistoria de La PsicologiarafalbaltodanoAún no hay calificaciones
- El Inconsciente Desde Un Punto de Vista CognitivoDocumento1 páginaEl Inconsciente Desde Un Punto de Vista CognitivoEsteban BoschAún no hay calificaciones
- Conexion IntercelularDocumento8 páginasConexion IntercelularEsteban BoschAún no hay calificaciones
- Síndrome de Down e IntegraciónDocumento1 páginaSíndrome de Down e IntegraciónEsteban BoschAún no hay calificaciones
- Síndrome de Down e IntegraciónDocumento1 páginaSíndrome de Down e IntegraciónEsteban BoschAún no hay calificaciones
- Historia de La PsicologiaDocumento23 páginasHistoria de La PsicologiarafalbaltodanoAún no hay calificaciones
- Codigo de EticaDocumento34 páginasCodigo de EticakokingoAún no hay calificaciones
- Codigo de EticaDocumento34 páginasCodigo de EticakokingoAún no hay calificaciones
- FREUD (1900a) Traumdeutung IIDocumento22 páginasFREUD (1900a) Traumdeutung IISolana IzcoAún no hay calificaciones
- Patrimonio Inmaterial FichasDocumento4 páginasPatrimonio Inmaterial FichasAlexander Cruz limaAún no hay calificaciones
- Volquetes para transporte y descarga de materialesDocumento22 páginasVolquetes para transporte y descarga de materialesJohn CornejoAún no hay calificaciones
- Análisis de DespegueDocumento20 páginasAnálisis de DespegueI C2100% (1)
- Imprimir - 20201011123234 - Vehículo - VF000000000000000Documento3 páginasImprimir - 20201011123234 - Vehículo - VF000000000000000jhl1981Aún no hay calificaciones
- DICLOFENACODocumento8 páginasDICLOFENACOAbbyAbbsAún no hay calificaciones
- Discriminación de La Dirección en La Cual Viene El SonidoDocumento3 páginasDiscriminación de La Dirección en La Cual Viene El SonidoHugo Sánchez RogelAún no hay calificaciones
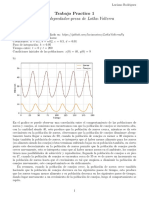
- Analisis Lotka VolterraDocumento4 páginasAnalisis Lotka VolterraLucianoRodriguezAún no hay calificaciones
- Alberdi, Juan Bautista - Una Entrevista Historica PDFDocumento5 páginasAlberdi, Juan Bautista - Una Entrevista Historica PDFCésar Sampedro EstradaAún no hay calificaciones
- Proposiciones Acerca Del Núcleo de Las CélulasDocumento2 páginasProposiciones Acerca Del Núcleo de Las CélulasNéstor Raúl Henao Sierra100% (1)
- Actividad 2 Razonamiento Logico MatematicoDocumento5 páginasActividad 2 Razonamiento Logico MatematicoGERARDO SATOAún no hay calificaciones
- La Minería en La Antigua Grecia y RomaDocumento1 páginaLa Minería en La Antigua Grecia y RomaJhoan Anthony Lazaro MamaniAún no hay calificaciones
- Maquinas SimplesDocumento14 páginasMaquinas Simplesjenny katherin joya suarezAún no hay calificaciones
- Desarrollo de Programación Tecnologia e Informatica Grado QuintoDocumento7 páginasDesarrollo de Programación Tecnologia e Informatica Grado QuintoManuel Camilo GaonaAún no hay calificaciones
- Aa TTDocumento20 páginasAa TTKatherine Julca AltamiranoAún no hay calificaciones
- Clase 10 VIGILANCIA EPIDEMIOLOGICADocumento24 páginasClase 10 VIGILANCIA EPIDEMIOLOGICALeonardo ChalcoAún no hay calificaciones
- Caracterización Del Distrito de PariñasDocumento9 páginasCaracterización Del Distrito de PariñasFiorella Hernández Gutiérrez100% (1)
- Alteraciones del Sistema NeurológicoDocumento30 páginasAlteraciones del Sistema NeurológicoYulianny Romero50% (2)
- 2 Periodo-Guia C.sociales (2021)Documento15 páginas2 Periodo-Guia C.sociales (2021)Beatriz Eugenia Gallego GiraldoAún no hay calificaciones
- Lampara de Sodio de Alta PresiónDocumento13 páginasLampara de Sodio de Alta Presiónjose manuel huisa carrilloAún no hay calificaciones
- HematuriaDocumento33 páginasHematuriaDaniel MezaAún no hay calificaciones
- Caso Clínico Primeros Auxilios 1Documento4 páginasCaso Clínico Primeros Auxilios 1jcontreraschandia19Aún no hay calificaciones
- Cuidando La Vida PropiaDocumento17 páginasCuidando La Vida PropiaCamiAún no hay calificaciones
- FDE-02-08 - La Protección de Trabajadoras Gestantes Expuestas A Radiaciones Ionizantes en El Ámbito SanitarioDocumento2 páginasFDE-02-08 - La Protección de Trabajadoras Gestantes Expuestas A Radiaciones Ionizantes en El Ámbito Sanitarioadriana Centro de Urología EspecializadaAún no hay calificaciones
- Practica 3 SimulaciónDocumento2 páginasPractica 3 SimulaciónNikole Elizabeth SantaCruz CarrascoAún no hay calificaciones
- Series de Tiempo - EstadisticaDocumento12 páginasSeries de Tiempo - EstadisticaJorge Luis Qquellon HuamanAún no hay calificaciones
- El Cordon de SoldaduraDocumento8 páginasEl Cordon de SoldaduraAntonio AntezanaAún no hay calificaciones