Documentos de Académico
Documentos de Profesional
Documentos de Cultura
(p9) Efecto de La Temperatura Sobre La Rapidez de La Reacción
Cargado por
Ernesto Barrera F0 calificaciones0% encontró este documento útil (0 votos)
20 vistas5 páginasEfecto de la Temperatura
Título original
(p9)Efecto de La Temperatura Sobre La Rapidez de La Reacción
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEfecto de la Temperatura
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
20 vistas5 páginas(p9) Efecto de La Temperatura Sobre La Rapidez de La Reacción
Cargado por
Ernesto Barrera FEfecto de la Temperatura
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
EFECTO DE LA TEMPERATURA SOBRE LA RAPIDEZ DE LA REACCIÓN.
CINÉTICA DE YODACIÓN DE LA ACETONA
I. OBJETIVO GENERAL
Estudiar el efecto de la temperatura sobre la rapidez de reacción.
II. OBJETIVOS PARTICULARES
a) Determinar la constante de rapidez de reacción a varias temperaturas
b) Obtener la energía de activación de reacción y el factor pre-exponencial de la
ecuación de Arrhenius.
III PROBLEMA
Obtener la ecuación que relaciona la variación de la constante de rapidez de reacción con
la temperatura.
V. REACTIVOS Y MATERIALES
Reactivos: Material y Equipo
(I2 – KI) (0.002M- 0.2M) HCl 0.323 M 1 Espectrofotómetro
Acetona 1.33 M 2 celdas espectrofotométricas
1 cronómetro
1 termómetros
3 vasos de precipitados de 50 ml
Un baño de agua con control de temperatura
3 buretas de 50mL con soporte (por grupo)
VI. PROPUESTA DEL DISEÑO EXPERIMENTAL
Llevar a cabo una discusión grupal, identificar las variables involucradas y plantear la hipótesis
para proponer el diseño del experimento que pueda conducir a la resolución del problema
planteado (considerar que en el laboratorio se dispone del material indicado en el punto V).
Cuadro 1. Propuesta de diseño experimental.
Corrida T °C Vaso 1 (Acetona Vaso 2 I2 0.002M
1.33M + HCl 0.323M)
1 T ambiente 4 ml + 2 ml 4 ml
2 T ambiente + 10 °C 20 ml + 10 ml 20 ml
T ambiente – 10 °C 20 ml + 10 ml 20 ml
VII. DATOS, CÁLCULOS Y RESULTADOS
1. Registrar los datos experimentales de tiempo y absorbancia para cada corrida en las tablas
2,3 y 4.
2. Algoritmo de cálculos
a) Calcular la concentración de yodo a cada tiempo y temperatura, a partir de la
ecuación obtenida de la curva patrón, la práctica de Técnicas Analíticas (P. 7).
Registrar los datos en las tablas 2,3 y 4.
b) Explicar cómo se obtiene la energía de activación y el factor pre-exponencial
utilizando la ecuación de Arrhenius. (Métodos gráfico y/o analítico)
TABLA 2. Registro de datos de tiempos, absorbancia y concentraciones.
Espectrofotómetro._____Modelo._________________
Temperatura _______________ _________________nm
t (seg) Abs C In C 1/C
0 771 1.99818582 0.69223927 0.50045396
30 700 1.81417649 0.59563164 0.55121429
60 670 1.73642607 0.55182902 0.57589552
90 734 1.90229364 0.64306034 0.5256812
120 606 1.57055851 0.45143129 0.63671617
150 573 1.48503304 0.39543702 0.67338569
180 539 1.3969159 0.33426688 0.71586271
210 510 1.32175716 0.27896203 0.75656863
240 471 1.22068161 0.1994094 0.81921444
270 436 1.12997279 0.12219355 0.88497706
300 401 1.03926396 0.03851273 0.96221945
330 367 0.95114682 -0.05008684 1.0513624
360 332 0.86043799 -0.15031372 1.1621988
390 290 0.7515874 -0.28556777 1.33051724
420 261 0.67642866 -0.39092829 1.47835249
450 225 0.58312816 -0.53934829 1.71488889
480 191 0.49501101 -0.70317526 2.02015707
510 154 0.39911883 -0.91849609 2.50551948
540 132 0.34210185 -1.07264677 2.92310606
570 121 0.31359337 -1.15965815 3.18884298
600 0.088 0.00022807 -8.38586716 4384.65909
630 0.058 0.00015032 -8.80276096 6652.58621
660 0.03 7.775E-05 -9.46200659 12861.6667
690 0.01 2.5917E-05 -10.5606189 38585
720 0 0 #¡NUM! #¡DIV/0!
TABLA 3. Registro de datos de tiempos, absorbancia y concentraciones.
Espectrofotómetro._____Modelo._________________
Temperatura _______________ _________________nm
t (seg) Abs C In C 1/C
0 820
30 742
60 677
90 609
120 540
150 414
180 342
210 272
240 206
270 0.063
300 0.034
330 0.029
360 0.039
390 0.040
420 0.039
450 0.039
480 0.039
TABLA 4. Registro de datos de tiempos, absorbancia y concentraciones.
Espectrofotómetro._____Modelo._________________
Temperatura _______________ _________________nm
t (seg) Abs C In C 1/C
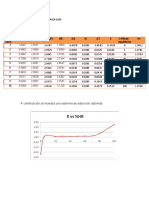
VIII. ELABORACIÓN DE GRÁFICOS
1. Trazar las gráficas de (C vs. t); (Ln C vs. t) y (1/C vs. t) para cada temperatura, y
comprobar el orden de reacción para el yodo (n) y determinar las constantes de rapidez
aparentes (kps).
TABLA 3. Con los valores de kps llenar la siguiente tabla:
T°C T(K) 1/T(K^-1) kps Ln kps
26.1 299.25 0.00334169
36.1 309.25 0.00323363
2. Trazar la gráfica de ln kps vs 1/T. Determinar la Ea y A.
IX. ANÁLISIS DE RESULTADOS
1. ¿De qué orden es la reacción?
2. ¿Cambia el orden de reacción con la temperatura?
3. ¿Cómo cambia la constante de rapidez de reacción con la temperatura?
4. ¿Qué valor tiene la energía de activación? ¿Cuáles son sus unidades?
5. ¿Qué valor tiene el factor pre-exponencial? ¿Cuáles son sus unidades? ¿Qué
significado tiene este valor?
X. CONCLUSIONES
XI. MANEJO DE RESIDUOS
También podría gustarte
- Efecto de la temperatura en la cinética de yodación de la acetonaDocumento9 páginasEfecto de la temperatura en la cinética de yodación de la acetonaMario VerdeAún no hay calificaciones
- Ramp RacDocumento10 páginasRamp RacTann MoralesAún no hay calificaciones
- Practica 8 Influencia de La Temp Sobre La Rapidez en La Yodacion de La AcetonaDocumento10 páginasPractica 8 Influencia de La Temp Sobre La Rapidez en La Yodacion de La AcetonaAlexis Sebastian RodriguezAún no hay calificaciones
- Practica 10. CatalisisDocumento14 páginasPractica 10. Catalisis320246908Aún no hay calificaciones
- Determinación del comportamiento hidráulico de reactores mediante el método de Wolf-ResnickDocumento8 páginasDeterminación del comportamiento hidráulico de reactores mediante el método de Wolf-ResnickCamilaAún no hay calificaciones
- Tarea 1Documento6 páginasTarea 1selene vèlizAún no hay calificaciones
- Práctica 8 Influencia de La Temp Sobre La Rapidez en La Yodación de La AcetonaDocumento7 páginasPráctica 8 Influencia de La Temp Sobre La Rapidez en La Yodación de La AcetonaEspy Flores100% (1)
- Laboratorio 2-Mecanica de FluidosDocumento25 páginasLaboratorio 2-Mecanica de FluidosPedro PiscoyaAún no hay calificaciones
- Informe de Destiacion BatchDocumento6 páginasInforme de Destiacion BatchFkl Porroa DaavidAún no hay calificaciones
- Brigada 4 Grupo 23 - P2Documento11 páginasBrigada 4 Grupo 23 - P2r yo noAún no hay calificaciones
- CZZCDocumento13 páginasCZZCHenry Valda ZuñigaAún no hay calificaciones
- Descomposición de Urea Por UreasaDocumento10 páginasDescomposición de Urea Por UreasaFernanda GómezAún no hay calificaciones
- Calibracion de Un Termistor CNTDocumento9 páginasCalibracion de Un Termistor CNTJhonatan Meza AparicioAún no hay calificaciones
- Reporte Seminario IvDocumento12 páginasReporte Seminario IvSanz SharlotteAún no hay calificaciones
- REACCION YODO-PERSULFATODocumento11 páginasREACCION YODO-PERSULFATOFabiana Gonzales CastilloAún no hay calificaciones
- Procesos de Separación - Destilación Por LotesDocumento16 páginasProcesos de Separación - Destilación Por LotesFrancisco Javier Velázquez JiménezAún no hay calificaciones
- Practica 5 RectilineoDocumento24 páginasPractica 5 RectilineoLaPalanK RotaAún no hay calificaciones
- Laboratorio#6 - Ley de Enfriamiento de NewtonDocumento11 páginasLaboratorio#6 - Ley de Enfriamiento de NewtonJoshua CarbajalAún no hay calificaciones
- Tablas TermotecniaDocumento30 páginasTablas TermotecniaJunior RodriguezAún no hay calificaciones
- Moldelo Energy 2DDocumento9 páginasMoldelo Energy 2DJose LopezAún no hay calificaciones
- Parcial III Termodinamica I (01-2016) SolucionarioDocumento6 páginasParcial III Termodinamica I (01-2016) SolucionarioROSA ISELA REYES JIMENEZAún no hay calificaciones
- Presión de Vapor de Agua A Alta TemperaturaDocumento2 páginasPresión de Vapor de Agua A Alta TemperaturaIsaac Laura CasillaAún no hay calificaciones
- Practica 1 - Isotermas de AdsorcionDocumento5 páginasPractica 1 - Isotermas de AdsorcionRem Minxola100% (3)
- Enfriamiento de NewtonDocumento8 páginasEnfriamiento de NewtonJhenny Callisaya BlancoAún no hay calificaciones
- INFORME LABORATORIO 2 CALOR Casi CompletoDocumento16 páginasINFORME LABORATORIO 2 CALOR Casi CompletoJoseAlejandroSeguraGalvisAún no hay calificaciones
- Ejemplo de Cálculos Reflujo Total MET-AGUADocumento16 páginasEjemplo de Cálculos Reflujo Total MET-AGUASalic PecheAún no hay calificaciones
- Reporte ProyectoDocumento12 páginasReporte ProyectoCarlos Gutiérrez OrnelasAún no hay calificaciones
- Factor Equivalencia de CargaDocumento35 páginasFactor Equivalencia de CargaDiego Manosalva OrtizAún no hay calificaciones
- EJEMPLOS AjusteDocumento9 páginasEJEMPLOS AjusteMilagros VegaAún no hay calificaciones
- Cinética Practica 9 (Reporte)Documento11 páginasCinética Practica 9 (Reporte)Axel Sama100% (1)
- Informe de Laboratorio Trabajo y Energía CinéticaDocumento16 páginasInforme de Laboratorio Trabajo y Energía CinéticavictorAún no hay calificaciones
- Influencia de La Temperatura Sobre La Rapidez de La Reacción. Cinética de Yodación de La Acetona.Documento9 páginasInfluencia de La Temperatura Sobre La Rapidez de La Reacción. Cinética de Yodación de La Acetona.Daniel Kbylan100% (1)
- Tubodestefan-Reyes Rizo Juan CarlosDocumento12 páginasTubodestefan-Reyes Rizo Juan Carlosjuankiak1Aún no hay calificaciones
- PDF 02 Henley Espaol Primeros Ejerciciosdocx - CompressDocumento6 páginasPDF 02 Henley Espaol Primeros Ejerciciosdocx - CompressMariela Mamani ChoqueAún no hay calificaciones
- Laboratori de CineticaDocumento11 páginasLaboratori de CineticaJhon Varela100% (1)
- Informe4 - Isotermas de Adsorción - Cardenas - Chávez-Arroyo - Flores & SanchezDocumento11 páginasInforme4 - Isotermas de Adsorción - Cardenas - Chávez-Arroyo - Flores & SanchezAbril Chavez-Arroyo EnzianAún no hay calificaciones
- Practica 3 Ley de Raoult - EQUIPO3-1Documento6 páginasPractica 3 Ley de Raoult - EQUIPO3-1Adriana PérezAún no hay calificaciones
- Determinación del mecanismo cinético que gobierna la reacción de pirolusita con SO2Documento8 páginasDeterminación del mecanismo cinético que gobierna la reacción de pirolusita con SO2joan davidAún no hay calificaciones
- Tarea 3 Desarrollar Los Siguientes Ejercicios de Aplicación Sobre Caudales.Documento6 páginasTarea 3 Desarrollar Los Siguientes Ejercicios de Aplicación Sobre Caudales.Dennis MartínezAún no hay calificaciones
- Medición de temperatura y potencia en laboratorio de termofluidosDocumento9 páginasMedición de temperatura y potencia en laboratorio de termofluidosGuillermoAún no hay calificaciones
- Informe FluidizacionDocumento9 páginasInforme FluidizacionJesús VieraAún no hay calificaciones
- Practica 8 TecnoDocumento9 páginasPractica 8 Tecnodaniel maguiñaAún no hay calificaciones
- Lab GasesDocumento9 páginasLab GasesBenito LazoAún no hay calificaciones
- Practica 9 Laboratorio de TermodinamicaDocumento10 páginasPractica 9 Laboratorio de TermodinamicaCarlos FraustoAún no hay calificaciones
- Evidencia de AprendizajeDocumento6 páginasEvidencia de AprendizajeYadira Gutiérrez ZavalaAún no hay calificaciones
- Análisis de transferencia de calor por convección y radiación en láminas metálicasDocumento20 páginasAnálisis de transferencia de calor por convección y radiación en láminas metálicasJoseAlejandroSeguraGalvisAún no hay calificaciones
- Informe 2 Calibracion de SensoresDocumento17 páginasInforme 2 Calibracion de SensoresJason SanchezAún no hay calificaciones
- Laboratorio2 - Mec. de Materiales - Grupo2Documento19 páginasLaboratorio2 - Mec. de Materiales - Grupo2ana zuletaAún no hay calificaciones
- Informe de Solidos 3Documento9 páginasInforme de Solidos 3Wilmer LemacheAún no hay calificaciones
- Simulación de separación de pozosDocumento4 páginasSimulación de separación de pozosDon juanAún no hay calificaciones
- Presion de VaporDocumento12 páginasPresion de VaporAnGie MaRtineZAún no hay calificaciones
- Tarea1 InformeDocumento11 páginasTarea1 InformeDANNY MOISES GARCIA COREAAún no hay calificaciones
- Trabajo Final - SISMO UPCDocumento33 páginasTrabajo Final - SISMO UPCJairoMuñozAlegreAún no hay calificaciones
- Reporte Practica 5 Destilacion ESIQIEDocumento22 páginasReporte Practica 5 Destilacion ESIQIEAraceli GarcíaAún no hay calificaciones
- Calibracion de Un TermistorDocumento9 páginasCalibracion de Un TermistorYurico Vergara CoronelAún no hay calificaciones
- Péndulo simpleDocumento20 páginasPéndulo simpleGibran Meza CastrejonAún no hay calificaciones
- Grupo 7 - Monografia-IieeDocumento15 páginasGrupo 7 - Monografia-IieeAlvaro Javier García Ames100% (1)
- Guía de mantenimiento de instalaciones fotovoltaicasDe EverandGuía de mantenimiento de instalaciones fotovoltaicasAún no hay calificaciones
- UF0902 - Caracterización de instalaciones de climatizaciónDe EverandUF0902 - Caracterización de instalaciones de climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Metodologias de La InvestigacionDocumento3 páginasMetodologias de La InvestigacionFaustino AlvarezAún no hay calificaciones
- Operaciones Intelectuales Del ConocimientoDocumento8 páginasOperaciones Intelectuales Del ConocimientoMaria TorresAún no hay calificaciones
- Semana2 Marco - Chicaiza 06 Al 10 Junio 2022Documento9 páginasSemana2 Marco - Chicaiza 06 Al 10 Junio 2022ingmarco72Aún no hay calificaciones
- Artículo Por Qué Una Instruccion Mínimamente Guiada No Funciona - CompressedDocumento14 páginasArtículo Por Qué Una Instruccion Mínimamente Guiada No Funciona - CompressedLa Pelota NosemanchaAún no hay calificaciones
- 1.1.1. Planteamiento y Justificacion de La InvestigacionDocumento3 páginas1.1.1. Planteamiento y Justificacion de La InvestigacionAntony NaulaAún no hay calificaciones
- Analisis Del Video Saber ObservarDocumento2 páginasAnalisis Del Video Saber ObservarLeslia Calla PalaciosAún no hay calificaciones
- Epistemología EnsayoDocumento5 páginasEpistemología Ensayogiovanndavid210% (1)
- Completando Frases, "Desarrollo Cognitivo"Documento4 páginasCompletando Frases, "Desarrollo Cognitivo"jesus huerta espinoza100% (1)
- Neo Conductismo: Universidad Nacional Hermilio Valdizán Facultad de Psicología Escuela Profesional de PsicologíaDocumento22 páginasNeo Conductismo: Universidad Nacional Hermilio Valdizán Facultad de Psicología Escuela Profesional de PsicologíaLuis Alberto RiveraAún no hay calificaciones
- Isaac Newton PDFDocumento34 páginasIsaac Newton PDFCinthia Yossi Cajachagua HilarioAún no hay calificaciones
- Pressed PDFDocumento212 páginasPressed PDFDATILERO7813100% (2)
- Diferencias entre masa y peso en diferentes cuerpos celestesDocumento5 páginasDiferencias entre masa y peso en diferentes cuerpos celestesriyuanaAún no hay calificaciones
- Definición de Línea de InvestigaciónDocumento26 páginasDefinición de Línea de InvestigaciónCesarAún no hay calificaciones
- El Cambio de Paradigma en El Campo de La ArchivisticaDocumento39 páginasEl Cambio de Paradigma en El Campo de La ArchivisticaLuis ChoqueAún no hay calificaciones
- Pensamiento analítico y sintético: complementariedad en la construcción del pensamiento matemáticoDocumento16 páginasPensamiento analítico y sintético: complementariedad en la construcción del pensamiento matemáticoAdalberto Talaigua TilbeAún no hay calificaciones
- Topografia 1Documento14 páginasTopografia 1Milagros Jesus Espinoza sucsoAún no hay calificaciones
- Metodología de La InvestigaciónDocumento10 páginasMetodología de La InvestigaciónRosAún no hay calificaciones
- Matriz de Consistencia y Operacionalizacin - Yair Meza - Jonathan Mendoza - LPHDocumento4 páginasMatriz de Consistencia y Operacionalizacin - Yair Meza - Jonathan Mendoza - LPHLuis Martín Pinedo HerreraAún no hay calificaciones
- Orígenes instrumentos evaluación psicológicaDocumento4 páginasOrígenes instrumentos evaluación psicológicaMaria Jose Fasabi TiconaAún no hay calificaciones
- Ciencia, ciberespacio y sociedad del riesgoDocumento5 páginasCiencia, ciberespacio y sociedad del riesgoOquely Ortiz FloresAún no hay calificaciones
- Principales Medidas en EpidemiologíaDocumento35 páginasPrincipales Medidas en EpidemiologíaHenry Fernando Garcia LimonAún no hay calificaciones
- Trabajo Modulo I - Gutierrez ChavezDocumento32 páginasTrabajo Modulo I - Gutierrez Chavezrussito28Aún no hay calificaciones
- Tipos de InvestigacionDocumento3 páginasTipos de InvestigacionLisseth PaguayAún no hay calificaciones
- Sistematización de Cuencas HidrograficasDocumento18 páginasSistematización de Cuencas Hidrograficasroman arangoAún no hay calificaciones
- Preston. Una Introducción A La Teoría Del Desarrollo. Capítulo 9Documento6 páginasPreston. Una Introducción A La Teoría Del Desarrollo. Capítulo 9Yenny Paulet Romero Galindo75% (4)
- GUÍA 3. Determinación de Masa, Volumen y Tratamientos de DatosDocumento6 páginasGUÍA 3. Determinación de Masa, Volumen y Tratamientos de DatosLuisclAún no hay calificaciones
- Algunas Concepciones Sobre Las MatemáticasDocumento3 páginasAlgunas Concepciones Sobre Las MatemáticasjavimauricioAún no hay calificaciones
- Administración EmpíricaDocumento7 páginasAdministración EmpíricaLu PastorAún no hay calificaciones
- Selección de La Muestra ExposicionDocumento20 páginasSelección de La Muestra Exposicionrivera100% (1)
- Qué es la EconometríaDocumento21 páginasQué es la EconometríaFiorella TapiaAún no hay calificaciones