Documentos de Académico
Documentos de Profesional
Documentos de Cultura
So Luci Ones
Cargado por
Mauro Alejandro ChocobarDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
So Luci Ones
Cargado por
Mauro Alejandro ChocobarCopyright:
Formatos disponibles
lOMoARcPSD|6838866
Soluciones
Química (Instituto Universitario Politécnico Santiago Mariño)
Studocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Guía de Soluciones
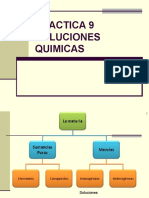
Mezclas: Son sistemas dispersos, que están presentes por todas partes. Una dispersión de material,
sólido, líquido o gaseoso (fase dispersa) que esta disuelta en otra sustancia (sólida, líquida o gaseosa) que
constituye la fase dispersora.
Se clasifican en:
Mezclas Heterogéneas: No son uniformes; en algunos casos, puede observarse la discontinuidad a simple
vista (sal y carbón, por ejemplo); en otros casos, debe usarse una mayor resolución para observar la
discontinuidad.
Mezclas Homogéneas: Son totalmente uniformes (no presentan discontinuidades al ultramicroscopio) y
presentan iguales propiedades y composición en todo el sistema, algunos ejemplos son la salmuera, el aire.
Estas mezclas homogéneas se denominan soluciones.
Pueden distinguirse algunos tipos de mezclas homogéneas: Coloides, emulsiones, Suspensiones y
Soluciones.
Coloides: Son mezclas que sus partículas se encuentran entre 10 a 20 nanómetros (1X10-12m), no se ven a
simple vista, no se sedimentan en reposo y no se pueden separar por filtración. Se reconocen mediante el
efecto Tyndall y el efecto Browniano.
Efecto Tyndall: Es el fenómeno físico que hace que las partículas coloidales en una disolución o un gas
sean visibles al dispersar la luz. Por el contrario, en las disoluciones verdaderas y los gases sin partículas
en suspensión son transparentes, pues prácticamente no dispersan la luz. Por ejemplo, el efecto Tyndall
es notable cuando los faros de un coche se usan en la niebla.
La luz con menor longitud de onda se dispersa mejor, por lo que el color de la luz esparcida tiene un tono
azulado. La luz que reciben las partículas es desviada de la trayectoria inicial y se hacen visibles las
partículas.
También por este mismo efecto el cielo se percibe azul. La luz del sol es dispersada por la atmósfera, en
mayor medida por la región del espectro electromagnético que corresponde al azul.
Efecto Browniano: Es el movimiento aleatorio que se observa en algunas partículas microscópicas que se
hallan en un medio fluido. Recibe su nombre en honor al escoces Robert Brown. El movimiento estocástico
de estas partículas se debe a que su superficie es bombardeada incesantemente por las moléculas
(átomos) del fluido sometido a una agitación térmica.
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Emulsión: Es una mezcla de dos líquidos inmiscibles de manera más o menos homogénea. Un líquido (la
fase dispersa) es dispersada en otro (la fase continua o fase dispersante). Muchas emulsiones son de
aceites/agua, encontrados en la vida diaria.
Suspensiones: Son mezclas que cuando están en reposo se sedimentan, se pueden separar, son turbias y
se pueden ver sus partículas luego del reposo.
Soluciones: Son sistemas homogéneos formados básicamente por soluto y solvente. Donde el soluto es la
sustancia que se disuelve el disolvente la sustancia que disuelve. La masa total de la solución es la suma de
la masa de soluto más la masa del solvente. Pueden tener cualquier estado físico. La capacidad que tiene
un soluto de disolverse en un solvente depende mucho de la temperatura y de las propiedades químicas de
ambos.
Concentración: Es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente.
Se pueden clasificar:
De forma cualitativa:
Saturada: Es aquella que contiene la máxima cantidad de soluto que pueda mantenerse disuelto en una
determinada cantidad de solvente a una temperatura establecida.
Insaturada: Es aquella donde la masa del soluto disuelta con respecto a la solución saturada es menor a
la misma temperatura y masa del solvente.
Concentrada: Es aquella donde la masa del soluto disuelta es próxima determinada por la solubilidad a la
misma temperatura
Sobresaturada: Es aquella que contiene una mayor cantidad de soluto que una solución saturada a
temperatura determinada. Y se convierte en una solución inestable.
De forma cuantitativa
Unidades Físicas
Estas unidades suelen expresarse en porcentajes (%), no importa la naturaleza del soluto, referidos a la
masa (gramos) y al volumen (mililitros)
Porcentaje referido a la masa (% P/P): Relaciona la masa de soluto, en gramos, presente en una
cantidad dada de solución. Si dice 4% en peso indica que se tiene “4 gramos de soluto por cada 100
gramos de solución”, para hallar este porcentaje se utiliza la siguiente expresión:
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Porcentaje referido al volumen (%v/v): Se refiere al volumen de soluto en mililitros (mL), presente en
cada 100 mL de solución. Si se tiene 5% v/v significa que se tiene 5 mL de soluto disueltos en 100 mL de
solución, se expresa:
Porcentaje peso a volumen (% P/V): Representa la masa de soluto (en gramos) por cada 100 mL de
solución, se puede hallar con la siguiente expresión:
Y en algunos casos puede necesitarse:
Unidades Químicas
Estas unidades se basan en el concepto de mol. Recuerda que un mol india la cantidad de moléculas
(átomos o partículas) presentes en una sustancia y su equivalencia corresponde al peso molecular del
compuesto o peso atómico de los átomos.
Molaridad (M) (mol/L): Se define como el número de moles de soluto disuelto en un litro de solución.
Matemáticamente se expresa así:
O de esta otra forma:
Molalidad (m) (mol/Kg ste): Indica la cantidad de moles de soluto presente en un Kilogramo (Kg) de
solvente.
O de esta otra forma:
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Normalidad (N): Relaciona el número de equivalentes gramos o equivalentes químicos de un soluto con la
cantidad de solución (1 L)
Equivalente gramo o equivalente químico se refiere al tipo de compuesto que se utiliza. Si es un ácido se
divide el Peso Molecular entre el número de hidrógenos (H) presente, si es un hidróxido entre el número
de iones oxidrilos (OH) y si es una sal entre el número de cationes (cargas positivas) (siempre se
encuentran entre el ión o lo que deriva del ácido).Se expresa:
O también:
Fracción Molar (X): es adimensional (no tiene dimensiones) se refiere a la relación de los moles (tanto
del soluto (s) y el solvente(s)) entre los moles totales de una disolución. (en la parte práctica se asumen
los porcentajes entre 100, es decir una solución al 5% de sal, la sal tiene como fracción molar del soluto,
5/100= Xsto= 0,05 )
Se expresa:
NOTA: Un solución puede tener más de un solvente y también más de un soluto, aquí se deben considerar
todos para que la sumatoria de 1
Diluciones: Existe una expresión muy útil para calcular la concentración de una solución cuando se debe
diluir desde un volumen de concentración conocida, hasta un volumen de normalidad desconocida
.N1 * V1 = N2 * V2 ; también se puede emplear con molaridad M1 * V1 = M2 *V2
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejemplos
1.- Se disuelven 20 g de NaOH en 560 g de agua. Calcula: a) la concentración de la disolución en % en
masa y b) su molalidad. ( (PaNa 23, PaO=16 y PaH=1.)
Datos: Soluc = 20 g + 560 g = 580 g de soluc
Sto= 20 g % m/ m = (20 g/580 g) * 100 = 3,45 % m/m
Ste= 560 g m = 20 g /(40 g/mol* 0, 56 Kg ste) o también
PM NaOH = 40g/mo m = 0,5 mol/0,56 Kg ste
m = 0,89 molal o 0,89 mol/Kg ste
Formulas Recordar:
%m/m = gsot/gsoluc*100 1Kg = 1000 g => 560g => 0,56Kg
m = moles sto/ Kgste n = 20g / 40 g/mol = 0,5 moles
soluc = sto + ste
2.- ¿Qué cantidad de glucosa, C6H12O6 (PM = 180 g/mol), se necesita para preparar 100 cm3 de disolución
0,2 molar?
Datos: g sto = M* V(L) soluc * PM sto
Sto= ?? g g sto = 0,2 mol/L*0,1L* 180 g/mol = 36 g
Solución = 100 cm3 = 100 mL = 0,1 L o También moles sto = M* V(L)
PM C6H12O6 = 180 g/mol moles sto = 0,2 mol/L *0,1L
g sto = 0,2 mol * 180 g / mol = 36 g
Formulas Recordar:
M= moles sto/ V(L) soluc. 1 L = 1000 mL => 100mL = 0, 1 L
M = g sto / (PM sto* V(L)soluc 1mL = 1 cm3
n (moles) = gsto / PM sto
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
También podría gustarte
- Soluciones Odisoluciones QuimicasDocumento46 páginasSoluciones Odisoluciones QuimicasKevin BarahonaAún no hay calificaciones
- Soluciones PorcentualesDocumento8 páginasSoluciones PorcentualesMarlen Tlapanco43% (7)
- Tema 5 SolucionesDocumento63 páginasTema 5 SolucionesDasigo SzkamardaAún no hay calificaciones
- SolucionesDocumento49 páginasSolucionessorsire LabarcaAún no hay calificaciones
- Quimica de Cuarto AñoDocumento6 páginasQuimica de Cuarto AñoreiquerdAún no hay calificaciones
- Qui MicaDocumento9 páginasQui Micaesteban perezAún no hay calificaciones
- Soluciones QuímicasDocumento35 páginasSoluciones QuímicasDiego WalAún no hay calificaciones
- Relaciones EstequiometricasDocumento39 páginasRelaciones EstequiometricasAnthony Soto L.50% (2)
- Las SolucionesDocumento57 páginasLas SolucionesJorge SegoviaAún no hay calificaciones
- So Luci OnesDocumento46 páginasSo Luci OnesLuis Fernando0% (1)
- Laboratorio Analitica Practica #1Documento19 páginasLaboratorio Analitica Practica #1eylen OviedoAún no hay calificaciones
- Soluciones QuimicasDocumento74 páginasSoluciones QuimicasIrwin HerediaAún no hay calificaciones
- Disoluciones QuímicasDocumento21 páginasDisoluciones QuímicasLuis Jiménez100% (1)
- Soluciones 2Documento14 páginasSoluciones 2Gabriela GutierrezAún no hay calificaciones
- 10 - Disoluciones QuimicasDocumento8 páginas10 - Disoluciones QuimicasFaustino Peña CarrascoAún no hay calificaciones
- Calculos Estequiométricos Masa-Masa - Docx Masa-Volumen - Docx Volumen-VolumenDocumento4 páginasCalculos Estequiométricos Masa-Masa - Docx Masa-Volumen - Docx Volumen-VolumenAngel Morales50% (4)
- Preparacion de DisolucionesDocumento5 páginasPreparacion de DisolucionesflaviaAún no hay calificaciones
- Tema-5 20 21Documento28 páginasTema-5 20 21Pilar de la CruzAún no hay calificaciones
- DisolucionesDocumento14 páginasDisolucionesKarol MorenoAún no hay calificaciones
- Curso+Lab+Teoria Sesión+3 SolucionesDocumento49 páginasCurso+Lab+Teoria Sesión+3 SolucionesAlma UrrutiaAún no hay calificaciones
- Unidades para Expresar La Concentración de Disoluciones: Unidades Físicas o Unidades QuímicasDocumento5 páginasUnidades para Expresar La Concentración de Disoluciones: Unidades Físicas o Unidades QuímicasflaviaAún no hay calificaciones
- Exposicion SolucionesDocumento43 páginasExposicion SolucionesJuan Villalobos NuñezAún no hay calificaciones
- Parte 1 SolucionesDocumento90 páginasParte 1 SolucionesBryan GuamanAún no hay calificaciones
- Tutoria PPT Disol.Documento85 páginasTutoria PPT Disol.Benjamin MuñozAún no hay calificaciones
- Las Soluciones-CsjDocumento57 páginasLas Soluciones-CsjQuenguan FranklinAún no hay calificaciones
- Soluciones Quimicas - Propiedades ColigativasDocumento43 páginasSoluciones Quimicas - Propiedades ColigativasAlfredo CruzAún no hay calificaciones
- Estequiometría de DisolucionesDocumento17 páginasEstequiometría de DisolucionesFernandaYanixelRiveraRosasAún no hay calificaciones
- Power Qui Concentracion 2Documento13 páginasPower Qui Concentracion 2talyvisandovalAún no hay calificaciones
- Practica N°7Documento9 páginasPractica N°7Geraldine Vasquez arcentalesAún no hay calificaciones
- 01 Talleer Soluciones PDFDocumento7 páginas01 Talleer Soluciones PDFJAIME USECHAún no hay calificaciones
- Lectura 3 - Unidades de ConcentraciónDocumento10 páginasLectura 3 - Unidades de ConcentraciónEloy García LunaAún no hay calificaciones
- Tema #4 Soluciones Quimicas y Sus PropiedadesDocumento8 páginasTema #4 Soluciones Quimicas y Sus Propiedadesoyolaeliseo65Aún no hay calificaciones
- 2 - Material de Apoyo - SolucionesDocumento17 páginas2 - Material de Apoyo - SolucionesIvana EstelaAún no hay calificaciones
- Unidad 6. SOLUCIONES OkDocumento37 páginasUnidad 6. SOLUCIONES OkJOSUE SEBASTIAN VALENCIA CUENCAAún no hay calificaciones
- Taller Quimica InorganicaDocumento9 páginasTaller Quimica InorganicaNos Fuimos FonotecaAún no hay calificaciones
- SolucionesDocumento37 páginasSolucionesGerald Paul Chumpitaz HuanquiAún no hay calificaciones
- Taller 4 Concentraciones 20192Documento10 páginasTaller 4 Concentraciones 20192kevin RodriguezAún no hay calificaciones
- Feum OsmolalidadDocumento2 páginasFeum OsmolalidadLuis CárdenasAún no hay calificaciones
- Exposicion 1, 2 y 3 SolucionesDocumento44 páginasExposicion 1, 2 y 3 SolucionesAlfredo CruzAún no hay calificaciones
- 2 de Bach Unidades de ConcentraciónDocumento27 páginas2 de Bach Unidades de Concentraciónerick tixiAún no hay calificaciones
- Quimica EstudiarDocumento41 páginasQuimica EstudiarDaniela Paillalef CabreraAún no hay calificaciones
- Unidad 1 SolucionesDocumento41 páginasUnidad 1 SolucionesKaren Martín Rozas SanAún no hay calificaciones
- Trabajo Integrador Terminado de QuimicaDocumento13 páginasTrabajo Integrador Terminado de QuimicaLuis Arturo González ValenciaAún no hay calificaciones
- Poesia 26 de Mayo MajitoDocumento38 páginasPoesia 26 de Mayo MajitoVanessa Guizelly Olvea ZapanaAún no hay calificaciones
- GUIA de Disoluciones-2Documento19 páginasGUIA de Disoluciones-2Inforlink Impresiones100% (1)
- Soluciones PresentacionDocumento31 páginasSoluciones PresentacionJacqueline Humanez MartinezAún no hay calificaciones
- 3 - QUI5217 - C7 - APUNTEACADEMICO QuímicaDocumento15 páginas3 - QUI5217 - C7 - APUNTEACADEMICO QuímicaVanessa KotzingAún no hay calificaciones
- Soluc M, M, N, FMDocumento11 páginasSoluc M, M, N, FMAndres ChenAún no hay calificaciones
- Soluciones 2Documento6 páginasSoluciones 2Camilo PeñaAún no hay calificaciones
- Informe 1 - 92GDocumento19 páginasInforme 1 - 92GJhon Paul Sanchez100% (1)
- Unidades Quimicas de ConcentracionDocumento6 páginasUnidades Quimicas de ConcentracionValenthinapuelloAún no hay calificaciones
- Agroquimica JorgeLuisCruzOrdoñez PDFDocumento7 páginasAgroquimica JorgeLuisCruzOrdoñez PDFRodrigo Estudillo LopezAún no hay calificaciones
- Grupo4 QuimicaDocumento27 páginasGrupo4 QuimicaAngie CrucesAún no hay calificaciones
- Guía Grado 11 Quimica MolalidadDocumento4 páginasGuía Grado 11 Quimica Molalidadgustavo herreraAún no hay calificaciones
- Estequiometria de Disoluciones y Análisis QuímicoDocumento11 páginasEstequiometria de Disoluciones y Análisis Químicosalma villegas50% (2)
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Buque Tanque Quimiquero 2014Documento138 páginasBuque Tanque Quimiquero 2014Matías QuirogaAún no hay calificaciones
- Cloruro de ViniloDocumento5 páginasCloruro de ViniloDelem SaviñonAún no hay calificaciones
- Capitulo 2 Biologia de Los Microorganismos de Uso IndustrialDocumento11 páginasCapitulo 2 Biologia de Los Microorganismos de Uso IndustrialXavii RaMirezAún no hay calificaciones
- Resumen 3er Parcial de Ciencia de Los MaterialesDocumento13 páginasResumen 3er Parcial de Ciencia de Los MaterialesFederico MariniAún no hay calificaciones
- Ficha Tecnica Colestimetato SodicoDocumento10 páginasFicha Tecnica Colestimetato SodicoClaudia CalderónAún no hay calificaciones
- Guía Octavo - Fórmula MolecularDocumento4 páginasGuía Octavo - Fórmula MolecularViviana Alejandra Mora DiazAún no hay calificaciones
- Este Ciclo Ocurre Como Un Mecanismo de Comunicación Entre Músculo e Hígado Con El Objetivo de Regenerar A La GlucosaDocumento9 páginasEste Ciclo Ocurre Como Un Mecanismo de Comunicación Entre Músculo e Hígado Con El Objetivo de Regenerar A La Glucosakaren garciaAún no hay calificaciones
- Manejo de Paciente IntoxicadoDocumento25 páginasManejo de Paciente IntoxicadoMarilyn Paola Bernal Salamanca100% (1)
- Elaboración de Moldes Rígidos y Flexibles en Diferentes MaterialesDocumento4 páginasElaboración de Moldes Rígidos y Flexibles en Diferentes MaterialesJohan LozanoAún no hay calificaciones
- Ejercicios de PreparaciónDocumento4 páginasEjercicios de PreparaciónJosue Guevara GalvisAún no hay calificaciones
- Taller Fuerzas Intemoleculares Complemento LecturaDocumento2 páginasTaller Fuerzas Intemoleculares Complemento LecturaAlejandro PalacioAún no hay calificaciones
- Alcohol JycDocumento2 páginasAlcohol JycMilenaAún no hay calificaciones
- Aluminio en Envases Farmacéuticos INTRODUCCIONDocumento7 páginasAluminio en Envases Farmacéuticos INTRODUCCIONCami AntunesAún no hay calificaciones
- Sistemas de Proteccion y ControlDocumento20 páginasSistemas de Proteccion y Controlvania vergara vergara100% (1)
- EETT Sede Social Tipo ADocumento18 páginasEETT Sede Social Tipo AJosé IgnacioAún no hay calificaciones
- Introducción CriobiologíaDocumento3 páginasIntroducción CriobiologíaLiss ContrerasAún no hay calificaciones
- Coloración Del BencenoDocumento9 páginasColoración Del BencenoLuis HuilcaAún no hay calificaciones
- Tarea 4 Quimica Organica Cilia BalantaDocumento18 páginasTarea 4 Quimica Organica Cilia Balantajohn ortegaAún no hay calificaciones
- PDF Laboratorio 6 Reacciones Quimicas Grupo n2 DDDocumento29 páginasPDF Laboratorio 6 Reacciones Quimicas Grupo n2 DDBryan Tejada SaenzAún no hay calificaciones
- Q.Inorgánica NITROGENOIDESDocumento8 páginasQ.Inorgánica NITROGENOIDESBronco Wlady Corn-CarrAún no hay calificaciones
- Sistemas DispersosDocumento5 páginasSistemas DispersosMia Aylin Gutiérrez OlivaresAún no hay calificaciones
- Amorceur Lampe IM 1000 WDocumento4 páginasAmorceur Lampe IM 1000 Wtariq boukhlikAún no hay calificaciones
- Espacios ConfinadosDocumento33 páginasEspacios ConfinadosEco construccionesAún no hay calificaciones
- Fabricación Del Acero - Paula Rojas - 000416Documento59 páginasFabricación Del Acero - Paula Rojas - 000416Cristian Gallegos MuñozAún no hay calificaciones
- El IridioDocumento18 páginasEl Iridioclucero9Aún no hay calificaciones
- Diseño Mecanico de Resipientes A PresionDocumento20 páginasDiseño Mecanico de Resipientes A PresionJesus SerranoAún no hay calificaciones
- Guía e Informe de Laboratorio MicrobiologíaDocumento6 páginasGuía e Informe de Laboratorio MicrobiologíaLAURA VIVIANA AMAYA BUITRAGOAún no hay calificaciones
- LISTA DE RADICALES Quimica IIDocumento2 páginasLISTA DE RADICALES Quimica IIEJIMAún no hay calificaciones
- Informe #9 QuimicaDocumento6 páginasInforme #9 QuimicaLAURA YINETH CASTILLO QUINTEROAún no hay calificaciones
- Unidad Educativa Municipal "Sucre": Qúimica OrgánicaDocumento34 páginasUnidad Educativa Municipal "Sucre": Qúimica OrgánicaElian 2F LliveAún no hay calificaciones