0% encontró este documento útil (0 votos)
1K vistas82 páginasMODULO 4. Macroscopia de La V30
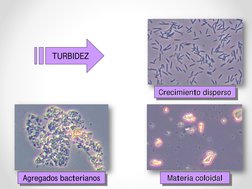
Este documento proporciona información sobre la macroscopía de la V30 en el monitoreo de la edad del fango mediante análisis rápido. Algunos de los puntos clave incluyen: el color gris del fango indica deficiencia de oxígeno, mientras que el marrón es típico de condiciones estables; el tamaño pequeño del macroflóculo (<0,5 cm) y la alta turbidez sugieren problemas; y la sedimentabilidad rápida es deseable en comparación con la lenta. El documento también anal
Cargado por
ANDRES CASTAÑEDA ANZALDODerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas82 páginasMODULO 4. Macroscopia de La V30
Este documento proporciona información sobre la macroscopía de la V30 en el monitoreo de la edad del fango mediante análisis rápido. Algunos de los puntos clave incluyen: el color gris del fango indica deficiencia de oxígeno, mientras que el marrón es típico de condiciones estables; el tamaño pequeño del macroflóculo (<0,5 cm) y la alta turbidez sugieren problemas; y la sedimentabilidad rápida es deseable en comparación con la lenta. El documento también anal
Cargado por
ANDRES CASTAÑEDA ANZALDODerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd