Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cloruro de Sodio
Cargado por
Sharon Alexandra Bolaños SilvaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cloruro de Sodio
Cargado por
Sharon Alexandra Bolaños SilvaCopyright:
Formatos disponibles
Buscar en Wikipedia Crear una cuenta Acceder
Cloruro de sodio 80 idiomas
Contenidos [ocultar] Artículo Discusión Leer Editar Ver historial Herramientas
Inicio
Propiedades químicas Para una descripción de su uso como condimento, véase Sal común.
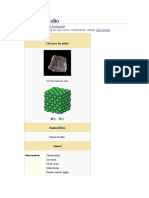
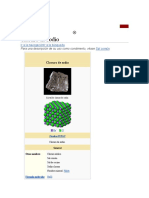
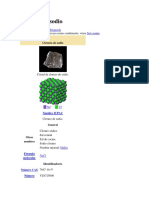
Estructura cristalina El cloruro de sodio, sal común o sal de mesa, denominada en su forma mineral como halita, es un
compuesto químico con la fórmula NaCl. El cloruro de sodio es una de las sales responsables de la Cloruro de sodio
Producción
salinidad del océano y del fluido extracelular de muchos organismos. Es también el componente de la sal
Regulación fisiológica
común, usada como condimento y conservante de alimentos.
Aplicaciones
Con masas molareses de 22,99 y 35,45 g/mol respectivamente, 100 g de NaCl contienen 39,34 g de Na y
Antiséptico local y preservante de 60,66 g de Cl. En su forma comestible, la sal (también conocida como sal de mesa) se utiliza
alimentos
habitualmente como condimento y curado y conservante de alimentos Se utilizan grandes cantidades de
Usos industriales diversos
cloruro sódico en muchos procesos industriales, y es una fuente importante de compuestos de sodio y
Fundente del hielo cloro utilizados como materia primaspara posteriores síntesis químicas. Otra aplicación importante del
Cristal de cloruro de sodio.
Efectos medioambientales cloruro sódico es la descongelación de carreteras cuando el clima es bajo cero.
Plantas En la antigüedad, el cloruro de sodio era muy apetecido como un bien transable y como condimento, y se
Industria alimentaria y agricultura remuneraba en la época preclásica romana a los soldados que construían la Vía Salaria, que empezaba
en las canteras de Ostia hasta Roma, con un generoso salarium argentum.
Medicina
Referencias
Propiedades químicas [ editar ]
Enlaces externos
Es un compuesto iónico formado por un catión sodio (Na+) y un anión cloruro (Cl-), y ,puede sufrir las __ Na+ __ Cl-
reacciones características de cualquiera de estos dos iones. Como cualquier otro cloruro iónico soluble, Nombre IUPAC
precipita cloruros insolubles cuando es agregado a una disolución de una sal metálica apropiada, como Cloruro de sodio.
General
nitrato de plata:
Otros Cloruro sódico
NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq) nombres Sal común
Sal de cocina
Otro método para separar ambos componentes es mediante la electrólisis.
Sodio cloruro
Si se aplica una corriente eléctrica continua con un elevado potencial a una salmuera alcalina, el producto Nombre mineral: Halita
anódico es gas dicloro (Cl2) y los catódicos son hidróxido de sodio (NaOH) y dihidrógeno (H2). Fórmula NaCl
molecular
electrólisis: 2 NaCl(aq) → 2 NaOH(aq) + Cl2(gas) + H2(gas) Identificadores
Como la mayoría de las sales iónicas confiere propiedades coligativas a sus disoluciones, es decir, es Número CAS 7647-14-51
capaz de variar la presión de vapor de la disolución, elevar el punto de ebullición y descender el punto de Número VZ4725000
RTECS
congelación según su concentración molal.
ChEBI 26710
ChEMBL CHEMBL1200574
Estructura cristalina [ editar ] ChemSpider 5044
Cuando el cloruro de sodio está en estado sólido, sus átomos se acomodan en una estructura cristalina DrugBank 09153
PubChem 5234
cúbica, como es de esperarse en una unión iónica ocasionada por los campos electrostáticos de sus
UNII 451W47IQ8X
átomos. Cada ion se acomoda en el centro de un octaedro regular quedando rodeado por 6 iones de
KEGG D02056 C13563, D02056
cargas opuestas distribuidos en los vértices del octaedro.
InChI [mostrar]
Esta misma estructura básica se encuentra en muchos otros compuestos y es comúnmente conocida Propiedades físicas
como la estructura cristalina de halita o sal de roca. Se puede representar como una red cúbica centrada Apariencia Incoloro; aunque parece blanco si
en la cara (fcc) con una base de dos átomos o como dos redes cúbicas centradas en la cara son cristales finos o pulverizados.
Densidad 2160 kg/m³; 2,16 g/cm³
interpenetrantes. El primer átomo se encuentra en cada punto de celosía.
Masa molar 58,443 g/mol
Punto de 1074 K (801 °C)
Producción [ editar ] fusión
Punto de 1738 K (1465 °C)
El cloruro de sodio es producido en masa por la evaporación de agua de mar o salmuera de otros
ebullición
recursos, como lagos salados, y minando la roca de sal, llamada halita.
Estructura f.c.c.
En 2002, la producción mundial de sal se estimó en 210 millones de toneladas métricas, y los principales cristalina
países productores fueron Estados Unidos (40.3 millones de toneladas), China (32.9), Alemania (17.7), Índice de 1,544202
refracción
India (14.5) y Canadá (12.3).2 A
(nD)
Propiedades químicas
Regulación fisiológica [ editar ] Solubilidad 359 g/L en agua
en agua
El ion Na+ es causante de la regulación osmótica celular regulando el potencial de membrana expulsando
Producto de 37,79 mol²
el ion K +, facilita en gran manera el impulso nervioso y es aportado al organismo en gran medida como solubilidad
sal de mesa. Termoquímica
ΔfH0gas -181,42 kJ/mol
Aplicaciones [ editar ] ΔfH0líquido -385,92 kJ/mol
ΔfH0sólido -411,12 kJ/mol
El cloruro de sodio es usado universalmente como aditivo alimentario. También se usa en la producción
S0gas, 1 bar 229,79 J·mol–1·K
de papel y celulosa, en los productos de baño y en detergentes. Además de los usos domésticos
S0líquido, 1 bar 95,06 J·mol–1·K–1
familiares de la sal, las aplicaciones más dominantes de la producción de aproximadamente 250 millones
S0sólido 72,11 J·mol–1·K–1
de toneladas por año (datos de 2008) incluyen productos químicos y descongelación.3
Peligrosidad
NFPA 704
Antiséptico local y preservante de alimentos [ editar ]
0
La sal, gracias a su elevado poder osmótico, es capaz de deshidratar un amplio espectro de virus y 0 0
bacterias en estado no esporulado, por lo que se usa como un doloroso antiséptico para desinfectar
heridas. Riesgos
Muy pocos microorganismos, como los halófilos y organismos superiores como los crustáceo Ingestión Peligroso en grandes cantidades;
su uso a largo plazo en
braquiópodos conocidos como las Artemias, pueden resistirse al poder osmótico de la sal. Entre los cantidades normales puede traer
microorganismos resistentes a la salinidad está el caso de la bacteria B. marismortui, encontrada en el problemas en los riñones; Su
mar Muerto. consumo excesivo también está
relacionado con la hipertensión
La salazón de la carne es una forma de preservar ésta de la acción bacteriana, ya que la sal retrasa la arterial.
descomposición proteínica. Para preservar alimentos, el cloruro de sodio extrae el agua de estos, Inhalación Puede producir irritación en altas
impidiendo el crecimiento de las bacterias.4 5 cantidades.
Piel Puede producir resequedad.
Usos industriales diversos [ editar ] Ojos Puede producir irritación y
molestia.
El cloruro sódico es muy utilizado, por lo que incluso aplicaciones relativamente menores pueden Compuestos relacionados
consumir cantidades masivas. En la exploración de petróleo y gas, la sal es un componente importante Cloruros Cloruro de potasio, cloruro de
de los fluidos de perforación en la perforación de pozos. Se utiliza para flocularizar y aumentar la alcalinos litio, cloruro de cesio
densidad del fluido de perforación para superar las altas presiones de gas de fondo de pozo. Cada vez Haluros de Bromuro sódico, fluoruro sódico,
sodio ioduro sódico
que un taladro golpea una formación salina, se añade sal al fluido de perforación para saturar la solución
Valores en el SI y en condiciones estándar
con el fin de minimizar la disolución dentro del estrato salino.3 La sal también se utiliza para aumentar el
(25 ℃ y 1 atm), salvo que se indique lo contrario.
curado del hormigón en las carcasas cementadas.6 >. [editar datos en Wikidata]
En textiles y tintorería, la sal se utiliza como enjuague de salmuera para separar contaminantes
orgánicos, para promover el "salado" de precipitados de colorantes y para mezclar con colorantes concentrados para estandarizarlos[aclaración requerida].
Una de sus principales funciones es proporcionar la carga iónica positiva para promover la absorción de los iones de carga negativa de los colorantes.6
También se utiliza en el procesamiento de aluminio, berilio, cobre, acero y vanadio. En la industria del papel y la pasta de papel, la sal se utiliza para
blanquear la pasta de madera. También se utiliza para fabricar clorato sódico, que se añade junto con ácido sulfúrico y agua para fabricar dióxido de cloro,
un excelente producto químico blanqueador a base de oxígeno. El proceso del dióxido de cloro, que se originó en Alemania después de la Primera Guerra
Mundial, es cada vez más popular debido a las presiones medioambientales para reducir o eliminar los compuestos blanqueadores clorados. En el curtido
y el tratamiento del cuero, la sal se añade a las pieles de los animales para inhibir la actividad microbiana en la parte inferior de las pieles y para atraer la
humedad de vuelta a las pieles.6
En la fabricación de caucho, la sal se utiliza para fabricar buna, neopreno y caucho blanco. La salmuera y el ácido sulfúrico se utilizan para coagular un
látex emulsionado hecho de butadieno clorado.6 3
También se añade sal para asegurar el suelo y dar firmeza a los cimientos sobre los que se construyen las autopistas. La sal actúa para minimizar los
efectos del desplazamiento causado en el subsuelo por los cambios de humedad y la carga de tráfico.6
El cloruro sódico se utiliza a veces como desecante barato y seguro debido a sus propiedades higroscópicas, lo que hace de la salazón un método eficaz
de conservación de alimentos históricamente; la sal extrae el agua de las bacterias mediante presión osmótica, impidiendo que se reproduzcan, una de
las principales fuentes de deterioro de los alimentos. Aunque existen desecantes más eficaces, pocos son seguros para la ingestión humana.
Fundente del hielo [ editar ]
El cloruro de sodio en salmuera (la mezcla comercial para una solución saturada alcanza los 270 g por litro)
es el fundente del hielo y de la nieve más usado en vialidad. Al disolverse la sal en el agua, baja el punto de
congelación de ésta. En contacto con el agua provoca una reacción endotérmica que precisa de aporte de
calor, que toma del ambiente o de la superficie de contacto, entalpía, (ΔH= -385.820 KJ/mol).
La segunda aplicación más importante de la sal es el deshielo y el antihielo de las carreteras, tanto en
depósitos de arena como esparcida por vehículos de servicio invernal. En previsión de las nevadas, las
carreteras se "antihielan" de forma óptima con salmuera (solución concentrada de sal en agua), que impide
la adherencia entre la nieve y la superficie de la carretera. Este procedimiento evita el uso intensivo de sal
Diagrama de fases de la mezcla agua-
tras la nevada. Para el deshielo, se utilizan mezclas de salmuera y sal, a veces con agentes adicionales
NaCl
como cloruro de calcio y/o cloruro de magnesio. El uso de sal o salmuera se vuelve ineficaz por debajo de
−10 grados Celsius (14 °F).
La sal para deshielo en el Reino Unido procede predominantemente de una única mina de Winsford en
Cheshire. Antes de su distribución, se mezcla con <100 ppm de ferrocianuro de sodio como agente
antiaglomerante, lo que permite que la sal gema fluya libremente fuera de los vehículos de arenado a pesar
de haber sido almacenada antes de su uso. En los últimos años, este aditivo también se ha utilizado en la sal
de mesa. Se han utilizado otros aditivos en la sal de carretera para reducir los costes totales. En EE. UU., por
ejemplo, se mezcló con sal gema una solución de carbohidratos subproducto del procesado de la remolacha
azucarera que se adhirió a la superficie de las carreteras un 40% mejor que la sal gema suelta. Al
permanecer más tiempo en la carretera, el tratamiento no tenía que repetirse varias veces, lo que ahorraba
Toneladas de sal de carretera para su tiempo y dinero.6
uso en invierno
En términos técnicos de fisicoquímica, el punto de congelación mínimo de una mezcla de agua y sal es de
−21,12 grados Celsius (−6,0 °F) para un 23,31% en peso de sal. Sin embargo, la congelación cerca de esta
concentración es tan lenta que el punto eutéctico de −22,4 grados Celsius (−8,3 °F) puede alcanzarse con un 25 % en peso de sal.7
Efectos medioambientales [ editar ]
La sal de carretera acaba en masas de agua dulce y podría perjudicar a las plantas y animales acuáticos al alterar su capacidad de osmorregulación.8 La
omnipresencia de la sal plantea un problema en cualquier aplicación de revestimientos costeros, ya que las sales atrapadas causan grandes problemas
de adherencia. Las autoridades navales y los constructores de barcos controlan las concentraciones de sal en las superficies durante la construcción. Las
concentraciones máximas de sal en las superficies dependen de la autoridad y de la aplicación. La normativa de la IMO es la más utilizada y fija los
niveles de sal en un máximo de 50 mg/m2 de sales solubles medidas como cloruro sódico. Estas mediciones se realizan mediante un test de Bresle. La
salinización (aumento de la salinidad, también conocido como síndrome de salinización del agua dulce) y el consiguiente aumento de la lixiviación de
metales es un problema constante en toda América del Norte y en las vías fluviales dulces europeas.9 .
En el deshielo de carreteras, la sal se ha asociado a la corrosión de los tableros de los puentes, los vehículos de motor, las barras y alambres de refuerzo
y las estructuras de acero sin protección utilizadas en la construcción de carreteras. La escorrentía superficial, la pulverización de vehículos y las acciones
del viento también afectan al suelo, a la vegetación de los bordes de las carreteras y a los suministros locales de aguas superficiales y subterráneas.
Aunque se han encontrado pruebas de carga ambiental de sal durante los picos de uso, las lluvias y deshielos primaverales suelen diluir las
concentraciones de sodio en la zona donde se aplicó la sal.6 Un estudio de 2009 descubrió que aproximadamente el 70% de la sal de carretera que se
aplica en el área metropolitana de Minneapolis-Saint Paul se retiene en la cuenca local. 10
Plantas [ editar ]
El sodio es un nutriente no esencial para las plantas, que lo necesitan en dosis muy bajas. Excepcionalmente, ciertos grupos de plantas, como las plantas
C4, o la CAM, necesitan dosis mayores de este elemento.
Por otra parte, el exceso de sal en el medio resulta perjudicial para la mayor parte de las plantas (salinidad del suelo o sustrato), ya que provoca su
desecación por ósmosis (el agua se desplaza hacia el ámbito más salino). Un síntoma característico son las quemaduras de los bordes de las hojas.
Solamente las plantas llamadas halofitas han desarrollado un proceso que evita esa pérdida de agua.
Industria alimentaria y agricultura [ editar ]
Artículo principal: Sal
Muchos microorganismoss no pueden vivir en un medio salado: el agua sale de sus células por ósmosis. Por esta razón, la sal se utiliza para conservar
algunos alimentos, como el tocino, el pescado o la col.
La sal se añade a los alimentos, ya sea por el productor o por el consumidor, como potenciador del sabor, conservante, aglutinante, aditivo de control de
la fermentación, agente de control de la textura y revelador del color. El consumo de sal en la industria alimentaria se subdivide, en orden descendente de
consumo, en otros productos de elaboración de alimentos, envasadores de carne, enlatado, panadería, productos lácteos y molinería de cereales. La sal
se añade para favorecer el desarrollo del color en el tocino, el jamón y otros productos cárnicos procesados. Como conservante, la sal inhibe el
crecimiento de bacterias. La sal actúa como aglutinante en los embutidoss para formar un gel aglutinante compuesto de carne, grasa y humedad. La sal
también actúa como potenciador del sabor y como ablandador.6
En muchas industrias lácteas, la sal se añade al queso como agente de control del color, la fermentación y la textura. El subsector lácteo incluye
empresas que fabrican mantequilla de nata, leche condensada y evaporada, postres congelados, helados, queso natural y procesado, y productos lácteos
especiales. En el enlatado, la sal se añade principalmente como potenciador del sabor y conservante. También se utiliza como portador de otros
ingredientes, agente deshidratante, inhibidor de enzimas y ablandador. En panadería, la sal se añade para controlar la velocidad de fermentación de la
masa de pan. También se utiliza para fortalecer el gluten (el complejo elástico proteína-agua de ciertas masas) y como potenciador del sabor, por ejemplo
como cobertura de productos horneados. La categoría de procesado de alimentos también incluye productos de molinería. Estos productos consisten en
moler harina y arroz y fabricar cereales para el desayuno y harina mezclada o preparada. La sal también se utiliza como condimento, por ejemplo, en
patatas fritas, pretzels y comida para perros y gatos.6
El cloruro sódico se utiliza en medicina veterinaria como agente emesis-causante. Se administra como solución saturada caliente. La emesis también
puede ser causada por la faringe colocación de pequeñas cantidades de sal común o cristales de sal.
Medicina [ editar ]
Es el antídoto natural del nitrato de plata, metabolizándolo en cloruro de plata, sustancia prácticamente atóxica que el cuerpo puede excretar con
seguridad.11
Referencias [ editar ]
1. ↑ Número CAS
2. ↑ Susan R. Feldman. Sodium chloride. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2005.
doi 10.1002/0471238961.1915040902051820.a01.pub2
3. ↑ a b c Westphal, Gisbert et al. (2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim .
4. ↑ Parra, Sergio (6 de agosto de 2015). «El secreto para conservar alimentos durante la historia: sal, acidez y bacterias del propio alimento» . Consultado el 13 de
agosto de 2017.
5. ↑ Andresrguez (18 de febrero de 2010). «¿Por qué se emplean las salazones para conservar alimentos?» . Ciencias y cosas. Consultado el 13 de agosto de 2017.
6. ↑ a b c d e f g h i Error en la cita: Etiqueta <ref> no válida; no se ha definido el contenido de las referencias llamadas usgs
7. ↑ Error en la cita: Etiqueta <ref> no válida; no se ha definido el contenido de las referencias llamadas u1
8. ↑ Rastogi, Nina (16 de febrero de 2010) ¿La sal de carretera perjudica al medio ambiente? slate.com.
9. ↑ «Las vías fluviales salinas están creando peligrosos 'cócteles químicos' » . phys.org.
10. ↑ «La mayor parte de la sal de carretera llega a lagos y ríos» . www.sciencedaily.com. Universidad de Minnesota. 20 de febrero de 2009. Consultado el 27 de
septiembre de 2015.
11. ↑ Calabrese, Alberto I.; Astolfi, Emilio A. (enero de 1969). Toxicología. Buenos Aires, Argentina: Kapelusz. p. 190. OCLC 14501248 .
Enlaces externos [ editar ]
La salinidad en el suelo.
Proyectos Wikimedia · Datos: Q2314 · Multimedia: Sodium chloride / Q2314
Identificadores · GND: 4352912-4 · NKC: ph189249 · AAT: 300183888 · Identificadores médicos · MeSH: D012965 · UMLS:
Control de autoridades C0037494 · Identificadores químicos · Número CAS: 7647-14-5 · Números EINECS: 231-598-3 · Código ATC: B05CB01 · RTECS:
VZ4725000 · ChEBI: 26710 · ChEMBL: CHEMBL1200574 · ChemSpider: 5044 · DrugBank: 09153 · PubChem: 5234 · UNII:
451W47IQ8X · KEGG: C13563 · SMILES: ID · InChI: ID · InChI key: ID · Identificadores biológicos · MGI: 7647-14-5
Categorías: Cloruros Compuestos de sodio Conservantes Código ATC B Antisépticos Sustitutos del plasma Sal
Esta página se editó por última vez el 3 abr 2023 a las 09:16.
El texto está disponible bajo la Licencia Creative Commons Atribución Compartir Igual 3.0; pueden aplicarse cláusulas adicionales. Al usar este sitio, usted acepta nuestros términos de uso y nuestra política de privacidad.
Wikipedia® es una marca registrada de la Fundación Wikimedia, Inc., una organización sin ánimo de lucro.
Política de privacidad Acerca de Wikipedia Limitación de responsabilidad Versión para móviles Desarrolladores Estadísticas Declaración de cookies
También podría gustarte
- Ensayos Por Via HumedaDocumento15 páginasEnsayos Por Via HumedaAndrésArenas92% (13)
- Cloruro de SodioDocumento10 páginasCloruro de SodioJohn Rafael Carrillo DolugarAún no hay calificaciones
- Cloruro de SodioDocumento10 páginasCloruro de SodiobetshabeAún no hay calificaciones
- Tema de TesisDocumento18 páginasTema de TesisJose Carlos Huamani QuicañoAún no hay calificaciones
- MoleculaDocumento16 páginasMoleculaAlexsoulAún no hay calificaciones
- Cloruro de SodioDocumento7 páginasCloruro de SodioJuan Carlos MosqueraAún no hay calificaciones
- Cloruro de Sodio UzielDocumento8 páginasCloruro de Sodio UzielUziel Cosme OjedaAún no hay calificaciones
- Cloruro de SodioDocumento12 páginasCloruro de Sodiovict1992Aún no hay calificaciones
- Sal común: propiedades y usosDocumento4 páginasSal común: propiedades y usosivanjcm85Aún no hay calificaciones
- SodioDocumento9 páginasSodioEnriqueCondoFAún no hay calificaciones
- Cloruro de SodioDocumento2 páginasCloruro de SodioJezziAún no hay calificaciones
- Estudio de Los Principales Grupos y Elementos de La Tabla PeriodicaDocumento23 páginasEstudio de Los Principales Grupos y Elementos de La Tabla PeriodicaAntonio Palacios BautistaAún no hay calificaciones
- Obtencion de SalesDocumento15 páginasObtencion de SalesmatheoussAún no hay calificaciones
- Cloruro de Sodio en Quimica - Buscar Con GoogleDocumento1 páginaCloruro de Sodio en Quimica - Buscar Con GoogleStephanie Pérez JiménezAún no hay calificaciones
- Sal ComúnDocumento24 páginasSal ComúnCompuDell MazateAún no hay calificaciones
- Cloruro de Sodio (NaCl)Documento15 páginasCloruro de Sodio (NaCl)KAROLINA FLORES DUARTEAún no hay calificaciones
- Agua RegiaDocumento10 páginasAgua RegiaSheyla Rios CalzadillaAún no hay calificaciones
- Informe Unidad No 4 (Procesos Petroquimicos)Documento41 páginasInforme Unidad No 4 (Procesos Petroquimicos)GREXY CAMPOSAún no hay calificaciones
- Estructura de Las Sales 7ºDocumento20 páginasEstructura de Las Sales 7ºMARITZA CORTES PARRAAún no hay calificaciones
- Industria Del Acido ClorhidricoDocumento25 páginasIndustria Del Acido ClorhidricoCarlos Andrés Mamani Condori100% (1)
- Sales inorgánicas 40Documento54 páginasSales inorgánicas 40David LozadaAún no hay calificaciones
- Actividad 2 Quimica 9Documento3 páginasActividad 2 Quimica 9Emeli LeudoAún no hay calificaciones
- Sulfato de CobreDocumento5 páginasSulfato de CobredarenAún no hay calificaciones
- Cloruro de Sodio (NaCl) - Estructura, Propiedades, UsosDocumento10 páginasCloruro de Sodio (NaCl) - Estructura, Propiedades, UsosCarlosAún no hay calificaciones
- CorregidoDocumento10 páginasCorregidoNicole QuintoAún no hay calificaciones
- 3er Exm RefinacionDocumento113 páginas3er Exm RefinacionKatherin Carhuas QuispeAún no hay calificaciones
- Sales haloideas y oxisalesDocumento8 páginasSales haloideas y oxisalesEskibel Mendoza RuizAún no hay calificaciones
- Sales Binarias - Equipo5 2Documento11 páginasSales Binarias - Equipo5 2aulrich1342Aún no hay calificaciones
- Sulfato de SodioDocumento8 páginasSulfato de SodioCAICAY OTOYA LUIS EDUARDOAún no hay calificaciones
- Ácido Sulfúrico Y Propiedades Fisicas y QuimicasDocumento14 páginasÁcido Sulfúrico Y Propiedades Fisicas y QuimicasRonal Vásquez BautistaAún no hay calificaciones
- Presentación Sin TítuloDocumento22 páginasPresentación Sin TítuloJulieta AnahiAún no hay calificaciones
- NOMENCLATURADocumento7 páginasNOMENCLATURAisabella medinaAún no hay calificaciones
- Algc - Dimension 3 E4 - LmytDocumento7 páginasAlgc - Dimension 3 E4 - LmytDiego GarciaAún no hay calificaciones
- Nitrato de PlataDocumento4 páginasNitrato de PlataYndira RamirezAún no hay calificaciones
- Carbonato de SodioDocumento3 páginasCarbonato de SodioJorge FyhyhAún no hay calificaciones
- Carbonato de sodio: fórmula, usos e importancia industrialDocumento4 páginasCarbonato de sodio: fórmula, usos e importancia industrialANGELO CIRO ARREDONDOAún no hay calificaciones
- T3 3 Investigacion Msds Acido SulfuricoDocumento33 páginasT3 3 Investigacion Msds Acido Sulfuricopablo dominic toredoAún no hay calificaciones
- Sexto GrupoDocumento9 páginasSexto GrupoLuis Alberto Apaza ArceAún no hay calificaciones
- Informe de Comportamiento de Metales Con AcidoDocumento7 páginasInforme de Comportamiento de Metales Con AcidoFrancys SanchezAún no hay calificaciones
- Sales MixtasDocumento9 páginasSales MixtasPatricia RochaAún no hay calificaciones
- SodioDocumento4 páginasSodioPaulette Michelly Muro camposAún no hay calificaciones
- Acido ClorhidricoDocumento7 páginasAcido ClorhidricoMattias Samir Vidal SilesAún no hay calificaciones
- Semana 12 Grupo IaDocumento64 páginasSemana 12 Grupo IaDarwin Tapia IzaguirreAún no hay calificaciones
- Identificación de IonesDocumento8 páginasIdentificación de IonesDaniela Esther SiñaniAún no hay calificaciones
- Análisis cualitativo de cationesDocumento8 páginasAnálisis cualitativo de cationeswilder condori choque0% (2)
- Semana 12 Grupo IaDocumento64 páginasSemana 12 Grupo IaDarwin Tapia IzaguirreAún no hay calificaciones
- Sulfato cobre azulDocumento8 páginasSulfato cobre azulEDWIN MOLLINEDO VELIZAún no hay calificaciones
- Trabajo Practico2Documento20 páginasTrabajo Practico2Valeria BorghinoAún no hay calificaciones
- Trabajo Práctico N 2-SALES - 100047Documento3 páginasTrabajo Práctico N 2-SALES - 100047catrielceballos10Aún no hay calificaciones
- Cloruro de SodioDocumento7 páginasCloruro de SodioJhosue Rumay SanchezAún no hay calificaciones
- Trabajo de ProcesoDocumento11 páginasTrabajo de ProcesoAlexander A TorresAún no hay calificaciones
- Ud1.3 Productos Químicos en JoyeríaDocumento40 páginasUd1.3 Productos Químicos en JoyeríajmpbAún no hay calificaciones
- QUIMICA INORGANICA .-Clase IIDocumento41 páginasQUIMICA INORGANICA .-Clase IINieve PerezAún no hay calificaciones
- Evaluación diagnóstica ácidos hidrácidosDocumento4 páginasEvaluación diagnóstica ácidos hidrácidosbaba bebeAún no hay calificaciones
- PRECIO 22 Clases 2015 REFINACIONDocumento78 páginasPRECIO 22 Clases 2015 REFINACIONmAún no hay calificaciones
- Lectura Del Cloruro de SodioDocumento1 páginaLectura Del Cloruro de Sodiojean carlos canales brunoAún no hay calificaciones
- HCL - Acido ClorhidricoDocumento24 páginasHCL - Acido ClorhidricoLizeth Puma Ortiz100% (1)
- PtO2 catalizadorDocumento8 páginasPtO2 catalizadordanielsocialAún no hay calificaciones
- Informe Transformaciones de La Materia DesarrolloDocumento4 páginasInforme Transformaciones de La Materia Desarrolloabrahamurbina88Aún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Esquemas de rehidratación parenteral en deshidratación graveDocumento10 páginasEsquemas de rehidratación parenteral en deshidratación graveDaniela Bezaí MoralesAún no hay calificaciones
- ProductoDocumento1 páginaProductoDiego VegaAún no hay calificaciones
- Ejercicios Propuestos 4 PuriDocumento5 páginasEjercicios Propuestos 4 PuriAlejandra Reyes GonzalezAún no hay calificaciones
- Informe de Fruta ConfitadaDocumento16 páginasInforme de Fruta ConfitadaJhon AlexAún no hay calificaciones
- Repaso de BioquimicaDocumento12 páginasRepaso de BioquimicaKassandra Villanueva FranklinAún no hay calificaciones
- Manual de Sialoterapia Curacion A Traves de La SalivaDocumento111 páginasManual de Sialoterapia Curacion A Traves de La SalivaDon Reyes100% (2)
- Semana 1 - Biología - Doc - IngDocumento11 páginasSemana 1 - Biología - Doc - IngDaniela GárateAún no hay calificaciones
- Conductividad de SolucionesDocumento5 páginasConductividad de SolucionesJose CortezAún no hay calificaciones
- Reacciones en Solución Acuosa 2020Documento21 páginasReacciones en Solución Acuosa 2020Jose KuryAún no hay calificaciones
- INF (1) Coloides EDAF 06Documento9 páginasINF (1) Coloides EDAF 06Edy Leon ChavezAún no hay calificaciones
- Determinación de cloruros por volumétrica de MohrDocumento4 páginasDeterminación de cloruros por volumétrica de MohrFrank MejiaAún no hay calificaciones
- Pavimentos LeoDocumento32 páginasPavimentos LeoLeandrus Pezo Pinedo100% (1)
- Ejercicios Tema 3 - Parte 1Documento3 páginasEjercicios Tema 3 - Parte 1MariamAún no hay calificaciones
- Bacterias Halófilas y OsmofilasDocumento13 páginasBacterias Halófilas y OsmofilasDiana Laura Trasviña Gonzalez0% (1)
- Clase 10 Salinidad de TierrasDocumento77 páginasClase 10 Salinidad de TierrasAlonso Mario Laura PaniaguaAún no hay calificaciones
- Cuestionario Quimica de AlimentosDocumento6 páginasCuestionario Quimica de AlimentosMario CabaAún no hay calificaciones
- Presión vapor soluciones químicasDocumento4 páginasPresión vapor soluciones químicasAlexAún no hay calificaciones
- Producción de sal industrialDocumento13 páginasProducción de sal industrialzakumaAún no hay calificaciones
- Cloruro de SodioDocumento3 páginasCloruro de SodioLuisa GuerreroAún no hay calificaciones
- ASTM D 3230 05 Espanol SALINIDAD PDFDocumento7 páginasASTM D 3230 05 Espanol SALINIDAD PDFAlfredo GallardoAún no hay calificaciones
- PT Cloruros en Agua - CorregidoDocumento9 páginasPT Cloruros en Agua - CorregidoharryAún no hay calificaciones
- Inyección de agua: ingeniería conceptual (factibilidad y simulación) enDocumento18 páginasInyección de agua: ingeniería conceptual (factibilidad y simulación) enYulieth Vanessa Ayala FerreiraAún no hay calificaciones
- AISLAMIENTO HALOBACTERIUMDocumento12 páginasAISLAMIENTO HALOBACTERIUMbaenanegreteAún no hay calificaciones
- DetergentesDocumento6 páginasDetergentesTaTi MaRinAún no hay calificaciones
- Practica 3 Estudio de La Materia Elemento, Compuesto y MezclaDocumento4 páginasPractica 3 Estudio de La Materia Elemento, Compuesto y MezclaMichelle BoeslerAún no hay calificaciones
- Densidades 4Documento29 páginasDensidades 4David100% (1)
- Cristales IonicosDocumento10 páginasCristales IonicosAntonio Rafael Blanco MosquedaAún no hay calificaciones
- SSPC-Guía 15 Extracción Sales AceroDocumento13 páginasSSPC-Guía 15 Extracción Sales AcerorevelkAún no hay calificaciones