Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Gravimetria Obtencion Al
Cargado por
Ximena Gutierrez0 calificaciones0% encontró este documento útil (0 votos)
7 vistas3 páginasTítulo original
gravimetria obtencion Al
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
7 vistas3 páginasGravimetria Obtencion Al
Cargado por
Ximena GutierrezCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
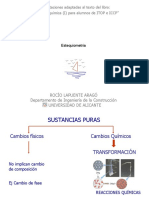
Objetivo
Calcular el porcentaje de Al en una muestra de Sulfato de aluminio Al2 ¿ ¿
REACCIONES DE LAS 2 MUESTRAS
Reacción al agregar el agente precipitante:
Al2 ¿ ¿Na(OH)→ Al(OH¿3 + Na2 SO 4
Se obtiene el Al(OH¿3
Reacción después de la calcinación
Al(OH)3 → Al2O3 + H2O
Se obtiene Al2O3e
MUESTRA 1
DATOS EXPERIEMENTALES
CANTIDAD
Peso del Al2 ¿ 6,0144 gr
Peso del crisol 23,9528 gr
V (utilizado) de hidróxido de sodio 11 ml
(Placa filtrante o crisol + precipitado) − (Placa filtrante o crisol) = (precipitado)
PESO DEL CRISOL + PESO DEL PRECIPITADO
PRECIPITADO DEL 𝐴𝑙(𝑂𝐻)3
Peso inicial de la 29.9672 gr 6,0144 gr
muestra
peso después de 40 24.1202 gr 0.1674 g
min en la mufla
Determinación del % aluminio
( gr de muestra final)
%Al= x100% = 25,67% Al
gr de muestra inicial
Sustituyendo datos tenemos
0 ,1674 gr
%Al= x 100%= 2.7833 %de Al
6,0144 gr
MUESTRA 2
DATOS EXPERIEMENTALES
CANTIDAD
Peso del Al2 ¿ 6,1847 gr
Peso del crisol 26.9441 gr
V (utilizado) de hidróxido de sodio 11 ml
(Placa filtrante o crisol + precipitado) − (Placa filtrante o crisol) = (precipitado)
PESO DEL CRISOL + PESO DEL PRECIPITADO
PRECIPITADO DEL 𝐴𝑙(𝑂𝐻)3
Peso inicial de la 33.1288 gr 6,1847 gr
muestra
peso después de 40 27,1248 gr 0.1807 gr
min en la mufla
Determinación del % aluminio
( gr de muestra final)
%Al= x100%
gr de muestra inicial
Sustituyendo datos tenemos
0.1807 gr
%Al = 6 ,1847 gr x 100%= 2.9217% de Al
ANEXOS
MUESTRA 1
CRISOL VACIO PAPEL FILTRO
Al₂(SO₄) ₃
PESO SÓLIDO NaOH FILTRACIÓN PESO DEL CRISOL +CENIZA
MUESTRA 2
PESO SÓLIDO NaOH PESO CRISOL VACIO PESO DEL CRISOL +CENIZA
También podría gustarte
- Ejercicios Resueltos de GravimetríaDocumento8 páginasEjercicios Resueltos de Gravimetríanano80% (5)
- Trabajo de Campo 4 Quimica InorganicaDocumento7 páginasTrabajo de Campo 4 Quimica InorganicaJuan Victor Llerena Lopez50% (2)
- Ejercicios de GravimetríaDocumento7 páginasEjercicios de GravimetríaWalter Romero B100% (5)
- Ejercicios Resueltos de GravimetriaDocumento26 páginasEjercicios Resueltos de GravimetriacamilaroseroAún no hay calificaciones
- Trabajo de Estequiometria Sem 7Documento12 páginasTrabajo de Estequiometria Sem 7Wilber Eusebio Peralta Llamoca75% (4)
- Tarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Documento10 páginasTarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Pamela Varela100% (1)
- Ejercicios de VolumetriaDocumento34 páginasEjercicios de VolumetriaEmerson Caceres Flores100% (2)
- 36 40Documento2 páginas36 40HolaSoyDavidRCFlëxJr.83% (6)
- Ejercicios Resueltos #06Documento9 páginasEjercicios Resueltos #06Christian DiazAún no hay calificaciones
- Evaluación FinalDocumento6 páginasEvaluación FinalYuri Katherine67% (3)
- Tarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Documento4 páginasTarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Pamela VarelaAún no hay calificaciones
- Taller GrupalDocumento4 páginasTaller GrupalJessica Granizo100% (1)
- Problemas de GavimetriaDocumento5 páginasProblemas de GavimetriaJolsen G-c50% (2)
- Actividad 27 y 28Documento20 páginasActividad 27 y 28Xavier Villon100% (4)
- Tarea Semana 04Documento9 páginasTarea Semana 04brayan jordi rodriguez guizadoAún no hay calificaciones
- Problemas de Gravimetria Ayres 15-1 Al 15-34Documento67 páginasProblemas de Gravimetria Ayres 15-1 Al 15-34Néstor Juan Sánchez Alfaro0% (1)
- Ejercicios de EstequiometriaDocumento8 páginasEjercicios de Estequiometrianuñezgonzalo kevinAún no hay calificaciones
- Taller de Quimica AnaliticaDocumento4 páginasTaller de Quimica AnaliticaEdward Sanchez25% (4)
- AcademiaDocumento473 páginasAcademiafelipeAún no hay calificaciones
- Taller 2 GravimetriaDocumento10 páginasTaller 2 GravimetriaClaudia GuerreroAún no hay calificaciones
- Carlitos XDDocumento7 páginasCarlitos XDOcampo Uribe JulhinaAún no hay calificaciones
- ProblemasDocumento3 páginasProblemasPercy CoraAún no hay calificaciones
- Carlitos XDDocumento8 páginasCarlitos XDJulio Poma TorresAún no hay calificaciones
- 3Documento3 páginas3Edwar Marquez0% (1)
- Peso de Sio 2 Impura Peso de Muestra X 100Documento3 páginasPeso de Sio 2 Impura Peso de Muestra X 100FRANK AGUSTO RAMOS ASTOYAURIAún no hay calificaciones
- Quimica TDocumento5 páginasQuimica TAngel Jesus Alvarez SierraAún no hay calificaciones
- EstequiometriaDocumento17 páginasEstequiometriaJOSEPH STEVEN QUEVEDO BERMEOAún no hay calificaciones
- 1.2.1 EXPOSICIONES de LOS TEMAS Gravimetría, Reglas de Solubilidad, Reacciones de Precipitación, Factor Gravimétrico, KpsDocumento25 páginas1.2.1 EXPOSICIONES de LOS TEMAS Gravimetría, Reglas de Solubilidad, Reacciones de Precipitación, Factor Gravimétrico, KpsEduardo DelgadoAún no hay calificaciones
- Gravimetria3 PDFDocumento39 páginasGravimetria3 PDFJoseph ChitanAún no hay calificaciones
- Tarea Global PT 3 2021 - CompressDocumento33 páginasTarea Global PT 3 2021 - CompressArévalo CristhianAún no hay calificaciones
- DETERMINACION DE Cu - I Uro RAPIDODocumento8 páginasDETERMINACION DE Cu - I Uro RAPIDOGREYS INES HURTADO GALLARDOAún no hay calificaciones
- Factor GravimétricoDocumento4 páginasFactor GravimétricoCarolina de Loera0% (1)
- Practica 5Documento11 páginasPractica 5Erika Ramos PadillaAún no hay calificaciones
- Clase 3Documento4 páginasClase 3Camilo Torres RestrepoAún no hay calificaciones
- Resolución Taller (2) Acidos y BasesDocumento3 páginasResolución Taller (2) Acidos y Bases60117409Aún no hay calificaciones
- Informe Último y Oficial Sobre Ringer LactatoDocumento24 páginasInforme Último y Oficial Sobre Ringer LactatoAna Beatriz Llanos GemioAún no hay calificaciones
- Calculos Quimicos Avanzado Grupo 1-22-12-2021Documento2 páginasCalculos Quimicos Avanzado Grupo 1-22-12-2021lorenaAún no hay calificaciones
- Taller N2 QuimicaDocumento14 páginasTaller N2 QuimicaPUENTES BERDUGO DUVAN STEEVENAún no hay calificaciones
- Trabajo Autónomo 18 Quimica PDFDocumento7 páginasTrabajo Autónomo 18 Quimica PDFRobinson Asencio100% (1)
- Reacciones QMC - 263Documento4 páginasReacciones QMC - 263Maria IsabelAún no hay calificaciones
- Actividad 22Documento7 páginasActividad 22Xavier VillonAún no hay calificaciones
- Práctica CobreDocumento10 páginasPráctica CobreCarreón Hernández Fátima CarolaAún no hay calificaciones
- Problemas de Estequiometría1Documento11 páginasProblemas de Estequiometría1LUIS ANGEL GARCIA PALACIOSAún no hay calificaciones
- Ejercicios 4-8-9-16-17-18Documento4 páginasEjercicios 4-8-9-16-17-18María Sánchez MontesAún no hay calificaciones
- Laboratotio 3 QMCDocumento7 páginasLaboratotio 3 QMCElias HendelsAún no hay calificaciones
- Universidad Nacional de Trujillo Facultad de Ingeniería QuímicaDocumento11 páginasUniversidad Nacional de Trujillo Facultad de Ingeniería QuímicaYanided Valladolis100% (1)
- Tarea 1Documento4 páginasTarea 1Marta A. NuñezAún no hay calificaciones
- Acidos y Bases CuestionarioDocumento11 páginasAcidos y Bases CuestionarioMilagros Baca100% (1)
- Analisis GravimetricoDocumento14 páginasAnalisis GravimetricoAlvaro GuajardoAún no hay calificaciones
- Estequiometría de Una Reacción QuímicaDocumento5 páginasEstequiometría de Una Reacción QuímicaJesus GonzaloAún no hay calificaciones
- Ejercicios Reactivo Limite Pureza y Rendimiento de Una ReacciónDocumento2 páginasEjercicios Reactivo Limite Pureza y Rendimiento de Una Reaccióngloria patricia torres malagonAún no hay calificaciones
- Problemas Analisis 8.3Documento3 páginasProblemas Analisis 8.3Adri EmmaAún no hay calificaciones
- Practica 2 Determinación de Cenizas y Acidez TitulableDocumento5 páginasPractica 2 Determinación de Cenizas y Acidez TitulableMichelle FigueroaAún no hay calificaciones
- Informe de Cloruro y Cloro ResidualDocumento8 páginasInforme de Cloruro y Cloro ResidualAdriana Lucia Florez solorzanoAún no hay calificaciones
- Informe Analitica Practica 9Documento6 páginasInforme Analitica Practica 9Marlli ReyesAún no hay calificaciones
- S06.s1-+Tarea+Calificada ResueltaDocumento5 páginasS06.s1-+Tarea+Calificada Resueltacubas cubas100% (1)
- Trabajo de Quimica - EstequiometríaDocumento6 páginasTrabajo de Quimica - EstequiometríaNICOLEAún no hay calificaciones
- Guia 2 de Estequiometria Con Desarrollo PDFDocumento4 páginasGuia 2 de Estequiometria Con Desarrollo PDFCarolinaAún no hay calificaciones
- Informe 6 de Quimica AnaliticaDocumento9 páginasInforme 6 de Quimica AnaliticaPriscila LuceroAún no hay calificaciones
- Esteoquiometría QuímicaDocumento9 páginasEsteoquiometría QuímicaALEJANDRO EDER ESCRIBA ESCRIBAAún no hay calificaciones
- Informe de Práctica 2Documento9 páginasInforme de Práctica 2lauraAún no hay calificaciones
- Practica Calificada RealizadaDocumento5 páginasPractica Calificada RealizadaArmaxitoFlowyAún no hay calificaciones
- Reacción 6lk5bvolátilDocumento34 páginasReacción 6lk5bvolátilXimena GutierrezAún no hay calificaciones
- ANEXOS AlDocumento2 páginasANEXOS AlXimena GutierrezAún no hay calificaciones
- Flu Jog RamaDocumento3 páginasFlu Jog RamaXimena GutierrezAún no hay calificaciones
- Calculos de La Densidad RelativaDocumento1 páginaCalculos de La Densidad RelativaXimena GutierrezAún no hay calificaciones
- CartaDocumento1 páginaCartaXimena GutierrezAún no hay calificaciones
- Areas ProtegidasDocumento2 páginasAreas ProtegidasXimena GutierrezAún no hay calificaciones
- Formulación de FísicoquimicaDocumento2 páginasFormulación de FísicoquimicaXimena GutierrezAún no hay calificaciones
- Nomenclatura de Complejos Ejercicios-1Documento4 páginasNomenclatura de Complejos Ejercicios-1Ximena GutierrezAún no hay calificaciones
- Ejercicios NOMENCLATURA COMPLEJOS-1Documento12 páginasEjercicios NOMENCLATURA COMPLEJOS-1Ximena GutierrezAún no hay calificaciones
- Lab 17 Propiedades Del AntimonioDocumento4 páginasLab 17 Propiedades Del AntimonioXimena Gutierrez100% (1)
- Estequiometria V.2Documento94 páginasEstequiometria V.2Ximena GutierrezAún no hay calificaciones
- Gases Ideales V.2Documento27 páginasGases Ideales V.2Ximena GutierrezAún no hay calificaciones
- DISOLUCIÓNESDocumento28 páginasDISOLUCIÓNESXimena GutierrezAún no hay calificaciones
- 3 Teoría Del Comercio InternacionalDocumento117 páginas3 Teoría Del Comercio InternacionalJose EspinozaAún no hay calificaciones
- Diseños Instruccionales y Tecnologías de Información y ComunicaciónDocumento4 páginasDiseños Instruccionales y Tecnologías de Información y ComunicaciónZullyAún no hay calificaciones
- Mantenimiento 22 RamirezDocumento2 páginasMantenimiento 22 RamirezAngel SisoAún no hay calificaciones
- Balistica 2da ParteDocumento46 páginasBalistica 2da ParteMARCELL ANTONIO ORTEGA MAMANIAún no hay calificaciones
- Pendulo ElectricoDocumento24 páginasPendulo ElectricoAmadeus Marcas MartinezAún no hay calificaciones
- Thermorecetas 2bDocumento84 páginasThermorecetas 2bavogelpAún no hay calificaciones
- Locomoción AnimalDocumento1 páginaLocomoción AnimalJDCLAún no hay calificaciones
- 15-Salud-Preescolar-Padres de FamiliaDocumento5 páginas15-Salud-Preescolar-Padres de FamiliaJany ArteagaAún no hay calificaciones
- Gomez, Francesc - El Pequeño Libro de Las Redes SocialesDocumento161 páginasGomez, Francesc - El Pequeño Libro de Las Redes SocialesLeidy YF100% (1)
- Caso SodimacDocumento22 páginasCaso SodimacYESSICAAún no hay calificaciones
- ESTEQUIOMETRIADocumento12 páginasESTEQUIOMETRIAnancy100% (1)
- CaratulaDocumento92 páginasCaratulamilon abrahamAún no hay calificaciones
- Problemas Económicos 2022 2Documento13 páginasProblemas Económicos 2022 2jefferson quantAún no hay calificaciones
- Rocol Agrolube Ultra 2 - PPDocumento9 páginasRocol Agrolube Ultra 2 - PPRoberto Alfaro EspinozaAún no hay calificaciones
- Artículo CodependenciaDocumento3 páginasArtículo Codependenciazulema52Aún no hay calificaciones
- Práctica 5 y 8 SensoresDocumento7 páginasPráctica 5 y 8 SensoresJoshua MadoraAún no hay calificaciones
- Guía de Estudio Relaciones IndustrialesDocumento8 páginasGuía de Estudio Relaciones IndustrialesFausto RamirezAún no hay calificaciones
- CAPÍTULO III TIVECA CFDocumento7 páginasCAPÍTULO III TIVECA CFCarlos IseaAún no hay calificaciones
- Semana 5 - Control GubernamentalDocumento12 páginasSemana 5 - Control GubernamentalRichard Ramos AlcántaraAún no hay calificaciones
- Iso 9001 Capitulo 8Documento13 páginasIso 9001 Capitulo 8JOHAN MONTOYAAún no hay calificaciones
- Práctica 3 Movimiento ParabólicoDocumento4 páginasPráctica 3 Movimiento ParabólicoyourokiAún no hay calificaciones
- Principales Compuestos Nitrados IndustrialesDocumento5 páginasPrincipales Compuestos Nitrados IndustrialesYanella MendozaAún no hay calificaciones
- Tarea 6. Sensores de PocisiònDocumento5 páginasTarea 6. Sensores de PocisiònJosé Alfredo Contreras JiménezAún no hay calificaciones
- Charla 5 Minutos Lavado de Manos 2007Documento1 páginaCharla 5 Minutos Lavado de Manos 2007Pauly Villarroel MonteroAún no hay calificaciones
- TRABAJO - Cimentaciones Profundas Por Pilotes - Tipo AIIIDocumento25 páginasTRABAJO - Cimentaciones Profundas Por Pilotes - Tipo AIIIjelsi roddyAún no hay calificaciones
- Los Pequeños Descansos Que Ayudan Al Cerebro A Aprender Cosas NuevasDocumento6 páginasLos Pequeños Descansos Que Ayudan Al Cerebro A Aprender Cosas NuevasGabriel Perez ElizaldeAún no hay calificaciones
- EJERCICIO 1 EstadisticaDocumento2 páginasEJERCICIO 1 EstadisticaAldo R-dAún no hay calificaciones