Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Carta de Hallazgos 17 Marzo
Carta de Hallazgos 17 Marzo
Cargado por
ViridianHernandezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Carta de Hallazgos 17 Marzo
Carta de Hallazgos 17 Marzo
Cargado por
ViridianHernandezCopyright:
Formatos disponibles
Ciudad de México, 17 de marzo de 2023.
Destinatario:
Bonarum Pharma, S.A. de C.V.
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) realizó visita
de verificación sanitaria a su planta de fabricación con domicilio en Km. 19.5 Antigua
Carretera México-Puebla, S/N, Col. Los Reyes Acaquilpan, C.P. 56400, La Paz, Estado de
México del día 23 al 26 de enero de 2023, constatada en el acta sanitaria 23-MF-3315-
00357-MO.
Se acudió al establecimiento para verificar el cumplimiento de las irregularidades
identificadas en anterior visita como consta en el acta 22-MF-3315-00790-DP donde los
verificadores especializados de esta autoridad sanitaria identificaron diversas
irregularidades en la supervisión, organización, limpieza e insumos, entre las que
destacan:
No cuentan con evidencia de retiro de producto fuera de especificación del
mercado, a pesar de que cuentan con antecedentes de productos irregulares.
Los procesos de limpieza no se encuentran validados.
El agua empleada en los procesos de operación, limpieza y sanitización no se
encuentra filtrada y su traslado al área aséptica es por medio de cubetas de acero.
En la evaluación de efectividad de sanitizantes no se considera la detección de
microorganismos.
Los equipos para la fabricación de los medicamentos no cuentan con la calificación
que garantice su funcionamiento.
Oklahoma Núm. 14, Colonia Nápoles, www.gob.mx/cofepris,
Demarcación Territorial Benito Juárez, Ciudad de México, C.P. 03810 t: 55 50 80 52 00
En relación al programa de llenado simulado, no se presenta evidencia de
calificación del personal involucrado y no se establecen las condiciones de
temperatura para la incubación de los frascos y ampolletas en el proceso de llenado
simulado.
Realizan actividades de maquila sin contar con el Certificado de Buenas Prácticas
de Fabricación.
No presentaron evidencia documentada de la capacitación/calificación del personal
designado como auditores líderes.
No presentan evidencia completa de la calificación de su lista de proveedores.
Durante la reciente visita se comprobó que no han sido subsanadas las irregularidades
detectadas, como la empresa lo manifestó mediantes escritos ingresados ante esta
autoridad, por lo que continuará la medida de seguridad consistente en la suspensión de
actividades del establecimiento.
Basado en los hallazgos durante ambas visitas, existen elementos suficientes para
determinar que Bonarum Pharma, S.A. de C.V.. continúa sin cumplir los criterios de
calidad suficientes, lo que constituye un alto riesgo para la salud de la población.
Se hace un llamado a la empresa a solventar las observaciones detectadas por los
inspectores técnicos durante las visitas, a fin de permitir la reanudación de sus
actividades.
Emitimos esta carta de hallazgos, mediante la cual Cofepris reitera su disposición de
contribuir con las mejores alternativas a esta problemática, siempre poniendo al paciente
en el centro de la toma de decisiones y tomando como guía ética la misión de esta
autoridad sanitaria de garantizar el acceso a tratamientos seguros, eficaces y de calidad.
ATENTAMENTE
LA COMISIÓN FEDERAL PARA LA PROTECCIÓN CONTRA RIESGOS SANITARIOS
Nota: Bonarum Pharma, S.A. de C.V. ha sido fabricante de medicamentos como Acetilcolina, Ergometrina,
Hidrocortisona/Mupirocina, Betametasona/Clotrimazol/Gentamicina y Cocarboxilasa para diversos
laboratorios, los cuales se encuentran con permisos revocados, vencidos y/o cancelados.
Como titular del registro, Bonarum Pharma, S.A. de C.V. tiene en proceso de autorización una prórroga para el
registro sanitario del medicamento Acetónido de fluocinolona. Es importante señalar que para este último
producto, se cuentan con múltiples alternativas de fabricación nacionales.
Oklahoma Núm. 14, Colonia Nápoles, www.gob.mx/cofepris,
Demarcación Territorial Benito Juárez, Ciudad de México, C.P. 03810 t: 55 50 80 52 00
También podría gustarte
- Ordenes Médicas Jairo Solano PDFDocumento14 páginasOrdenes Médicas Jairo Solano PDFVendettaAún no hay calificaciones
- 59 Transferencia 2021Documento2 páginas59 Transferencia 2021Imprenta Riera100% (1)
- Programa PQR y RecallDocumento13 páginasPrograma PQR y Recallcristian camilo gil100% (2)
- Procedimiento Normalizado de Operación para La Selección, Adquisición, Recepción y Registro de Medicamentos e InsumosDocumento16 páginasProcedimiento Normalizado de Operación para La Selección, Adquisición, Recepción y Registro de Medicamentos e InsumosdocchimalAún no hay calificaciones
- Control de procesos y seguridad e higiene. INAV0109De EverandControl de procesos y seguridad e higiene. INAV0109Aún no hay calificaciones
- Visita SanitariaDocumento4 páginasVisita SanitariaJair MartinezAún no hay calificaciones
- SedalmerkDocumento3 páginasSedalmerkZurisadahi SanjinezAún no hay calificaciones
- Alta Directiva Sanitaria para Establecimientos Dedicados A Distribucion y Comercializacion de Insumos para SaludDocumento4 páginasAlta Directiva Sanitaria para Establecimientos Dedicados A Distribucion y Comercializacion de Insumos para SaludFernando Herrera robledoAún no hay calificaciones
- Procedimiento Politica de Alcohol y DrogasDocumento17 páginasProcedimiento Politica de Alcohol y DrogasVacunas SpenceAún no hay calificaciones
- Último Informe BPM Bago RRHDocumento18 páginasÚltimo Informe BPM Bago RRHMAHATMA CORPORATIONAún no hay calificaciones
- Guia - Aplicacion - de - Criterios - CBPF Dic 2019Documento16 páginasGuia - Aplicacion - de - Criterios - CBPF Dic 2019Marco Antonio Lopez GarfiasAún no hay calificaciones
- Alerta Sanitaria ANESKET 23042024Documento3 páginasAlerta Sanitaria ANESKET 23042024Paulina PMAún no hay calificaciones
- Comunicado Sobre El Caso PsicofarmaDocumento2 páginasComunicado Sobre El Caso PsicofarmaNeurociencia AlzheimerAún no hay calificaciones
- Plan de Evaluacion ProcesosDocumento3 páginasPlan de Evaluacion ProcesosLuis Ramón GómezAún no hay calificaciones
- Ejemplo DossierDocumento26 páginasEjemplo DossieryorkAún no hay calificaciones
- Aviso de Riesgo Kadcyla 23042024Documento3 páginasAviso de Riesgo Kadcyla 23042024farmacia tarimoyaAún no hay calificaciones
- 18LP3697-98 A DeqsaDocumento12 páginas18LP3697-98 A DeqsaangelAún no hay calificaciones
- Guia Sobre La Aplicacion de Criterios Certificacion de Buenas Practicas de Fabricacion Ver. 06 de Marzo de 2020Documento20 páginasGuia Sobre La Aplicacion de Criterios Certificacion de Buenas Practicas de Fabricacion Ver. 06 de Marzo de 2020Mary Fall100% (1)
- F Cer Aee PP 043 - v02Documento15 páginasF Cer Aee PP 043 - v02Maxcon ExtintoresAún no hay calificaciones
- Agua EnvasadaDocumento20 páginasAgua Envasadaredservicam100% (1)
- Agua EnvasadaDocumento8 páginasAgua EnvasadaMaitane GauerdiAún no hay calificaciones
- Procedimiento y Temario para La Presentación Del Examen de Conocimientos para El RS de Servicios de Control y Exterminación de PlagasDocumento3 páginasProcedimiento y Temario para La Presentación Del Examen de Conocimientos para El RS de Servicios de Control y Exterminación de Plagasalonzo410Aún no hay calificaciones
- Gestión de CALIDAD BIO Riesgos SanitariosDocumento44 páginasGestión de CALIDAD BIO Riesgos SanitariosJaz SanAún no hay calificaciones
- Responsable SanitarioDocumento3 páginasResponsable SanitarioMonserrat Holguin100% (1)
- C2 Nom-059-Ssa1-2015 - ZarmDocumento6 páginasC2 Nom-059-Ssa1-2015 - Zarmzyanzy rojasAún no hay calificaciones
- Lista de Chequeo para Apertura de Un Establecimiento Farmacéutico MinoristaDocumento6 páginasLista de Chequeo para Apertura de Un Establecimiento Farmacéutico Minoristaeliana montagutAún no hay calificaciones
- Boas Praticas de ManufacturaDocumento9 páginasBoas Praticas de ManufacturaIverson BravoAún no hay calificaciones
- Alerta Sanitaria Productos Medzena 08122021Documento2 páginasAlerta Sanitaria Productos Medzena 08122021cnna166Aún no hay calificaciones
- Taller Nº9Documento3 páginasTaller Nº9Evelin Cruz VeraAún no hay calificaciones
- BPM y BPLDocumento15 páginasBPM y BPLJEANAún no hay calificaciones
- Alerta SanitariaDocumento2 páginasAlerta SanitariaCarlos Wall-e HernandezAún no hay calificaciones
- NOM 121 SSA1 1994. Quesos FrescosDocumento10 páginasNOM 121 SSA1 1994. Quesos FrescosZacil Aguilar0% (1)
- Cofepris Alerta Sanitaria, 08dic21 Producto IrregularDocumento2 páginasCofepris Alerta Sanitaria, 08dic21 Producto IrregularBiomedico HdmAún no hay calificaciones
- Grupo Nº3 - Informe de Visita A Una Empresa - Buenas Practicas de Manufactura (BPM)Documento5 páginasGrupo Nº3 - Informe de Visita A Una Empresa - Buenas Practicas de Manufactura (BPM)Nicole NietoAún no hay calificaciones
- HuevoDocumento10 páginasHuevoAbdiel PucAún no hay calificaciones
- Manejo de ResiduosDocumento5 páginasManejo de ResiduosDANIELA STHEFANI CAICEDO GONZALEZAún no hay calificaciones
- 71 Alerta Sanitaria Limustin 19102021VFDocumento3 páginas71 Alerta Sanitaria Limustin 19102021VFDanny A. De LeónAún no hay calificaciones
- Laboratorios Analiticos AutorizadosDocumento236 páginasLaboratorios Analiticos AutorizadosFelix Martin GutierrezAún no hay calificaciones
- Aviso de Riesgo River Side 26052023Documento6 páginasAviso de Riesgo River Side 26052023Miguel AguayoAún no hay calificaciones
- Caracterización Del Proceso de Administración de Operaciones en La Farmacia Rio Grita 2Documento9 páginasCaracterización Del Proceso de Administración de Operaciones en La Farmacia Rio Grita 2cordorlord2012Aún no hay calificaciones
- Guía BPM - Productos FitoterapéuticosDocumento6 páginasGuía BPM - Productos FitoterapéuticosFabian MassAún no hay calificaciones
- Requisitos Resolucion MXDocumento5 páginasRequisitos Resolucion MXAlvaro NietoAún no hay calificaciones
- Certificacion en BP Oficina FarmaceuticaDocumento16 páginasCertificacion en BP Oficina FarmaceuticaEdith YS0% (1)
- Unidad 2 - Paso 1 - Fundamentacion - Yuli Andrea Garcia M.Documento7 páginasUnidad 2 - Paso 1 - Fundamentacion - Yuli Andrea Garcia M.lore girlezaAún no hay calificaciones
- NOM1儿啊parteDocumento22 páginasNOM1儿啊parteAlfredo ArroyoAún no hay calificaciones
- PNO MicroencapsulacionDocumento25 páginasPNO MicroencapsulacionMorales Alberto JorgeAún no hay calificaciones
- Recepcion Técnica de Medicamentos y Dispositivos Médicos.Documento30 páginasRecepcion Técnica de Medicamentos y Dispositivos Médicos.clara balcuchoAún no hay calificaciones
- Paso 1 - Fundamentación by Laura Camila SánchezDocumento11 páginasPaso 1 - Fundamentación by Laura Camila SánchezCamila SanchezAún no hay calificaciones
- Alerta Sanitaria Graneodin-B 13042023Documento3 páginasAlerta Sanitaria Graneodin-B 13042023AlinAún no hay calificaciones
- Certificado LPO - Maria Cristina Mendez Santoyo - PAO-OR-0305Documento3 páginasCertificado LPO - Maria Cristina Mendez Santoyo - PAO-OR-0305alanpadillabuenoAún no hay calificaciones
- AuditoriaAmb Calidad ESE H Regional Norte El Tarra 102018Documento34 páginasAuditoriaAmb Calidad ESE H Regional Norte El Tarra 102018nidiabayonagAún no hay calificaciones
- BPMsDocumento11 páginasBPMsAdrian TenelemaAún no hay calificaciones
- Análisis de FlujogramasDocumento3 páginasAnálisis de FlujogramasLeidy CanoAún no hay calificaciones
- Poes 2Documento68 páginasPoes 2juan pAún no hay calificaciones
- I. Restylane (Gel Con Lodocaina)Documento3 páginasI. Restylane (Gel Con Lodocaina)huitxiAún no hay calificaciones
- Validacion de ProcesosDocumento12 páginasValidacion de ProcesosCamila Antonia100% (1)
- Cabexport InformeDocumento8 páginasCabexport InformeDavid AlejandroAún no hay calificaciones
- Alerta Sanitaria de Prolia 08012024Documento3 páginasAlerta Sanitaria de Prolia 08012024Elizsam NurmiAún no hay calificaciones
- Aplicacion Del ARICPC en CarnicosDocumento89 páginasAplicacion Del ARICPC en CarnicosGina ChaconAún no hay calificaciones
- Elaboración de conservas y cocinados cárnicos. INAI0108De EverandElaboración de conservas y cocinados cárnicos. INAI0108Aún no hay calificaciones
- Higiene general en la industria alimentaria. INAQ0108De EverandHigiene general en la industria alimentaria. INAQ0108Aún no hay calificaciones
- Carta de Hallazgo Del Mes de Febrero 2023 - Comisión Federal para La Protección Contra Riesgos Sanitarios - Gobierno - Gob - MXDocumento3 páginasCarta de Hallazgo Del Mes de Febrero 2023 - Comisión Federal para La Protección Contra Riesgos Sanitarios - Gobierno - Gob - MXViridianHernandezAún no hay calificaciones
- Una Carta de Hallazgos Es Un Mensaje o Cial A Un Fabricante o Sujeto Que Ha Violado Alguna Regla en Una Actividad ReguladaDocumento2 páginasUna Carta de Hallazgos Es Un Mensaje o Cial A Un Fabricante o Sujeto Que Ha Violado Alguna Regla en Una Actividad ReguladaViridianHernandezAún no hay calificaciones
- Comunicado de Prensa No.28/23Documento4 páginasComunicado de Prensa No.28/23ViridianHernandezAún no hay calificaciones
- Comunicado de Prensa No. 29/23Documento5 páginasComunicado de Prensa No. 29/23ViridianHernandezAún no hay calificaciones
- Comunicado A La Población No. 12/2022Documento7 páginasComunicado A La Población No. 12/2022ViridianHernandezAún no hay calificaciones
- Solicitud de Aspirante A TitulacionDocumento1 páginaSolicitud de Aspirante A TitulacionViridianHernandezAún no hay calificaciones
- Manual Informe Residencia Profesional IquiDocumento7 páginasManual Informe Residencia Profesional IquiViridianHernandezAún no hay calificaciones
- Actividad 4 Evaluaciòn de Una Organizacion InteligenteDocumento9 páginasActividad 4 Evaluaciòn de Una Organizacion InteligenteCarolina MartinezAún no hay calificaciones
- SOAT RM 730-2015Documento38 páginasSOAT RM 730-2015José Miguel Infantas RodríguezAún no hay calificaciones
- CML Caso VraemDocumento5 páginasCML Caso VraemAnonymous e4S3hqHnAún no hay calificaciones
- 100 Preguntas Más Recientes Tipo Test - OPE EnfermeriaDocumento11 páginas100 Preguntas Más Recientes Tipo Test - OPE Enfermeriamarcafg89rAún no hay calificaciones
- Formato Hoja de Control Guillermo Antonio DiazDocumento9 páginasFormato Hoja de Control Guillermo Antonio Diazandres riañosAún no hay calificaciones
- Actividad 2 Mapa Mental de Etapa 2Documento3 páginasActividad 2 Mapa Mental de Etapa 2BandraAún no hay calificaciones
- Postulados de BlackDocumento16 páginasPostulados de BlackBrian RebolledoAún no hay calificaciones
- Practica 8Documento6 páginasPractica 8Ysac Chilon CuevaAún no hay calificaciones
- Juvenal Examen MedicoDocumento1 páginaJuvenal Examen Medicodaniela cardozo moncadaAún no hay calificaciones
- Calendario Academico FCM 2022 FinalDocumento2 páginasCalendario Academico FCM 2022 FinalEnfermeria Instituto D6Aún no hay calificaciones
- Resolucion 705-BotiquinDocumento2 páginasResolucion 705-Botiquinjessica andradeAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa Conceptualjohanna reyesAún no hay calificaciones
- Reserva Web de Instalaciones Deportivas - Ayuntamiento de GetafeDocumento4 páginasReserva Web de Instalaciones Deportivas - Ayuntamiento de GetafeFran0% (1)
- Matriz de Peligros Actividad FinalDocumento20 páginasMatriz de Peligros Actividad FinalCamilaAún no hay calificaciones
- Caso Clinico de OidoDocumento11 páginasCaso Clinico de OidoLuis Miguel HuancaAún no hay calificaciones
- Zunilda Carta DocumentoDocumento2 páginasZunilda Carta DocumentolegalesacevedoAún no hay calificaciones
- Mapa Conceptual Medicamentos HomeopaticosDocumento1 páginaMapa Conceptual Medicamentos HomeopaticosCLAUDIA ZORAIDA SARMIENTO VACAAún no hay calificaciones
- Pet Abastecimiento de Combustible, Encendido y Apagado Del Generador ElectricoDocumento16 páginasPet Abastecimiento de Combustible, Encendido y Apagado Del Generador ElectricoCristel Delgado100% (1)
- FP Ensenanza SANS06 LOE FichaDocumento2 páginasFP Ensenanza SANS06 LOE FichaPatty NandoAún no hay calificaciones
- 42 Control de Salud Del AdolescenteDocumento52 páginas42 Control de Salud Del AdolescenteMatías Nicolás LópezAún no hay calificaciones
- BELOTERODocumento12 páginasBELOTEROGis GalindoAún no hay calificaciones
- CuponeraDocumento40 páginasCuponeraMariela HernandezAún no hay calificaciones
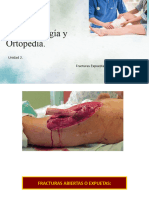
- Unidad VII Fracturas ExpuestaDocumento49 páginasUnidad VII Fracturas ExpuestaVanessa González DávalosAún no hay calificaciones
- Cuáles Son Los Riesgos A Los Que Están Más Expuestos Los Niños y Las Niñas en Los Diferentes Ambientes y Que Debemos Hacer para PrevenirlosDocumento2 páginasCuáles Son Los Riesgos A Los Que Están Más Expuestos Los Niños y Las Niñas en Los Diferentes Ambientes y Que Debemos Hacer para PrevenirlosValentina TarazonaAún no hay calificaciones
- Gerencia Tema 4Documento85 páginasGerencia Tema 4Tito MamaniAún no hay calificaciones
- Examen de InvestigacionDocumento14 páginasExamen de InvestigacionMercedes Quispe MaytaAún no hay calificaciones
- Actividad de Puntos Evaluables - Escenario 5 - PRIMER BLOQUE-TEORICO - TOXICOLOGIA LABORAL - (GRUPO B01)Documento6 páginasActividad de Puntos Evaluables - Escenario 5 - PRIMER BLOQUE-TEORICO - TOXICOLOGIA LABORAL - (GRUPO B01)Carolĭna Cuartas Carmona100% (2)
- Con Qué Frecuencia Las Enfermeras Lo Trataban Con Cortesía y RespetoDocumento3 páginasCon Qué Frecuencia Las Enfermeras Lo Trataban Con Cortesía y RespetoKarina RiveraAún no hay calificaciones