Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Afmp 2 1
Cargado por
Monse HernándezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Afmp 2 1
Cargado por
Monse HernándezCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL AUTÓNOMA
DE MÉXICO
FACULTAD DE ESTUDIOS SUPERIORES
ZARAGOZA
ANÁLISIS DE FÁRMACOS Y MATERIAS PRIMAS II
ALUMNO: HERNÁNDEZ BUITRÓN MONSERRATH
GRUPO: 1552
FECHA DE ENTREGA: 24 DE AGOSTO DE 2022
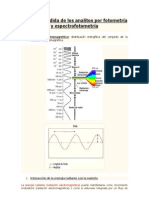
Luz
La luz está formada por la radiación electromagnética cuyas longitudes de onda
están comprendidas entre 400 y 700 nm, propagándose de un lugar a otro sin
transferencia de materia mediante un movimiento ondulatorio, aunque también
consiste en unas partículas llamadas fotones responsables de las manifestaciones
cuánticas del fenómeno electromagnético, provocando una dualidad onda-
partícula.
Espectro electromagnético (región UV visible)
El espectro electromagnético es la distribución de energías de las radiaciones
electromagnéticas. Se puede expresar en términos de energía, aunque más
comúnmente se hace en términos de la longitud de onda y frecuencias de las
radiaciones. Se extiende desde las radiaciones con menor longitud de onda (los
rayos gamma) hasta las de mayor longitud de onda (las ondas de radio).
La espectrometría ultravioleta-visible o espectrofotometría UV-Vis implica la
espectroscopia de fotones en la región de radiación ultravioleta-visible. Utiliza la
luz en los rangos visibles y adyacentes (el ultravioleta (UV) cercano y el infrarrojo
(IR) cercano.
En esta región del espectro electromagnético, las moléculas se someten a
transiciones electrónicas.
Esta espectrofotometría utiliza radiaciones del campo UV de 80 a 400 nm,
principalmente de 200 a 400 nm (UV cercano) y de luz visible de 400 a 800 nm,
por lo que es de gran utilidad para caracterizar las soluciones en la región
ultravioleta-visible del espectro.
Características de la onda
Longitud de onda (l): Es la distancia entre dos crestas o la distancia mínima de dos
partículas que vibran en fase.
Frecuencia (f): Es el número de oscilaciones que padecen las partículas vibrantes
por segundo o el número de oscilaciones que presenta una onda en un tiempo
determinado. Se calcula como: f=1/T.
Ciclo u oscilación: Es el recorrido de una partícula desde que inicia la vibración
hasta que regresa a su posición inicial (m). también se define como el recorrido
que va desde inicio de la cresta hasta el inicio del valle de la onda.
Interacción radiación-materia a partir de la teoría del orbital molecular
Las fuentes de radiación natural tienen dos orígenes: a) fuentes de origen
extraterrestre (como la radiación cósmica y los nucleidos cosmogénicos) y b)
fuentes de origen terrestre o nucleidos primordiales. Pero además de dichas
fuentes de radiación natural en las que no intervienen los seres humanos, existen
otras producidas de manera artificial en las cuales se inducen emisiones de
radiaciones ionizantes, bien por medio de reacciones nucleares, generadores de
rayos X o aceleradores de partículas. Las emisiones de estas fuentes de radiación
pueden ser tanto de partículas cargadas (alfa, electrones, positrones) como de
radiación electromagnética (X o gamma).
Conviene separar los tipos de radiación en cuatro grupos según su interacción con
la materia: 1) las partículas pesadas cargadas positivamente, que incluyen
partículas alfa, protones e iones pesados energéticos; 2) las partículas ligeras
cargadas, como electrones, betas y positrones; 3) las radiaciones
electromagnéticas, incluyendo rayos X y gamma; 4) los neutrones. La figura
siguiente esquematiza los rasgos principales de estos procesos.
Ley de Beer
La ley establece que la concentración de una sustancia química es directamente
proporcional a la absorbancia de una solución. La relación se puede usar para
determinar la concentración de una especie química en una solución usando un
colorímetro o un espectrofotómetro. La relación se usa con mayor frecuencia en la
espectroscopia de absorción UV-visible. La Ley de Beer no es válida a altas
concentraciones de solución.
La premisa es que un haz de luz se vuelve más débil a medida que pasa a través
de una solución química. La atenuación de la luz se produce como resultado de la
distancia a través de la solución o como resultado del aumento de la
concentración.
Ley de Lambert
La ley de Lambert declaró que la absorbancia de una muestra de material es
directamente proporcional a su espesor (longitud de la trayectoria).
La Ley Lambert es un medio matemático de expresar cómo la materia va
absorbiendo la luz. No obstante, aquí se define la cantidad de luz que deja una
muestra y se observa menos, y esto va ocurriendo por la cantidad de absorción y
la distancia de la ruta.
Esta ley consiste en medir la longitud de ondas de ellos y la separación de
radiación monocromática. El elemento esencial del instrumento es el sistema de
dispersión que debe tener la propiedad de cambiar la dirección de propagación de
la radiación de acuerdo con las longitudes de onda que se producen.
Hasta ahora existen dos métodos ópticos para dispersar la luz, uno que es por
refracción y el otro por difracción. Dentro de un fotómetro se usa un haz de luz
enfocado precisamente para penetrar en el elemento de procesamiento. Una
fotocélula de silicio mide la intensidad de luz resultante. La alteración de la
intensidad de la luz causada por absorción y/o difusión se explica en la Ley
Lambert-Beer.
La ley de Bouguer (aunque el reconocimiento ha recaído más sobre Heinrich
Lambert), establece que una muestra absorberá mayor radiación cuando las
dimensiones del medio absorbente o material sean mayores; específicamente, su
grosor, que viene a ser la distancia la que recorre la luz al entrar y salir.
Ley de Lambert y Beer
La derivación moderna de la ley de Beer- Lambert combina las dos leyes y
relaciona la absorbancia tanto a las concentraciones de las especies atenuantes,
así como el espesor del material de muestra. La ley explica que hay una relación
exponencial entre la transmisión de luz a través de una sustancia y la
concentración de la sustancia, así como también entre la transmisión y la longitud
del cuerpo que la luz atraviesa.
La ley de Beer establece que la totalidad de la luz que emana de una muestra
puede disminuir debido a tres fenómenos de la física, que serían los siguientes:
El número de materiales de absorción en su traje, que se llama
concentración.
Las distancias que la luz debe pasar a través de la muestra. Llamamos a
este fenómeno, distancia de la ruta óptica.
Las probabilidades de que la amplitud de onda que se produce pueda ser
absorbida por el material, por lo tanto, es llamado el coeficiente de
extinción.
La absorbancia está relacionada con la concentración de la sustancia, c, por la ley
de Lambert-Beer, que se resume con la ecuación: A = ε b c , donde c se expresa
en mol/L, b es la longitud del camino óptico (anchura de la célula que contiene la
disolución de la sustancia) y se expresa en cm, y ε es la absortividad molar,
propiedad característica de cada sustancia correspondiente a la cantidad de
radiación que absorbe a una longitud de onda determinada por unidad de
concentración, siendo sus unidades L mol-1 cm-1 (téngase en cuenta que la
absorbancia no tiene unidades).
La ley de Lambert-Beer se cumple para soluciones diluidas; para valores de c
altos, ε varía con la concentración, debido a fenómenos de dispersión de la luz,
agregación de moléculas, cambios del medio, etc. La medición de absorbancia de
la luz por las moléculas se realiza en unos aparatos llamados espectrofotómetros.
Técnicamente, la Ley de Beer se relaciona solo con la concentración, mientras
que la Ley de Beer-Lambert relaciona la absorbancia con la concentración y el
espesor de la muestra.
Desviaciones de la ley de Lambert-Beer.
Frecuentemente hay desviaciones de la proporcionalidad directa entre
absorbancia y concentración cuando la longitud de la trayectoria b es una
constante. Algunas de estas desviaciones, llamadas desviaciones reales, son
fundamentales y representan limitaciones reales a la ley. Otras son resultado del
método que utilizamos para medir la absorbancia (desviaciones instrumentales) o
de cambios químicos que ocurren cuando cambia la concentración (desviaciones
químicas). Dichas desviaciones pueden ser positivas (si la absorbancia medida es
mayor que la real) o negativas (si la absorbancia medida es menor que la real).
- Desviaciones reales: A concentraciones mayores que 0.01 M, las distancias
promedio entre los iones o las moléculas de las especies absorbentes disminuyen
hasta el punto en el que cada partícula afecta la distribución de la carga y, por lo
tanto, el grado de absorción de sus vecinos. Debido a que el grado de interacción
depende de la concentración, la ocurrencia de este fenómeno provoca
desviaciones de la relación lineal entre absorbancia y concentración. Cuando los
iones están muy cerca uno del otro, la absortividad molar del analito puede ser
alterada debido a las interacciones electrostáticas que conducen a desviaciones
de la ley de Beer.
- Desviaciones químicas: Las desviaciones aparecen cuando las especies
absorbentes experimentan asociación, disociación o reacción con el disolvente
para dar lugar a productos que absorben de manera distinta al analito. El grado de
las desviaciones puede predecirse a partir de las absortividades molares de las
especies absorbentes y las constantes de equilibrio para estos equilibrios. Es
debido a que normalmente no tomamos en cuenta a estos procesos que afectan al
analito, a menudo no es posible corregir las mediciones.
- Desviaciones instrumentales: La hipótesis básica para aplicar la ley es que
se usa luz monocromática. Es imposible extraer radiación monocromática de una
fuente continua. En su lugar se hace pasar una banda de radiación cuyo ancho
depende del elemento dispersor y del ancho de la rendija. En un espectro de
absorción, varias longitudes de onda se absorben en distinto grado; esto es, la
absortividad varía con la longitud de onda. A una longitud de onda que
corresponda a un máximo bastante ancho en el espectro, la banda de longitudes
de onda será absorbida más o menos en el mismo grado. Sin embargo, en una
parte con inclinación pronunciada en el espectro se absorberán en diferentes
grados. La pendiente del espectro aumentará al incrementar la concentración, y el
resultado es que las fracciones de las cantidades de cada longitud de onda
absorbida pueden cambiar, en especial si el ajuste del instrumento se desplaza
durante la medición. Entonces se observará una desviación negativa en la gráfica
de absorbencia en función de concentración. Cuanto mayor sea la pendiente de la
curva espectral, mayor será la desviación.
Entre otros factores instrumentales que pueden causar desviaciones, están la
radiación parásita que entra al monocromador y que se detecta, las reflexiones
internas de la radiación dentro del monocromador, y celdas que no coinciden
(respecto de la longitud de trayectoria) cuando se usan para distintas soluciones
de analito, o se usan en los instrumentos de haz doble (cuando el blanco o el
disolvente absorben de manera apreciable en la celda de referencia). La luz
parásita (que es toda luz detectada que no es absorbida por la muestra o que sale
del ancho de banda de la longitud de onda seleccionada) llega a ser limitante, en
especial con altas absorbancias, y termina causando desviaciones respecto de la
linealidad. El ruido que causa la luz parásita también es un factor importante del
error espectrométrico o de la imprecisión a grandes absorbentes.
Grupos cromóforos:
1. Son ciertos grupos o arreglos de átomos dentro de una molécula y que
absorben energía en la región visible del espectro, y son los responsables
del color en un compuesto.
2. Un cromóforo es el conjunto de átomos de una molécula que posee
electrones capaces de absorber energía y excitarse para luego emitir esta
energía en forma de luz visible; las longitudes de onda de la energía emitida
dependen del cambio de nivel energético de los electrones, de estado
excitado a estado basal. Cuando una molécula absorbe ciertas longitudes
de onda de luz visible y transmite o refleja otras, la molécula tiene un color.
Espectro de absorción.
La espectrometría de absorción se refiere a una variedad de técnicas que emplean
la interacción de la radiación electromagnética con la materia. En la
espectrometría de absorción, se compara la intensidad de un haz de luz medida
antes y después de la interacción con una muestra. Las palabras transmisión y
remisión se refieren a la dirección de viaje de los haces de luz medidos antes y
después de la absorción. Las descripciones experimentales por lo general asumen
que hay una única dirección de incidencia de la luz sobre la muestra, y que un
plano perpendicular a esta dirección pasa por la muestra.
Bandas de absorción
Una banda de absorción es un intervalo de longitudes de onda o, de manera
equivalente, frecuencias o energías. Según la mecánica cuántica, los átomos y las
moléculas solo pueden absorber ciertas cantidades de energía o existir en estados
específicos. Cuando tales cuantos de radiación electromagnética son emitidos o
absorbidos por un átomo o una molécula, la energía de la radiación cambia el
estado del átomo o molécula de un estado inicial a un estado final. El intervalo de
longitudes de onda, en el espectro electromagnético, que constituye la banda de
absorción es característico de una transición particular de un estado inicial dado a
un estado final dado en una sustancia dada.
Tipos de bandas de absorción:
Transiciones electrónicas: los átomos, moléculas y materia condensada
tienen lugar principalmente en las partes visible y ultravioleta del espectro.
Transiciones de vibración: se encuentran en la porción del espectro
infrarrojo, en longitudes de onda entre 1 y 30 micrones.
Transiciones de rotación: tienen lugar en las regiones de infrarrojo lejano y
microondas del espectro.
Bibliografía
1. Carácter ondulatorio y corpuscular de la luz [Internet]. Fotonostra.com.
[citado el 24 de agosto de 2022]. Disponible en:
https://www.fotonostra.com/fotografia/laluz.htm
2. Leskow EC. Espectro Electromagnético - Concepto, regiones, usos e
importancia [Internet]. Concepto. [citado el 24 de agosto de 2022].
Disponible en: https://concepto.de/espectro-electromagnetico/
3. Aprenda sobre la ley de Beer [Internet]. Aprenda sobre la ley de Beer. 2020
[23 de agosto de 2022]. Disponible en:
https://www.greelane.com/es/ciencia-tecnolog%C3%ADa-matem
%C3%A1ticas/ciencia/beers-law-definition-and-equation-608172
4. Definicion.xyz. [23 de agosto de 2022]. Disponible en:
https://definicion.xyz/ley-de-beer-lambert/
5. Definista P. Ley de Lambert [Internet]. Definicionyque.es. 2018 [23 de
agosto de 2022]. Disponible en: https://definicionyque.es/ley-de-lambert/
6. Www.uv.mx. [23 de agosto de 2022]. Disponible en:
https://www.uv.mx/personal/aherrera/files/2014/05/L.-Ley-de-Bouguer-
Lambert-Beer-0.pdf
7. Pérez G. Espectrometría ultravioleta-visible [Internet]. Espectrometría.com.
[citado el 23 de agosto de 2022]. Disponible en:
https://www.espectrometria.com/espectrometra_ultravioleta-visible
8. Banda de absorción [Internet]. Frwiki.wiki. [citado el 23 de agosto de 2022].
Disponible en: https://es.frwiki.wiki/wiki/Bande_d%27absorption
También podría gustarte
- Campos Electromagnéticos: La exposición no es optativa, nadie puede escapar a ellaDe EverandCampos Electromagnéticos: La exposición no es optativa, nadie puede escapar a ellaAún no hay calificaciones
- Informe #2 Longuitud de OndaDocumento11 páginasInforme #2 Longuitud de OndaStacy Ruddy Flores MacedoAún no hay calificaciones
- Marco TeóricoDocumento11 páginasMarco TeóricoDulce Maria de Jesus Miss ZacariasAún no hay calificaciones
- Determinación Fotométrica Hierro Absorción LuzDocumento13 páginasDeterminación Fotométrica Hierro Absorción LuzAna Claudia Caballero FioriloAún no hay calificaciones
- Identificación de un espectrofotómetro UV-Vis y la ley de BeerDocumento12 páginasIdentificación de un espectrofotómetro UV-Vis y la ley de BeerJESUS DAVID BOLA‹O JIMENEZAún no hay calificaciones
- Práctica 5. Espectroscopia UV-Vis de Compuestos de CoordinaciónDocumento7 páginasPráctica 5. Espectroscopia UV-Vis de Compuestos de CoordinaciónMarisol GH0% (1)
- Tema 2. Introducción A Las Técnicas EspectroscópicasDocumento4 páginasTema 2. Introducción A Las Técnicas EspectroscópicasElizabethVargasAún no hay calificaciones
- Prac 3 BQ1 PRÁCTICA DE LABORATORIO #03 'ESPECTROFOTOMETRÍA''Documento29 páginasPrac 3 BQ1 PRÁCTICA DE LABORATORIO #03 'ESPECTROFOTOMETRÍA''MaryoriThaniaGomez100% (3)
- Reporte 1Documento5 páginasReporte 1Castulo Marin Karla GisselleAún no hay calificaciones
- Informe de Lab, Medicina, EspectofotometriaDocumento24 páginasInforme de Lab, Medicina, Espectofotometriamanolete43210% (1)
- Limitaciones de La Ley de LambertDocumento16 páginasLimitaciones de La Ley de Lambertsugetita100% (4)
- Espectrofotometría UV-VisDocumento9 páginasEspectrofotometría UV-VismarinagamoAún no hay calificaciones
- Espectrometría y Espectrometria Uv VisibleDocumento23 páginasEspectrometría y Espectrometria Uv VisibleIssabel DalinaAún no hay calificaciones
- Espectroscopia BeluDocumento15 páginasEspectroscopia BeluGuillermo Exequiel LanatiAún no hay calificaciones
- Informe de Bioquimica1Documento18 páginasInforme de Bioquimica1MAPSI SASAún no hay calificaciones
- INVESTIGACIONDocumento16 páginasINVESTIGACIONAndrea GonzalezAún no hay calificaciones
- Medida analitos fotometríaDocumento161 páginasMedida analitos fotometríabrujoscuro2100% (2)
- Espectrofotometria y Cromatografia PreseDocumento10 páginasEspectrofotometria y Cromatografia PreseAlejandro Cuenta sebastianAún no hay calificaciones
- Tareas U2 - Gonzalez Flores Andrea - IntrumentalDocumento16 páginasTareas U2 - Gonzalez Flores Andrea - IntrumentalAndrea GonzalezAún no hay calificaciones
- INVESTIGACIONDocumento16 páginasINVESTIGACIONAndrea GonzalezAún no hay calificaciones
- Medida de Los Analitos Por Fotometría y EspectrofotometríaDocumento167 páginasMedida de Los Analitos Por Fotometría y EspectrofotometríaJimmy LaboratoristaAún no hay calificaciones
- Taller Parcial Quimica AnaliticaDocumento6 páginasTaller Parcial Quimica AnaliticaDiana Carolina BeltránAún no hay calificaciones
- ESPECTROFOTOMETRÍADocumento13 páginasESPECTROFOTOMETRÍAAlexandra AlvarezAún no hay calificaciones
- Química Analítica 10Documento15 páginasQuímica Analítica 10Gabriela Crespo CaballeroAún no hay calificaciones
- Análisis Espectrofotométrico UV-VisDocumento16 páginasAnálisis Espectrofotométrico UV-VisEdison Alejandro Boada MedinaAún no hay calificaciones
- A3 UV VIS - PicazoOlmosGerardoDocumento5 páginasA3 UV VIS - PicazoOlmosGerardoGerardo PicazoAún no hay calificaciones
- Resumen Introducción A La Química Clínica y EspectrofotometríaDocumento5 páginasResumen Introducción A La Química Clínica y EspectrofotometríajeiselllaAún no hay calificaciones
- T5 EspectroscopíaDocumento8 páginasT5 EspectroscopíaMicky AnvarAún no hay calificaciones
- Apunte ABSOCIOMETRIA MOLECULAR 2020Documento28 páginasApunte ABSOCIOMETRIA MOLECULAR 2020Morena PaezAún no hay calificaciones
- EspectrosDocumento6 páginasEspectrosmarydj1408Aún no hay calificaciones
- Instrumental I - Métodos Espectroscópicos de AnálisisDocumento33 páginasInstrumental I - Métodos Espectroscópicos de AnálisisFernando Stuar Campos MendozaAún no hay calificaciones
- Absorcion de RadiacionDocumento41 páginasAbsorcion de RadiacionMontse PérezAún no hay calificaciones
- Introducción a métodos espectroscópicosDocumento63 páginasIntroducción a métodos espectroscópicoschula98Aún no hay calificaciones
- Medición espectrofotométrica de absorbancia y transmitanciaDocumento114 páginasMedición espectrofotométrica de absorbancia y transmitanciaKarina Beatríz100% (1)
- Espectroscopia InfrarrojaDocumento8 páginasEspectroscopia InfrarrojaKarlo Josué Sanchez RiveraAún no hay calificaciones
- Trabajo de EspectroDocumento13 páginasTrabajo de EspectroKrlos Dvd AlvarezAún no hay calificaciones
- Ficha de Lectura U 2.1Documento14 páginasFicha de Lectura U 2.1Ro AguileraAún no hay calificaciones
- FyQ TrabajoDocumento3 páginasFyQ TrabajoJuanAún no hay calificaciones
- Metodos EspectroscopicosDocumento19 páginasMetodos EspectroscopicosMarcio ArteagaAún no hay calificaciones
- PRÁCTICA 03, ESPECTROFOTOMETRIA. EnzimologiaDocumento4 páginasPRÁCTICA 03, ESPECTROFOTOMETRIA. EnzimologiaFiorella Rios GoñyAún no hay calificaciones
- TEMA 7 Técnicas EspectroscópicasDocumento24 páginasTEMA 7 Técnicas EspectroscópicasJohnny Samaniego MaciasAún no hay calificaciones
- Fenazopiridina VisibleDocumento14 páginasFenazopiridina VisibleChiquis GB67% (3)
- Química analítica UV-VISDocumento26 páginasQuímica analítica UV-VISYisell Rodas CanoleAún no hay calificaciones
- Fundamentos Espectroscopia Absorción AtómicaDocumento10 páginasFundamentos Espectroscopia Absorción AtómicaEduardo Garcia BéjarAún no hay calificaciones
- EspectrofotometríaDocumento9 páginasEspectrofotometríaSAMANTHA ASSUL PINTO ACOSTAAún no hay calificaciones
- Espectrofotometria UVDocumento64 páginasEspectrofotometria UVAlex F. Perdomo0% (1)
- Absorbancia Trasmitancia y Ley de BeerDocumento11 páginasAbsorbancia Trasmitancia y Ley de BeerJulyy ArtssAún no hay calificaciones
- Introducción UV-visible espectroscopíaDocumento12 páginasIntroducción UV-visible espectroscopíaNeus Vadell PuigrosAún no hay calificaciones
- La Ley de Lambert y Beer-Semana - 10-tDocumento17 páginasLa Ley de Lambert y Beer-Semana - 10-tEstefany Quispe RamirezAún no hay calificaciones
- Espectroscopia Trabajo Grupal111Documento26 páginasEspectroscopia Trabajo Grupal111Liz Elena Tadeo SotoAún no hay calificaciones
- EspectrofotometríaDocumento14 páginasEspectrofotometríaalejandro Gómez MiguelAún no hay calificaciones
- Espectroscopia Ultravioleta VisibleDocumento6 páginasEspectroscopia Ultravioleta VisiblerasevepaAún no hay calificaciones
- Espectrometría Molecular UV-Visible, Fotometría de FlamaDocumento32 páginasEspectrometría Molecular UV-Visible, Fotometría de FlamaDoménica PalaciosAún no hay calificaciones
- Espectroscopía UvDocumento10 páginasEspectroscopía UvalessandroAún no hay calificaciones
- MATERIAL DE APOYO-espectroscopia UV-VIS y ColorimetríaDocumento8 páginasMATERIAL DE APOYO-espectroscopia UV-VIS y Colorimetríaadeli alvarez100% (1)
- Tema 17Documento41 páginasTema 17Ana LopezAún no hay calificaciones
- Espectofotometría VisibleDocumento8 páginasEspectofotometría VisibleGregg JamesAún no hay calificaciones
- Radiación electromagnética y espectroscopíaDocumento46 páginasRadiación electromagnética y espectroscopíaMarianaAún no hay calificaciones
- Telecomunicaciones: Historia y conceptos básicosDe EverandTelecomunicaciones: Historia y conceptos básicosCalificación: 5 de 5 estrellas5/5 (1)
- CUESTIONARIO TEORICO SOBRE CONCEPTOS BÁSICOS DE CINEMÁTICA Alumnos FaltaDocumento12 páginasCUESTIONARIO TEORICO SOBRE CONCEPTOS BÁSICOS DE CINEMÁTICA Alumnos Faltaalexander vargas baqueAún no hay calificaciones
- Problemas de Radiacion Fisica Nuclear Radiactividad y Dosimetria RadiactivaDocumento36 páginasProblemas de Radiacion Fisica Nuclear Radiactividad y Dosimetria RadiactivaAdriánAún no hay calificaciones
- Tecnología Últimas ActividadesDocumento3 páginasTecnología Últimas ActividadesAaa 027Aún no hay calificaciones
- Características de La Fibra ÓpticaDocumento25 páginasCaracterísticas de La Fibra ÓpticaFleipe AlvarezAún no hay calificaciones
- Antonio Rodrigues Los Graficos en Radiestesia PDFDocumento300 páginasAntonio Rodrigues Los Graficos en Radiestesia PDFRicardo Plaça100% (1)
- Fisica Cinematica CircularDocumento6 páginasFisica Cinematica CircularGustavo GuinleAún no hay calificaciones
- Fisiología. DecibelesDocumento4 páginasFisiología. DecibelesLaura LópezAún no hay calificaciones
- 11° FISICA Explicación de Fenómenos: Explicar Los Fenómenos de Reflexión y Refracción de La Luz en Superficies Planas y Curvas.Documento21 páginas11° FISICA Explicación de Fenómenos: Explicar Los Fenómenos de Reflexión y Refracción de La Luz en Superficies Planas y Curvas.Kmilo CasilloAún no hay calificaciones
- Hoja de Trabajo 09 y 10Documento4 páginasHoja de Trabajo 09 y 10Michelle MmmmAún no hay calificaciones
- Acido FosforicoDocumento21 páginasAcido FosforicoFeranando Llatas VillanuevaAún no hay calificaciones
- Fisica 2014-3 MVCLDocumento5 páginasFisica 2014-3 MVCLDivertimaticManayAún no hay calificaciones
- Unidad de Trabajo 1Documento57 páginasUnidad de Trabajo 1franAún no hay calificaciones
- Conclusiones Primer y Segundo VideoDocumento4 páginasConclusiones Primer y Segundo VideoAndres felipe marin echeverriAún no hay calificaciones
- Practica de Caída LibreDocumento4 páginasPractica de Caída LibreLeslie QuintanaAún no hay calificaciones
- Lab. 06 de Ondas y CalorDocumento8 páginasLab. 06 de Ondas y CalorWilmer MartelAún no hay calificaciones
- Calefacción de un recinto mediante ciclo de CarnotDocumento14 páginasCalefacción de un recinto mediante ciclo de CarnotJhonathan BaptistaAún no hay calificaciones
- Informe Efecto FotoeléctricoDocumento6 páginasInforme Efecto FotoeléctricoMelany Dominguez JimenezAún no hay calificaciones
- BiotecnologiaDocumento43 páginasBiotecnologiaLAS MENDOZAAún no hay calificaciones
- Practico 3Documento4 páginasPractico 3lucatoileanaAún no hay calificaciones
- Seminario Fisica de Eco DictadoDocumento23 páginasSeminario Fisica de Eco DictadocarlosAún no hay calificaciones
- Practica 6 LAMGDocumento15 páginasPractica 6 LAMGMelesio García Luis AntonioAún no hay calificaciones
- Clase I RefraccionDocumento33 páginasClase I Refraccionagustina libertiAún no hay calificaciones
- Práctica N°6-DifusiónDocumento10 páginasPráctica N°6-DifusiónAngie Antonella Vidal Huamán100% (1)
- Intercambiador de Calor 2da UnidadDocumento27 páginasIntercambiador de Calor 2da UnidadMiller Ccanccapa MacedoAún no hay calificaciones
- Matriz de Riesgos Sector ManufacturaDocumento1 páginaMatriz de Riesgos Sector ManufacturaJuan C100% (1)
- Transferencia de Calor Fundamentos MD 1-BDocumento26 páginasTransferencia de Calor Fundamentos MD 1-Banon_981457838Aún no hay calificaciones
- Guia PracticaDocumento2 páginasGuia PracticaLIMBERT BRAYAN MAQUERA CERDAAún no hay calificaciones
- Informe 2 2Documento19 páginasInforme 2 2Anyury LatorreAún no hay calificaciones
- Talleres 1-3 QUIM-1103Documento4 páginasTalleres 1-3 QUIM-1103Karen NavarroAún no hay calificaciones
- Apuntes Evaluación de La Exposición A RuidoDocumento227 páginasApuntes Evaluación de La Exposición A RuidolydiaAún no hay calificaciones