Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diagrama de Fases 1 B
Diagrama de Fases 1 B
Cargado por
carlos0 calificaciones0% encontró este documento útil (0 votos)
4 vistas1 páginaI. Define conceptos clave como propiedades intensivas, transformaciones aleotrópicas, equilibrio químico y metaestable, solubilidad, soluto y constante de solubilidad. II. Utiliza las reglas de Gibbs y de la palanca para determinar las fases en equilibrio y la composición de un diagrama binario. III. Resuelve un problema para calcular la constante de solubilidad del cloruro de sodio a partir de la masa y volumen de una disolución preparada. IV. Realiza el diagrama de fases del yodo puro.
Descripción original:
Título original
DIAGRAMA DE FASES 1 B
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoI. Define conceptos clave como propiedades intensivas, transformaciones aleotrópicas, equilibrio químico y metaestable, solubilidad, soluto y constante de solubilidad. II. Utiliza las reglas de Gibbs y de la palanca para determinar las fases en equilibrio y la composición de un diagrama binario. III. Resuelve un problema para calcular la constante de solubilidad del cloruro de sodio a partir de la masa y volumen de una disolución preparada. IV. Realiza el diagrama de fases del yodo puro.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas1 páginaDiagrama de Fases 1 B
Diagrama de Fases 1 B
Cargado por
carlosI. Define conceptos clave como propiedades intensivas, transformaciones aleotrópicas, equilibrio químico y metaestable, solubilidad, soluto y constante de solubilidad. II. Utiliza las reglas de Gibbs y de la palanca para determinar las fases en equilibrio y la composición de un diagrama binario. III. Resuelve un problema para calcular la constante de solubilidad del cloruro de sodio a partir de la masa y volumen de una disolución preparada. IV. Realiza el diagrama de fases del yodo puro.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
DIAGRAMA DE FASES EXAMEN B
Nombre: 3EM1
I.-Define los siguientes conceptos
1.-¿Que es una propiedad intensiva? Proporciona ejemplos
2.-¿que es una transformación aleotrópica?. Realiza un diagrama
3.-Describe el equilibrio químico, equilibrio metaestable
4.-Define solubilidad, soluto y constante de solubilidad
5.-Define punto triple, temperatura critica y presión critica,
II.- En el siguiente diagrama se representa un diagrama binario de composición temperatura.
utilizando la regla de fases de Gibbs determina los grados de libertad y con la regla de la palana
determina las fases en equilibrio y la composición global y el % de los elementos en cada fase.
III.- Resuelve el siguiente problema. Para preparar medio litro de disolución de cloruro de sodio
utilizaron 3.75 g de sal. Halla el Kps del coluro de sodio (Na=23, Cl=35.45)
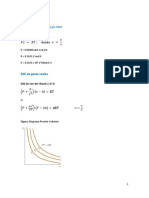
IV.-Realiza el diagrama de fases de un solo componente para el yodo (I2)
𝑷 ∆𝑯𝒗𝒂𝒑 𝟏 𝟏 𝑷𝟐 ∆𝑯𝒔𝒖𝒃 𝟏 𝟏 ∆𝑯𝒇𝒖𝒔 𝑻𝟐
ln𝑷𝟐 = − (𝑻 − 𝑻 ) ln =− ( − ) 𝐏𝟐 − 𝐏𝟏 = −
∆𝑽𝒇𝒖𝒔
𝒍𝒏 ( )
𝑻𝟏
𝟏 𝑹 𝟐 𝟏 𝑷𝟏 𝑹 𝑻𝟐 𝑻𝟏
Punto triple=113.6°C y 0.121 atm
-3
∆H vap=20.752 KJ/mol; ∆H fus=15.52 KJ/mol ; ∆H sub= ∆H vap+ ∆H fus KJ/mol R=8.31*10 KJ/mol K
También podría gustarte
- Ejercicios de Combustion para Solucionar DudasDocumento7 páginasEjercicios de Combustion para Solucionar DudasCesar Chirinos Di Giovannantonio64% (11)
- Balances de Materia y EnergiaDocumento16 páginasBalances de Materia y EnergiaDANIELA ROMERO PADILLAAún no hay calificaciones
- Diseño Detorres Problema 8.1 Treybal (Rodriguez-Ramirez-Serrato)Documento29 páginasDiseño Detorres Problema 8.1 Treybal (Rodriguez-Ramirez-Serrato)Maggie Ecliptwimon100% (1)
- Tarea-3-John-Cubides Ejercicio #2Documento7 páginasTarea-3-John-Cubides Ejercicio #2KRAZY NET0% (1)
- Ejercicio 8 Ingeniería de Las Reacciones Químicas 1Documento20 páginasEjercicio 8 Ingeniería de Las Reacciones Químicas 1Cecilia FernandezAún no hay calificaciones
- Ecuaciones Termodinamica Capitulo 2Documento25 páginasEcuaciones Termodinamica Capitulo 2SaraMendoza100% (1)
- FQ2-2020.1 Tarea 04Documento2 páginasFQ2-2020.1 Tarea 04ArsmstrongAún no hay calificaciones
- Influencia de La Temperatura Sobre La Velocidad de Reacción Del Agua OxígenadaDocumento17 páginasInfluencia de La Temperatura Sobre La Velocidad de Reacción Del Agua OxígenadaCitlalli Zenteno0% (4)
- Anexo 1 - Tarea 2 GleidyDocumento14 páginasAnexo 1 - Tarea 2 Gleidyalfonso jimenezAún no hay calificaciones
- Practica 1 - Destilacion Simple - Equipo 4Documento21 páginasPractica 1 - Destilacion Simple - Equipo 4Marco PantaleonAún no hay calificaciones
- Previo P4 Diagrama de Fases CiclohexanoDocumento4 páginasPrevio P4 Diagrama de Fases CiclohexanoScarlet JhonsonAún no hay calificaciones
- Anexo 2Documento11 páginasAnexo 2Juan Pablo GarantivaAún no hay calificaciones
- Tarea 3 - Rafael Velasquez - Grupo 201102 - 37Documento12 páginasTarea 3 - Rafael Velasquez - Grupo 201102 - 37rafael velasquezAún no hay calificaciones
- UntitledDocumento12 páginasUntitledNayeli GutierrezAún no hay calificaciones
- BMyE 2020-1 Serie 1Documento3 páginasBMyE 2020-1 Serie 1Alex RamosAún no hay calificaciones
- Practica 4Documento11 páginasPractica 4diego muñoz arellanoAún no hay calificaciones
- Actividad5 FísicaDocumento10 páginasActividad5 FísicaGema Sofía LagunaAún no hay calificaciones
- Ejer Cici OsDocumento7 páginasEjer Cici OsBernardoColomaPaxiAún no hay calificaciones
- Destilacion MulticomponenteDocumento7 páginasDestilacion MulticomponenteAuroraTrejoAún no hay calificaciones
- Anexo 4Documento15 páginasAnexo 4Miguel Galvez MorenoAún no hay calificaciones
- Segunda Ley de La Termodinámica y Maquinas TermicasDocumento9 páginasSegunda Ley de La Termodinámica y Maquinas Termicasjorge salazarAún no hay calificaciones
- Taller #1 Jonathan Steven Zambrano VergaraDocumento6 páginasTaller #1 Jonathan Steven Zambrano VergaraJONATHAN ZAMBRANOAún no hay calificaciones
- TALLER Quimicq 90Documento13 páginasTALLER Quimicq 90Daniel Puentes100% (1)
- Clase 2.3. EdE - SeminarioDocumento10 páginasClase 2.3. EdE - SeminarioVale IturraAún no hay calificaciones
- Tarea 3 Estados de Agregacion y DisolucionesDocumento15 páginasTarea 3 Estados de Agregacion y DisolucionesANDREA ALVAREZ DIAZAún no hay calificaciones
- Práctica 2. Determinación KNO3Documento7 páginasPráctica 2. Determinación KNO3Dylan Ruiz AguilarAún no hay calificaciones
- Lab 4 CineticaDocumento22 páginasLab 4 CineticaJimena Bautista VelardeAún no hay calificaciones
- Equilibrio Qco Ejercicios Resueltos MoodleDocumento4 páginasEquilibrio Qco Ejercicios Resueltos MoodleDaniel DdiazAún no hay calificaciones
- Reactor No IsotermicoDocumento12 páginasReactor No IsotermicoKatia PulgarinAún no hay calificaciones
- Tarea 4 - Termodinámica Química INORGANICADocumento2 páginasTarea 4 - Termodinámica Química INORGANICAyonhsonAún no hay calificaciones
- XXVI OPQ Selectivo FINAL en 2023 FinDocumento10 páginasXXVI OPQ Selectivo FINAL en 2023 FinMenly Cosme LopezAún no hay calificaciones
- Practica 1 - 2015Documento20 páginasPractica 1 - 2015Jorge EliasAún no hay calificaciones
- Fase 2 Individual y ColaborativaDocumento13 páginasFase 2 Individual y ColaborativaGitequiTenoquiAún no hay calificaciones
- Taller N°1Documento8 páginasTaller N°1acanalesmahuzierAún no hay calificaciones
- Equilibrio Entre FasesDocumento9 páginasEquilibrio Entre FasesJAVIER GONZALEZAún no hay calificaciones
- Laboratorio de ReaccionesDocumento33 páginasLaboratorio de ReaccionesMARLONAún no hay calificaciones
- FQ1-2024.1 Tarea 02Documento2 páginasFQ1-2024.1 Tarea 02DAFNEE VICTORIA SUSEETH GUDIEL CANTÉAún no hay calificaciones
- Destilación Simple o DiferencialDocumento10 páginasDestilación Simple o DiferencialDavid Alemán SánchezAún no hay calificaciones
- TermoDocumento16 páginasTermoChato Alarcon CharlaixAún no hay calificaciones
- Informe ESLDocumento11 páginasInforme ESLDORIS HELENA GUTIÉRREZ LONDOÑOAún no hay calificaciones
- Guía10 - PRQ500 - 2PDocumento7 páginasGuía10 - PRQ500 - 2PBladimir Alex Quispe RochaAún no hay calificaciones
- Reactor BatchDocumento12 páginasReactor BatchELIZABETHAún no hay calificaciones
- Qumica Actividad 3Documento11 páginasQumica Actividad 3Jenni LoperaAún no hay calificaciones
- Balanceo Ecuaciones Quimicas Tanteo - AlgebraicoDocumento5 páginasBalanceo Ecuaciones Quimicas Tanteo - AlgebraicoDanaNoelia BellidoLedezmaAún no hay calificaciones
- IQ.05.03 Taller 12Documento5 páginasIQ.05.03 Taller 12JamiletAún no hay calificaciones
- Trabajo de Balance de Energía 2Documento6 páginasTrabajo de Balance de Energía 2Felipe GuantivaAún no hay calificaciones
- Juan Pablo Herrera Garantiva 555Documento13 páginasJuan Pablo Herrera Garantiva 555Juan Pablo Garantiva MezaAún no hay calificaciones
- Ex Final Junio Resuelto 1Documento5 páginasEx Final Junio Resuelto 1Bilal SennakAún no hay calificaciones
- Teoría de Destilación Fraccionada.Documento10 páginasTeoría de Destilación Fraccionada.David M GaytanAún no hay calificaciones
- DifusividadDocumento9 páginasDifusividadMarita M. OrbegosoAún no hay calificaciones
- 2018 2019 Examen Final ResueltoDocumento5 páginas2018 2019 Examen Final ResueltoBilal SennakAún no hay calificaciones
- Escuela Profesional de Física de La FCNM de La Unac Asignatura: TermodinámicaDocumento33 páginasEscuela Profesional de Física de La FCNM de La Unac Asignatura: TermodinámicaJoel GuerraAún no hay calificaciones
- Examen Quinta Oportunidad Fenomenos Quimicos en El EntornoDocumento3 páginasExamen Quinta Oportunidad Fenomenos Quimicos en El EntornoDavid ChongAún no hay calificaciones
- Estudio de Caso - 5Documento9 páginasEstudio de Caso - 5Hanna AlarconAún no hay calificaciones
- Practica 7 Equipo 4Documento13 páginasPractica 7 Equipo 4SylAún no hay calificaciones
- 1 9pracDocumento9 páginas1 9pracguido oscar huanca mamaniAún no hay calificaciones
- Practica 21 LAB 1Documento8 páginasPractica 21 LAB 1LOZANO ARANGO JULIANAAún no hay calificaciones
- Guía5 - PRQ500 - 2PDocumento6 páginasGuía5 - PRQ500 - 2PJuanAún no hay calificaciones
- La ecuación general de segundo grado en dos y tres variablesDe EverandLa ecuación general de segundo grado en dos y tres variablesAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Binarios Reaccion Peritectica y Sintetica T4Documento12 páginasBinarios Reaccion Peritectica y Sintetica T4carlosAún no hay calificaciones
- Binarios Regla de La Palanca y Reacciones Invariantes T2Documento6 páginasBinarios Regla de La Palanca y Reacciones Invariantes T2carlosAún no hay calificaciones
- ACFrOgCl dMZ3ekbAqVL 1Xs3K5pMqTxxA3i45hmHvLtjXEKO-kOtNT5vNp SMsrYbvsuIefdpXOYX6YOvWeRT5ZcBpitrC6DAKo-jVz2Ao0VwH4Sm2IqRhXmFOc1gmB5BFOspEFDkNBuzyoLX3Documento120 páginasACFrOgCl dMZ3ekbAqVL 1Xs3K5pMqTxxA3i45hmHvLtjXEKO-kOtNT5vNp SMsrYbvsuIefdpXOYX6YOvWeRT5ZcBpitrC6DAKo-jVz2Ao0VwH4Sm2IqRhXmFOc1gmB5BFOspEFDkNBuzyoLX3carlosAún no hay calificaciones
- Info2022 1Documento30 páginasInfo2022 1carlosAún no hay calificaciones