Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Gases Ideales y Sustancia Pura
Cargado por
Armando Gatiérrez GarciaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Mapa Gases Ideales y Sustancia Pura
Cargado por
Armando Gatiérrez GarciaCopyright:
Formatos disponibles
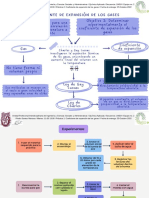
Gases Ideales y sustancia Pura.
No hay cambio en el valor de la temperatura del gas y por lo
tanto tampoco cambia la energía interna El trabajo realizado es igual al calor que entra o sale del gas
Proceso isotérmico W = nRT ln(Vf /Vi )
Factor de compresibilidad Un proceso isocórico es aquel que se lleva a cabo a volumen
Razón del volumen molar de un gas con relación al volumen
molar de un gas ideal a la misma temperatura y presión. constante El flujo de calor es en este caso
Representaciones gráficas de las fases presentes en un sistema Diagrama cambio de fases dQ = CV dT
material en función de la temperatura, la presión, y la
composición. Proceso isocórico
fusión (paso sólido -líquido), solidificación (paso líquido-sólido), Procesos de cambio de fase Procesos en gases ideales Proceso isobárico Un proceso isobárico se efectúa a presión constante. El trabajo esta dado por
vaporización (líquido-vapor), condensación (vapor-líquido), W = p(Vf - Vi )
sublimación (sólido - gas) Sustancia pura, aquella que no esta afectada por Gas ideal Z=1.0 donde Z=PV/RT
ninguna otra
La ecuación de estado de gas ideal Los procesos adiabáticos ocurren cuando el flujo de calor del o
Sólido, líquido y gaseosa, dependiendo de los valores de hacia el sistema a sus alrededores es cero
presión y temperatura una sustancia puede estar como sólido, Proceso adiabático
líquido o vapor o presentarse en dos o tres fases a la vez. Fases de una sustancia pura
PV=nRT
Tablas termodinámicas de las sustancias puras
Ley de Charles P=Presión , V=Volumen, n=Numero de moles, R=Constante del
Es una ley experimental de los gases que describe cómo los
gases tienden a expandirse cuando se calientan. gas ideal, T=temperatura.
Son tablas donde se agrupan de forma ordenada, diferentes
Leyes de Gases propiedades termodinámicas.
Contiene el nombre de l tabla, nombres de las propiedades
Establece que la presión de un volumen fijo de un gas, es termodinámicas y el valor de las propiedades.
directamente proporcional a su temperatura.
Ley de Gay-Lussac Energía en gases
Relación entre la presión y el volumen de un gas cuando la
temperatura es constante
P*V = K
Ley de Boyle
Es una propiedad que se obtiene de combinar la energía interna,
la presión y el volumen específico.
Entalpía de gases ideales.
La energía asociada con el movimiento aleatorio y desordenado
de las moléculas.
Energía interna
Es la propiedad que permite medir la cantidad de energía que
una sustancia es capaz de almacenar
Calor Especifico.
También podría gustarte
- Mapa Conceptual de Termodinámica de Gases IdealesDocumento3 páginasMapa Conceptual de Termodinámica de Gases IdealesvicenteAún no hay calificaciones
- Tipos de Procesos Termodinámicos II PDFDocumento3 páginasTipos de Procesos Termodinámicos II PDFKarenAún no hay calificaciones
- Gases IdealesDocumento1 páginaGases IdealesCARLOS ARCOSAún no hay calificaciones
- Determinación de la constante adiabática del aireDocumento17 páginasDeterminación de la constante adiabática del aireDavid ChoqueAún no hay calificaciones
- Unidad 3Documento1 páginaUnidad 3Ale SwiftAún no hay calificaciones
- U2-E1-Lopez Zamora Luis FernandoDocumento8 páginasU2-E1-Lopez Zamora Luis FernandoLuis Fërnandö LòpezAún no hay calificaciones
- Leyes Que Rigen El Aire Comprimido (José Escobar 2629)Documento2 páginasLeyes Que Rigen El Aire Comprimido (José Escobar 2629)joseAún no hay calificaciones
- Procesos de Gases IdealesDocumento41 páginasProcesos de Gases Idealesmelani canoAún no hay calificaciones
- Procesos de Gases Ideales CompletoDocumento57 páginasProcesos de Gases Ideales CompletoGUZMÁN DEL ÁNGEL RODRIGO ALFONSOAún no hay calificaciones
- Gases Ideales y Gases RealesDocumento13 páginasGases Ideales y Gases RealesHernández Torres Stephanie JoselineAún no hay calificaciones
- Formulario Gases IdealesDocumento6 páginasFormulario Gases IdealesVICTOR HUGO JIMENEZ CANCINOAún no hay calificaciones
- Procesos termodinámicos PopoDocumento4 páginasProcesos termodinámicos Popojose juan uscangaAún no hay calificaciones
- Ilovepdf MergedDocumento6 páginasIlovepdf MergedAlejandro MendezAún no hay calificaciones
- Ejemplos de Propiedades ExtensivasDocumento13 páginasEjemplos de Propiedades ExtensivasAngel VillaroelAún no hay calificaciones
- Analisis de Energia en Sistemas CerradosDocumento26 páginasAnalisis de Energia en Sistemas CerradosINGRITH STEFANY CHAVEZ ALARC�N100% (1)
- Procesos TermodinámicoDocumento10 páginasProcesos TermodinámicoBrenda ParraAún no hay calificaciones
- Informe Válvula Joule ThomsonDocumento5 páginasInforme Válvula Joule ThomsonNatalia SanabriaAún no hay calificaciones
- PVT Semana 7Documento25 páginasPVT Semana 7alex69618Aún no hay calificaciones
- Termodinamica AplicadaDocumento44 páginasTermodinamica AplicadaEric AmaroAún no hay calificaciones
- SolDocumento9 páginasSolMichael Martines IzquierdoAún no hay calificaciones
- Mapa Conceptual-Ley de Los GasesDocumento1 páginaMapa Conceptual-Ley de Los GasesPiscis Yallercco67% (3)
- P Sem13 Ses2 Procesos Termo-2021-AgostoDocumento29 páginasP Sem13 Ses2 Procesos Termo-2021-AgostoNehemias Sanchez SalasAún no hay calificaciones
- Unidad 3 Centrales Vapor Parte 1Documento21 páginasUnidad 3 Centrales Vapor Parte 1Jaime TamayoAún no hay calificaciones
- FluidosDocumento22 páginasFluidosJose Antonio Arauzo ZevallosAún no hay calificaciones
- Actividad 2 Mapa Mental Gases Ideales Jesus ComasDocumento1 páginaActividad 2 Mapa Mental Gases Ideales Jesus ComasJesús Miguel Comas AlvaradoAún no hay calificaciones
- Sustancias PurasDocumento36 páginasSustancias Puraserick luisAún no hay calificaciones
- PROCESOS TERMODINÁMICOS) Gases Ideales PDFDocumento25 páginasPROCESOS TERMODINÁMICOS) Gases Ideales PDFestevan gutierrezAún no hay calificaciones
- Proceso PolitropicoDocumento9 páginasProceso PolitropicoJheder MejiaAún no hay calificaciones
- Simulación interactiva de las leyes de los gasesDocumento3 páginasSimulación interactiva de las leyes de los gasesjosue barraganAún no hay calificaciones
- Gases Ideales: Semana 04 Sesión 01Documento8 páginasGases Ideales: Semana 04 Sesión 01Jose AndresAún no hay calificaciones
- Propiedades de los gases: leyes de Boyle y factores de llenado de globosDocumento17 páginasPropiedades de los gases: leyes de Boyle y factores de llenado de globosDanna PortilloAún no hay calificaciones
- Humidificación Y SecadoDocumento25 páginasHumidificación Y SecadoDaiana MuñozAún no hay calificaciones
- Wuolah-Free-Termodinámica y Cinética Química - Tema 2 - Equilibrios de Fase y Químico de SuperficiesDocumento25 páginasWuolah-Free-Termodinámica y Cinética Química - Tema 2 - Equilibrios de Fase y Químico de SuperficiesJORGE DANIEL CASARES REFOLIOAún no hay calificaciones
- Capítulo 4 - Primera Ley Sistemas CerradosDocumento43 páginasCapítulo 4 - Primera Ley Sistemas CerradosLuis Galo SanchezAún no hay calificaciones
- Lab Quimica AplicadaDocumento2 páginasLab Quimica AplicadaPedro Santos MarianaAún no hay calificaciones
- Proyecto Coefiente de Compresibilidad Isotermico Del Petroleo PDFDocumento7 páginasProyecto Coefiente de Compresibilidad Isotermico Del Petroleo PDFtatianaAún no hay calificaciones
- Termodinámica: trabajo y procesos termodinámicos en gasesDocumento44 páginasTermodinámica: trabajo y procesos termodinámicos en gaseshenryAún no hay calificaciones
- Analisis Termodinamico Del CompresorDocumento5 páginasAnalisis Termodinamico Del CompresorCarlos Tigse100% (1)
- Relación P-V-TDocumento16 páginasRelación P-V-TCarlosCarrilloAún no hay calificaciones
- EBULLICIONDocumento43 páginasEBULLICIONMiguelAún no hay calificaciones
- Procesos y Primera LeyDocumento41 páginasProcesos y Primera LeyCarlos RamirezAún no hay calificaciones
- Ficha Sobre Los Gases IdealesDocumento5 páginasFicha Sobre Los Gases IdealesMARY NOMESQUEAún no hay calificaciones
- Gases Ideales y Procesos de Los GasesDocumento9 páginasGases Ideales y Procesos de Los GasesBeacker Huaquisto RaimeAún no hay calificaciones
- Tema 6 Fluidos de YacimientoDocumento21 páginasTema 6 Fluidos de YacimientoIsraeljose CastellanoAún no hay calificaciones
- Clase2 23Documento39 páginasClase2 23fixs12Aún no hay calificaciones
- Taller FisicoquímicoDocumento10 páginasTaller Fisicoquímicocristian moralesAún no hay calificaciones
- 03 Termodinñamica IntroDocumento4 páginas03 Termodinñamica IntroMARCO ANTONIO CANDIA FLORESAún no hay calificaciones
- Propiedades y usos del aguaDocumento1 páginaPropiedades y usos del aguaFernanda CxAún no hay calificaciones
- Leyes de Los GasesDocumento3 páginasLeyes de Los GasesAna RuizAún no hay calificaciones
- Termodinámica - Procesos Politrópicos e IsentrópicosDocumento6 páginasTermodinámica - Procesos Politrópicos e IsentrópicosGeovanny JácomeAún no hay calificaciones
- Unidad 7. Gases IdealesDocumento24 páginasUnidad 7. Gases IdealesasimonAún no hay calificaciones
- Coeficientes Convectivos Parte 2Documento5 páginasCoeficientes Convectivos Parte 2Alex MaedaAún no hay calificaciones
- C-3 Termodinamica Tema Procesos TermodinamicosDocumento20 páginasC-3 Termodinamica Tema Procesos TermodinamicosBryanMottaZorrillaAún no hay calificaciones
- Análisis de Energía de Sistemas CerradosDocumento9 páginasAnálisis de Energía de Sistemas CerradosinmortaljcAún no hay calificaciones
- Estado Gaseoso para Quinto Grado de SecundariaDocumento5 páginasEstado Gaseoso para Quinto Grado de SecundariaErasmo Abel Llauce SiesquenAún no hay calificaciones
- Lección 05 - GasesDocumento6 páginasLección 05 - GasesFABIAN RODAS MENDOZAAún no hay calificaciones
- Termodinámica - ProcesosDocumento22 páginasTermodinámica - ProcesospabloillanesAún no hay calificaciones
- Tarea Equilibrio 1 1Documento2 páginasTarea Equilibrio 1 1Marco Medrano RamosAún no hay calificaciones
- Tarea Equilibrio 1.1Documento2 páginasTarea Equilibrio 1.1henguzAún no hay calificaciones
- Qué Es ArduinoDocumento3 páginasQué Es ArduinoArmando Gatiérrez GarciaAún no hay calificaciones
- Fenómenos naturales y desastresDocumento9 páginasFenómenos naturales y desastresArmando Gatiérrez GarciaAún no hay calificaciones
- Servicios AmbientalesDocumento4 páginasServicios AmbientalesArmando Gatiérrez GarciaAún no hay calificaciones
- Mapa Conceptual de Recursos NaturalesDocumento1 páginaMapa Conceptual de Recursos NaturalesArmando Gatiérrez GarciaAún no hay calificaciones
- Dimensiones de La Sustentabilidad y Los ODSDocumento1 páginaDimensiones de La Sustentabilidad y Los ODSArmando Gatiérrez GarciaAún no hay calificaciones
- Cadenas de ProduccionDocumento8 páginasCadenas de ProduccionArmando Gatiérrez GarciaAún no hay calificaciones
- Leyes de La TermodinamicaDocumento4 páginasLeyes de La TermodinamicaArmando Gatiérrez GarciaAún no hay calificaciones
- Compendio de Definiciones TermodinámicasDocumento7 páginasCompendio de Definiciones TermodinámicasArmando Gatiérrez GarciaAún no hay calificaciones
- Termodinámica: Conceptos clave de gases, cambios de fase y leyes termodinámicasDocumento8 páginasTermodinámica: Conceptos clave de gases, cambios de fase y leyes termodinámicasArmando Gatiérrez GarciaAún no hay calificaciones
- Plantas ElectricasDocumento0 páginasPlantas ElectricasDanny José Sánchez RodríguezAún no hay calificaciones
- Solucionario Practica Electricos 2Documento6 páginasSolucionario Practica Electricos 2Nicolas ParedesAún no hay calificaciones
- Equilibrio Rotacional PDFDocumento22 páginasEquilibrio Rotacional PDFDante Ch G100% (1)
- VectoresDocumento4 páginasVectoresJose MonroyAún no hay calificaciones
- Cinetica FinalDocumento16 páginasCinetica FinalJean Pierre Paredes TocasAún no hay calificaciones
- Anexo Instrucciones para La Tarea 1 Dimensionamiento de Un Lavador VenturiDocumento15 páginasAnexo Instrucciones para La Tarea 1 Dimensionamiento de Un Lavador VenturiSANDRAAún no hay calificaciones
- PresentaciónDocumento20 páginasPresentaciónYasmila BarrientosAún no hay calificaciones
- Cuáles Son Las 4 Capacidades Físicas BásicasDocumento4 páginasCuáles Son Las 4 Capacidades Físicas Básicaslesli fariasAún no hay calificaciones
- Trabajo Final de Fisica PP16Documento6 páginasTrabajo Final de Fisica PP16Deivid DreskAún no hay calificaciones
- Boletin ValenciaDocumento45 páginasBoletin Valenciacosasdeangel100% (1)
- Parámetros OndulatoriosDocumento19 páginasParámetros OndulatoriosSxto Johnathan Ipenza BallonAún no hay calificaciones
- Cap Tulo 7 Cinética Del Cuerpo Rígido en El PlanoDocumento27 páginasCap Tulo 7 Cinética Del Cuerpo Rígido en El Planofredy llano quispeAún no hay calificaciones
- Examen de DinamicaDocumento4 páginasExamen de Dinamicajis_laymonAún no hay calificaciones
- Tensión Superficial, Capilaridad, ÓsmosisDocumento4 páginasTensión Superficial, Capilaridad, ÓsmosisJose Antonio Martinez SalinasAún no hay calificaciones
- Movimiento cuerpo inclinado 1.5sDocumento4 páginasMovimiento cuerpo inclinado 1.5sSanti Del PezoAún no hay calificaciones
- Solucionario de examen parcial de Física 2Documento7 páginasSolucionario de examen parcial de Física 2catalina santanaAún no hay calificaciones
- Procesos de SeparacionDocumento88 páginasProcesos de SeparacionskimowasaAún no hay calificaciones
- Electromagnetismo para Ingeniería Electrónica Campos y Ondas 1ra Edicion Alejandro Paz ParraDocumento405 páginasElectromagnetismo para Ingeniería Electrónica Campos y Ondas 1ra Edicion Alejandro Paz ParraAlexDavidVillegasAún no hay calificaciones
- Comprobación de Diseño Redes AbiertasDocumento13 páginasComprobación de Diseño Redes AbiertasAlex RamirezAún no hay calificaciones
- 2do Energía PotencialDocumento7 páginas2do Energía PotencialAlfonso Isaias Zapata DamacelaAún no hay calificaciones
- EL EFECTO TÚNEL ENDocumento2 páginasEL EFECTO TÚNEL ENAndres LatorreAún no hay calificaciones
- Imagenes Por TC y PetDocumento11 páginasImagenes Por TC y PetHoward PatiñoAún no hay calificaciones
- MENDOZA Justificación de La Acción SísmicaDocumento13 páginasMENDOZA Justificación de La Acción SísmicaMariano AcimutAún no hay calificaciones
- Clase 8 Arrancadores Motores ElectricosDocumento33 páginasClase 8 Arrancadores Motores ElectricosJoe Huanca RiveraAún no hay calificaciones
- Análisis Del Movimiento Rectilíneo UniformeDocumento7 páginasAnálisis Del Movimiento Rectilíneo UniformeAntonio ValdezAún no hay calificaciones
- Examen Instrumentación IndustrialDocumento1 páginaExamen Instrumentación IndustrialRolo Cuero100% (1)
- Cap 6 - Equilibrio LV Corr Fig 8Documento47 páginasCap 6 - Equilibrio LV Corr Fig 8Andrea GalendeAún no hay calificaciones
- Tema5 2 PDFDocumento10 páginasTema5 2 PDFtomimakinaAún no hay calificaciones
- Practica 2 Velocidad - AceleracionDocumento5 páginasPractica 2 Velocidad - AceleracionrichintukAún no hay calificaciones
- Clase 15 - Relleno Hidráulico PDFDocumento30 páginasClase 15 - Relleno Hidráulico PDFJersonYparraguirreMillanAún no hay calificaciones