Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Mapa Conceptual-Ley de Los Gases
Cargado por
Piscis Yallercco67%(3)67% encontró este documento útil (3 votos)
857 vistas1 páginaTítulo original
Mapa Conceptual-Ley de los gases
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
67%(3)67% encontró este documento útil (3 votos)
857 vistas1 páginaMapa Conceptual-Ley de Los Gases
Cargado por
Piscis YallerccoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
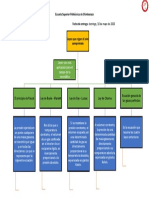
GASES IDEALES LEYES DE LOS GASES GASES REALES
Formados por partículas que no Se alejan del modelo ideal a presiones
interaccionan entre ellas y se mueven al altas y temperaturas bajas. Las
azar, las partículas cochan de manera Los gases no tienen ni forma ni moleculas chocan entre sí de forma
elástica volumen fijo. inelástica.
Su comportamiento depende de 4 variables:
Presión, temperatura absoluta, volumen y
cantidad de gas (número de moles).
LEY DE BOYLE Y LEY DE CHARLES LEY COMBINADA LEY DE LEY DE LOS LEY DE
MARIOTTE Y GAY-LUSSAC DE LOS GASES AVOGADRO GASES IDEALES GRAHAM
A temperatura A presión constante, el A temperatura y Establece que la
constante el volumen volumen ocupado por Expresa la relación presión constantes, el relación de la velocidad
(V) ocupado por una una masa de gas entre la presión, el volumen V ocupado por de difusión de dos
definida es volumen y la una muestra de gas, es gases es la misma que
masa definida de un Esta relación es llamada
directamente temperatura absoluta directamente la relación de la raíz
gas es inversamente ecuación de gas ideal y el
proporcional a su de una cantidad fija de proporcional al número cuadrada de la masa
proporcional a la valor numérico de R, la
temperatura absoluta gas. de moles (n) del gas molar de los gases.
presión aplicada. constante universal de los
gases, donde una mol de un
gas ideal ocupa 22.414 litros a
1.0 atmosfera de presión y
273.15 K (STP). Por lo tanto:
También podría gustarte
- Infografía Daniel L. Ley de Los Gases IdealesDocumento1 páginaInfografía Daniel L. Ley de Los Gases IdealesDaniel75% (4)
- Ondas SinusoidalesDocumento2 páginasOndas SinusoidalesGaige 020% (2)
- FISICA II - Reactivos Del Bloque 2Documento9 páginasFISICA II - Reactivos Del Bloque 2Otrebor Rapl100% (1)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Calibración de Un Probador BidireccionalDocumento9 páginasCalibración de Un Probador Bidireccionalandresfreak100% (1)
- Bibliografia de Gregor MendelDocumento4 páginasBibliografia de Gregor MendelGufjfu Yxyxyxyy0% (2)
- TEXTO de Comprensión Lectora CarmelinasDocumento3 páginasTEXTO de Comprensión Lectora CarmelinasJuan Lindo Lapa0% (1)
- Texto Argumentativo - Igualdad en La DiversidadDocumento4 páginasTexto Argumentativo - Igualdad en La DiversidadKAREN XIMENA SAENZ PARDOAún no hay calificaciones
- Funciones Del Agua en Seres VivosDocumento1 páginaFunciones Del Agua en Seres VivosMiraida Millán RodríguezAún no hay calificaciones
- Pegable El La Sociedad ColonialDocumento2 páginasPegable El La Sociedad ColonialMarcelis Peralta Rondon100% (1)
- TRIPTICODocumento2 páginasTRIPTICOJose YesquenAún no hay calificaciones
- Infografia Fisica 2Documento1 páginaInfografia Fisica 2Mafe Salas100% (1)
- TRIPTICO-1. Que Es La TermodinamicaDocumento2 páginasTRIPTICO-1. Que Es La TermodinamicaFreddy AC67% (3)
- Mapa Conceptual TemperaturaDocumento2 páginasMapa Conceptual TemperaturaHUGO DE GONZALEZ OSPINOAún no hay calificaciones
- Gases IdealesDocumento1 páginaGases IdealesCARLOS ARCOSAún no hay calificaciones
- Leyes FQDocumento4 páginasLeyes FQYesicaAún no hay calificaciones
- Termodinámica 4Documento4 páginasTermodinámica 4Alejandro GabrielAún no hay calificaciones
- Infografia GasesDocumento1 páginaInfografia GasesDanielAún no hay calificaciones
- Diagnostico EntradaDocumento6 páginasDiagnostico EntradaDaniela RomeroAún no hay calificaciones
- Tema 5. Gases 2x1Documento13 páginasTema 5. Gases 2x1tatinconcoca23Aún no hay calificaciones
- Gases IdealesDocumento1 páginaGases IdealesGómez Gutiérrez Brandon AccelAún no hay calificaciones
- Trabajo de GasesDocumento4 páginasTrabajo de GasesMiguel GómezAún no hay calificaciones
- Sem4-Gas PerfectoDocumento30 páginasSem4-Gas PerfectoAndres GarciaAún no hay calificaciones
- Ley de Los Gases IdealesDocumento24 páginasLey de Los Gases IdealesJoaquín Raymundo Muñoz MartínezAún no hay calificaciones
- Química FórmulasDocumento8 páginasQuímica Fórmulasnicole arevaloAún no hay calificaciones
- Gases Ideales PDFDocumento61 páginasGases Ideales PDFmatias arnauAún no hay calificaciones
- GasesDocumento1 páginaGasesRicardo GarcíaAún no hay calificaciones
- U2-E1-Lopez Zamora Luis FernandoDocumento8 páginasU2-E1-Lopez Zamora Luis FernandoLuis Fërnandö LòpezAún no hay calificaciones
- Wuolah-Free-Termodinámica y Cinética Química - Tema 2 - Equilibrios de Fase y Químico de SuperficiesDocumento25 páginasWuolah-Free-Termodinámica y Cinética Química - Tema 2 - Equilibrios de Fase y Químico de SuperficiesJORGE DANIEL CASARES REFOLIOAún no hay calificaciones
- Termodinamica (13177) Franklin Munoz 2016-1 PDFDocumento407 páginasTermodinamica (13177) Franklin Munoz 2016-1 PDFNaty Paez BarrazaAún no hay calificaciones
- Gases Ideales y Gases RealesDocumento13 páginasGases Ideales y Gases RealesHernández Torres Stephanie JoselineAún no hay calificaciones
- Informe 3Documento8 páginasInforme 3JENI MARCILLO MORÁNAún no hay calificaciones
- Guevara-Capacute DiapositivaDocumento14 páginasGuevara-Capacute Diapositivavictor capacuteAún no hay calificaciones
- Gases RealesDocumento36 páginasGases RealesLucero Fierro100% (1)
- Gases Ideales y RealesDocumento5 páginasGases Ideales y RealesJUAN ANTONIO DE LA CRUZ GOMEZAún no hay calificaciones
- 16 GasIdealDocumento9 páginas16 GasIdealraulAún no hay calificaciones
- Grupo 03 - Gases Ideales y Gases RealesDocumento21 páginasGrupo 03 - Gases Ideales y Gases RealesnfernandezAún no hay calificaciones
- El Estado Gaseoso Leyes de Los GasesDocumento27 páginasEl Estado Gaseoso Leyes de Los Gasesmaga_azulAún no hay calificaciones
- 1gases 2020Documento26 páginas1gases 2020julio GonzálezAún no hay calificaciones
- Clase Gases. Leyes de Los GasesDocumento42 páginasClase Gases. Leyes de Los GasesEMILIO RODRIGUEZ CALDERONAún no hay calificaciones
- Trabajo GasesDocumento3 páginasTrabajo GasesSheila100% (1)
- Unidad 7. Gases IdealesDocumento24 páginasUnidad 7. Gases IdealesasimonAún no hay calificaciones
- Exposición de GasesDocumento24 páginasExposición de GasesMaryel Elizabeth Salazar SarmientoAún no hay calificaciones
- Tema 4. Gases IdealesDocumento17 páginasTema 4. Gases IdealesBrisman Ricardo Palacin VargasAún no hay calificaciones
- Gases NovenoDocumento12 páginasGases NovenoPatricia OrozcoAún no hay calificaciones
- Gases IdealesDocumento20 páginasGases IdealesJEAN SEBASTIAN MEJIA GILAún no hay calificaciones
- TRABAJO 3. - Ley General de Los Gases y La Ecuación de Bernoulli PDFDocumento9 páginasTRABAJO 3. - Ley General de Los Gases y La Ecuación de Bernoulli PDFeduplay 11Aún no hay calificaciones
- Leyes GasesDocumento10 páginasLeyes Gasesjuan huamanAún no hay calificaciones
- De Lacruz - IMA - 2B - Leyes de Los AgasesDocumento2 páginasDe Lacruz - IMA - 2B - Leyes de Los AgasesCarlos De lacruzAún no hay calificaciones
- Power 4 - Gases - 2018Documento9 páginasPower 4 - Gases - 2018Johann SchmidtAún no hay calificaciones
- UNIDAD 4 - GasesDocumento27 páginasUNIDAD 4 - Gasesjose.torres1Aún no hay calificaciones
- Leyes Que Rigen El Aire Comprimido (José Escobar 2629)Documento2 páginasLeyes Que Rigen El Aire Comprimido (José Escobar 2629)joseAún no hay calificaciones
- Leyes Gases-1Documento10 páginasLeyes Gases-1Mauricio DiegoAún no hay calificaciones
- Gases IdealesDocumento16 páginasGases IdealesirisevangelinajerezAún no hay calificaciones
- Clase 8 BiofisicaDocumento5 páginasClase 8 BiofisicaWilly Daniel Cipriano CastroAún no hay calificaciones
- Leyes Gases-1Documento17 páginasLeyes Gases-1Fanny Sandoval RodríguezAún no hay calificaciones
- Gases Ideales PDFDocumento63 páginasGases Ideales PDFMelissa Arango FlóresAún no hay calificaciones
- Ley de Los Gases - CCPDocumento41 páginasLey de Los Gases - CCPStalin AriasAún no hay calificaciones
- Área: Ciencias Naturales Asignatura: Física Docente: Esp. Yenny R. Osorio Suárez Fecha de Devolución: 25/08/20 Grado: Octavo Estudiante: ObjetivoDocumento4 páginasÁrea: Ciencias Naturales Asignatura: Física Docente: Esp. Yenny R. Osorio Suárez Fecha de Devolución: 25/08/20 Grado: Octavo Estudiante: ObjetivoAlexis McallisterAún no hay calificaciones
- Estequiometria de Los GasesDocumento4 páginasEstequiometria de Los GasesJuliana carrillo HerreraAún no hay calificaciones
- Aire Comprimido Mapa ConceptualDocumento1 páginaAire Comprimido Mapa ConceptualCarlos Javier Vergara Guananga100% (1)
- Planificacion 2do Lapso 5to Año LiceoDocumento5 páginasPlanificacion 2do Lapso 5to Año LiceoCarlos Emigdio LozadaAún no hay calificaciones
- Informe 1 de Quimica Fisica BoyleDocumento12 páginasInforme 1 de Quimica Fisica BoyleMaría Gabriela GuevaraAún no hay calificaciones
- Introducción de La FísicaDocumento8 páginasIntroducción de La FísicacarlosAún no hay calificaciones
- El Concreto y Los TerremotosDocumento24 páginasEl Concreto y Los TerremotosJohan DionicioAún no hay calificaciones
- Ley de BoyleDocumento2 páginasLey de BoyleEnzoAún no hay calificaciones
- Sunfields Boletin Fotovoltaica AutonomasDocumento15 páginasSunfields Boletin Fotovoltaica AutonomasAlfredo BrambilaAún no hay calificaciones
- DabDocumento1 páginaDabKatherine León ValverdeAún no hay calificaciones
- Fenomenos ElectricosDocumento3 páginasFenomenos Electricosyorch mezaAún no hay calificaciones
- Los Estados de La MateriaDocumento7 páginasLos Estados de La Materiapaulacarrizo100% (1)
- C2 Energia Solar Fotovoltaica PDFDocumento155 páginasC2 Energia Solar Fotovoltaica PDForlandoAún no hay calificaciones
- V de Gowin OpticaDocumento4 páginasV de Gowin OpticaRonald Dos SantosAún no hay calificaciones
- Taller 2. Operaciones UnitariasDocumento2 páginasTaller 2. Operaciones UnitariasMariana GómezAún no hay calificaciones
- 01 - Glosario ProspectivaDocumento23 páginas01 - Glosario ProspectivaAdriana UruetaAún no hay calificaciones
- Grado de Reacción de Una Turbo Máquina y Su Ecuación para CalcularlaDocumento6 páginasGrado de Reacción de Una Turbo Máquina y Su Ecuación para CalcularlaTanya PasaperaAún no hay calificaciones
- Aire Acondicionado Tipo Split Fan Coil Expansion Directa Midea MTBDocumento2 páginasAire Acondicionado Tipo Split Fan Coil Expansion Directa Midea MTBMiguel Ruiz TatajeAún no hay calificaciones
- PrandtlDocumento4 páginasPrandtlFernando CamposAún no hay calificaciones
- La Conservacion de La Energia en Los Fluidos Hidrodinamica Hidrostatica y Termodinamica. F. Jarabo Friedrich F.J. Garcia Alvarez N. Elortegui EscartinDocumento25 páginasLa Conservacion de La Energia en Los Fluidos Hidrodinamica Hidrostatica y Termodinamica. F. Jarabo Friedrich F.J. Garcia Alvarez N. Elortegui EscartinLudovico BurgoaAún no hay calificaciones
- Caja CerradaDocumento15 páginasCaja Cerradasantiago maldonadoAún no hay calificaciones
- 5 Hidrostática (NXPowerLite) TDocumento17 páginas5 Hidrostática (NXPowerLite) Twendy Leslye Neira QuicañoAún no hay calificaciones
- Ley de OHMDocumento16 páginasLey de OHMFelipe ZuñigaAún no hay calificaciones
- La Fisica Del Ping-Pong EspaNolDocumento59 páginasLa Fisica Del Ping-Pong EspaNolAndy L Quezada Ordoñez100% (1)
- OndasDocumento50 páginasOndassothis2005Aún no hay calificaciones
- Ramas de La FísicaDocumento20 páginasRamas de La FísicaAlberto Zabala Bilbao100% (1)
- Reologia Aplicada A Procesos de Fundición y Propiedades Del Metal LíquidoDocumento9 páginasReologia Aplicada A Procesos de Fundición y Propiedades Del Metal LíquidoIsmael Saidi Naranjo100% (1)
- Tratatamiento Acustico y Termico.Documento38 páginasTratatamiento Acustico y Termico.titauhx100% (2)
- Tema 3 - Cuestiones y ProblemasDocumento8 páginasTema 3 - Cuestiones y ProblemasDeme CueVerAún no hay calificaciones
- Problemas - Trabajo y EnergiaDocumento2 páginasProblemas - Trabajo y EnergiaAnonymous kzl75IeTX5Aún no hay calificaciones