Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fuerzas de Van Der Waals
Cargado por
Siles Cuba José Alfredo1230 calificaciones0% encontró este documento útil (0 votos)
24 vistas5 páginasAlgo para quimica para los de 3 o 4 de SEC
Título original
fuerzas de Van der Waals
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoAlgo para quimica para los de 3 o 4 de SEC
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
24 vistas5 páginasFuerzas de Van Der Waals
Cargado por
Siles Cuba José Alfredo123Algo para quimica para los de 3 o 4 de SEC
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
fuerzas de Van der Waals
¿Qué son las fuerzas de Van der Waals?
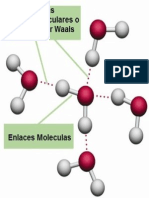
Se conoce como fuerzas de Van der Waals o interacciones de Van der Waals a
un cierto tipo de fuerzas intermoleculares atractivas o repulsivas, diferentes
de aquellas que generan los enlaces atómicos
(iónicos, metálicos o covalentes de tipo reticular) o la atracción electrostática
entre iones y otras moléculas.
Antes de mencionar los distintos tipos de fuerzas de Van der Waals, es
importante entender qué es la polaridad química. La polaridad química es
una propiedad de las moléculas que tienden a separar las cargas
eléctricas en su estructura. Es una propiedad muy relacionada con las
fuerzas intermoleculares (como las de Van der Waals), con
la solubilidad y con los puntos de fusión y ebullición. Dependiendo de la
polaridad, las moléculas pueden ser clasificadas en:
Moléculas polares. Están formadas por átomos con
electronegatividad muy diferente. El átomo con mayor
electronegatividad atrae los electrones del enlace y queda con una
densidad de carga negativa sobre él. Por otra parte, el átomo con
menor electronegatividad quedará con una densidad de carga positiva
sobre él. Esta distribución de cargas llevará finalmente a la formación
de un dipolo (sistema de dos cargas de signo opuesto e igual
magnitud).
Moléculas apolares. Están formadas por átomos con igual
electronegatividad, por lo que todos los átomos atraen de igual
manera los electrones del enlace.Un factor que también determina la
polaridad de una molécula es la simetría molecular. Existen moléculas
compuestas por átomos de diferente electronegatividad, pero que no
son polares. Esto ocurre porque cuando se suman las distintas
densidades de carga de las partes de la molécula, se anulan y
resultan en un momento dipolar nulo.
Entonces, las fuerzas de Van der Waals se manifiestan de tres formas
particulares:
Fuerzas de atracción de Keesom (interacciones dipolo-
dipolo). Son interacciones entre moléculas polares, es decir,
permanentemente polarizadas. Así, estas moléculas tienen un polo
positivo (con densidad de carga positiva 𝛅+) y uno negativo (con
densidad de carga negativa 𝛅–), y se orientan de forma que el polo
positivo se acerque con el polo negativo.
Fuerzas de atracción de Debye (interacciones dipolo permanente-
dipolo inducido). Tienen lugar entre una molécula polar y otra apolar,
pero que presenta una polaridad inducida. En este tipo de interacción,
el dipolo induce un dipolo transitorio en la molécula apolar.
Fuerzas de dispersión de London (dipolo inducido-dipolo
inducido). Son interacciones que ocurren entre moléculas apolares.
El movimiento de electrones en estas moléculas induce dipolos
transitorios, lo que provoca cierta atracción entre ellas. Son
interacciones muy débiles.
A la totalidad de estas fuerzas intermoleculares se las conoce como
Fuerzas de Van der Waals, nombre que hace homenaje al físico
holandés Johannes Diderik van der Waals (1837-1923), el primero en
proponer sus efectos en las ecuaciones de estado de un gas (conocida
como Ecuación de Van der Waals) en 1873. Por este hallazgo se le
concedió el Premio Nobel de Física en 1910.
Características de las Fuerzas de Van der Waal
Las fuerzas de Van der Waals crecen con la longitud del extremo no
polar de una sustancia.
Las fuerzas de Van der Waals resultan, por lo general, débiles
en comparación con los enlaces químicos ordinarios, lo que no les
impide resultar fundamentales para diversos campos de la física,
la biología y la ingeniería. Gracias a ellas muchos compuestos
químicos pueden ser definidos.
Las fuerzas de Van der Waals crecen con la longitud del extremo no
polar de una sustancia, puesto que están causadas por correlaciones
entre las polarizaciones fluctuantes entre átomos, moléculas o superficies
cercanas, consecuencia de la dinámica cuántica.
Presentan anisotropía, es decir, sus propiedades varían dependiendo de
la orientación de las moléculas: de ello a menudo depende que sean de
atracción o de repulsión.
Estas fuerzas son las más débiles que se dan entre moléculas en
la naturaleza: se requiere apenas 0,1 a 35 kJ/mol de energía para
vencerlas. Sin embargo, son cruciales para la formación de proteínas.
También podría gustarte
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Fuerzas de Van Der WaalsDocumento5 páginasFuerzas de Van Der WaalsSiles Cuba José Alfredo123Aún no hay calificaciones
- Fuerzas IntermolecularesDocumento6 páginasFuerzas IntermolecularesYuly Vanessa Caicedo PeñaAún no hay calificaciones
- Fuerzas IntermolecularesDocumento14 páginasFuerzas IntermolecularesTroller 47Aún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento15 páginasFuerzas de Van Der WaalsRoberto ReyesAún no hay calificaciones
- Fuerzas de Van der Waals: tipos, características y efecto ComptonDocumento5 páginasFuerzas de Van der Waals: tipos, características y efecto ComptonAlondraLaimeAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento7 páginasFuerzas de Van Der WaalsareacienciasAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesMarcos Muñoz CardonaAún no hay calificaciones
- Fuerzas de Van Der Waals ExpositivasDocumento11 páginasFuerzas de Van Der Waals ExpositivasArley GómezAún no hay calificaciones
- Fuerzas intermoleculares Van der WaalsDocumento6 páginasFuerzas intermoleculares Van der WaalsTayna RqpAún no hay calificaciones
- Fuerzas IntermolecularesDocumento6 páginasFuerzas IntermolecularesVickyAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento8 páginasFuerzas de Van Der WaalsMarcia Richert100% (3)
- Enlaces de Van Der WaalsDocumento2 páginasEnlaces de Van Der WaalsMoni PalaciosAún no hay calificaciones
- Momento Dipolar y Fuerzas IntermolecularesDocumento6 páginasMomento Dipolar y Fuerzas IntermolecularesJesusito Manuel RojasAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento5 páginasFuerzas de Van Der WaalsLaura CervantesAún no hay calificaciones
- Fuerzas Intermoleculares.Documento6 páginasFuerzas Intermoleculares.EDGAR IVAN MORALES VALLESAún no hay calificaciones
- Numero 2Documento4 páginasNumero 2skyfire aaAún no hay calificaciones
- Qué Son Las Fuerzas de Van Der WaalsDocumento6 páginasQué Son Las Fuerzas de Van Der Waalsloren del portilloAún no hay calificaciones
- Fuerzas IntermolecularesDocumento8 páginasFuerzas IntermolecularesElcira Alejandra Jaque JaqueAún no hay calificaciones
- Fuerzas de Van der Waals y puentes de hidrógenoDocumento2 páginasFuerzas de Van der Waals y puentes de hidrógenoJosé Daniel García ZalapaAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento7 páginasFuerzas de Van Der WaalsweikeAún no hay calificaciones
- Qui MicaDocumento4 páginasQui MicaAntonio BecerraAún no hay calificaciones
- UNIONESDocumento3 páginasUNIONESJazmin VelizAún no hay calificaciones
- Discusión Editar Ver Historial: 56 IdiomasDocumento3 páginasDiscusión Editar Ver Historial: 56 IdiomasGP GpAún no hay calificaciones
- Tarea 4 Qumica EnsayoDocumento3 páginasTarea 4 Qumica EnsayoLuis RicoAún no hay calificaciones
- Fuerza SDocumento3 páginasFuerza SpgAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento24 páginasFuerzas de Van Der WaalsDaniel CortezAún no hay calificaciones
- Fuerzas Intermoleculares, Hibridación de OrbitalesDocumento3 páginasFuerzas Intermoleculares, Hibridación de OrbitalesSharlyn DuarteAún no hay calificaciones
- Fuerza de Van Der WaalsDocumento10 páginasFuerza de Van Der WaalsJorgeAún no hay calificaciones
- Investigación Fuerzas de Van Der Waals - Delaney AcostaDocumento6 páginasInvestigación Fuerzas de Van Der Waals - Delaney AcostaRoxangel AdamesAún no hay calificaciones
- Fuerzas de Van Der WallsDocumento2 páginasFuerzas de Van Der WallsJuan FranciscoAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento4 páginasFuerzas de Van Der WaalsSuz MoonAún no hay calificaciones
- Fuerzas de Van Der WalsDocumento2 páginasFuerzas de Van Der WalsIsis Lilium ChanAún no hay calificaciones
- Fuerzas de Atracción de Sólidos y LíquidosDocumento8 páginasFuerzas de Atracción de Sólidos y LíquidosJiancarlo O. HidalgoAún no hay calificaciones
- AntecedentesDocumento17 páginasAntecedentesJosafat VidalAún no hay calificaciones
- Fuerzas de Van Der Waals y Sus TiposDocumento3 páginasFuerzas de Van Der Waals y Sus TiposBenjamin SoriaAún no hay calificaciones
- Tipo de Fuerzas MolecularesDocumento4 páginasTipo de Fuerzas MolecularesGuillermo FuentesAún no hay calificaciones
- Informe de Quimica N°03Documento9 páginasInforme de Quimica N°03JriellAún no hay calificaciones
- 2° Taller de Química OrgánicaDocumento4 páginas2° Taller de Química OrgánicaAldair ARAún no hay calificaciones
- Fuerzas de Interaccion MolecularDocumento13 páginasFuerzas de Interaccion MolecularSara Angélica Pimentel BonillaAún no hay calificaciones
- Distribución asimétrica de carga produce momento dipolarDocumento20 páginasDistribución asimétrica de carga produce momento dipolarmtvillaAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesAgustina RiveroAún no hay calificaciones
- Química Enlaces MetálicosDocumento9 páginasQuímica Enlaces MetálicosEL CHINOAún no hay calificaciones
- Monografia de QuimicaDocumento8 páginasMonografia de QuimicaJoa King Chaupis AdrianoAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento4 páginasFuerzas de Van Der WaalsJ Rodrigo Castro HAún no hay calificaciones
- COAGULACIÓNDocumento3 páginasCOAGULACIÓNMaría José MoyaAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesJuan Pedro Rivas TorresAún no hay calificaciones
- Importancia Del Enlace CovalenteDocumento3 páginasImportancia Del Enlace CovalenteRuben Rosero100% (3)
- Fuerzas Intermoleculares - Lecturas.Documento8 páginasFuerzas Intermoleculares - Lecturas.Karol ErazoAún no hay calificaciones
- Monografia de FuerzasDocumento2 páginasMonografia de FuerzasJose Grandez GongoraAún no hay calificaciones
- Las Fuerzas de Van Der WaalsDocumento2 páginasLas Fuerzas de Van Der Waalsbikers ACAún no hay calificaciones
- Enlaces QuímicosDocumento46 páginasEnlaces QuímicosCindy GutiérrezAún no hay calificaciones
- Fuerzas de Van Der Waals PDFDocumento3 páginasFuerzas de Van Der Waals PDFYesica CascoAún no hay calificaciones
- Fuerza VanDocumento5 páginasFuerza Vansiomara.mi.devAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesNicolas Meza OrtegaAún no hay calificaciones
- Fuerzas Intermolecularez 2018Documento3 páginasFuerzas Intermolecularez 2018Emilse GonzalezAún no hay calificaciones
- Fuerzas IntermolecularesDocumento18 páginasFuerzas Intermolecularesel ruxorAún no hay calificaciones
- Simulador QuímicaDocumento1 páginaSimulador QuímicaYesica CascoAún no hay calificaciones
- Trabajouu Quimica 1Documento6 páginasTrabajouu Quimica 1Juan Camilo Cardenas DuranAún no hay calificaciones
- Fuerzas Inter e IntramolecularesDocumento5 páginasFuerzas Inter e IntramolecularesJean ManuelAún no hay calificaciones
- Resumen La IliadaDocumento9 páginasResumen La IliadaR Patricio VillanuevaAún no hay calificaciones
- Procesos Físicos y QuímicosDocumento13 páginasProcesos Físicos y QuímicosSiles Cuba José Alfredo123Aún no hay calificaciones
- QUIERO SER GRANDE ResumenDocumento3 páginasQUIERO SER GRANDE ResumenSiles Cuba José Alfredo123100% (4)
- Himno Al Departamento de OruroDocumento5 páginasHimno Al Departamento de OruroSiles Cuba José Alfredo123Aún no hay calificaciones
- Cancionero SajamaDocumento16 páginasCancionero SajamaSiles Cuba José Alfredo123Aún no hay calificaciones
- La radio en la educación y la sociedadDocumento5 páginasLa radio en la educación y la sociedadSiles Cuba José Alfredo123Aún no hay calificaciones
- Himnos (Bolivianos)Documento11 páginasHimnos (Bolivianos)Siles Cuba José Alfredo123Aún no hay calificaciones
- EnlacesDocumento3 páginasEnlacesSiles Cuba José Alfredo123Aún no hay calificaciones
- ZZZZZZZZDocumento1 páginaZZZZZZZZSiles Cuba José Alfredo123Aún no hay calificaciones
- Podcast vs radio: Ventajas del podcastingDocumento1 páginaPodcast vs radio: Ventajas del podcastingSiles Cuba José Alfredo123Aún no hay calificaciones
- La IlíadaDocumento4 páginasLa IlíadaSiles Cuba José Alfredo123Aún no hay calificaciones
- Jan Łukasiewicz y la lógica polivalenteDocumento2 páginasJan Łukasiewicz y la lógica polivalenteSiles Cuba José Alfredo123Aún no hay calificaciones
- Jan Łukasiewicz y la lógica polivalenteDocumento2 páginasJan Łukasiewicz y la lógica polivalenteSiles Cuba José Alfredo123Aún no hay calificaciones
- Don Quijote de La ManchaDocumento6 páginasDon Quijote de La ManchaSiles Cuba José Alfredo123Aún no hay calificaciones
- La OdiseaDocumento13 páginasLa OdiseaSiles Cuba José Alfredo123Aún no hay calificaciones
- Procesos de Separación II: Destilación, Extracción y CristalizaciónDocumento45 páginasProcesos de Separación II: Destilación, Extracción y CristalizaciónCELAYA VENTOLERO VICTORAún no hay calificaciones
- Cambios de Estado Físico de La MateriaDocumento1 páginaCambios de Estado Físico de La MateriaRubén Andrés Espino HernándezAún no hay calificaciones
- Dilatacion Termica de Solidos.Documento15 páginasDilatacion Termica de Solidos.Felipe Zuñiga100% (1)
- Salida 02Documento3 páginasSalida 02Cristian Camilo Rincón HernándezAún no hay calificaciones
- Banco de Preguntas Quimica General PPD-MateriaDocumento5 páginasBanco de Preguntas Quimica General PPD-MateriaPatty Mendoza RiosAún no hay calificaciones
- Primer Taller de Transferencia de Calor Ii - 2022Documento4 páginasPrimer Taller de Transferencia de Calor Ii - 2022DANI CASTROAún no hay calificaciones
- Grupo 9. Trabajo 2. Producción de AnillinaDocumento26 páginasGrupo 9. Trabajo 2. Producción de AnillinaKaren Piñeros Gonzalez100% (1)
- Guia de Actividades y Rúbrica de Evaluación - Unidad 3 - Tarea 4 - Reacciones QuímicasDocumento12 páginasGuia de Actividades y Rúbrica de Evaluación - Unidad 3 - Tarea 4 - Reacciones QuímicasDroguerias De CórdobaAún no hay calificaciones
- EnzimasDocumento62 páginasEnzimasFaby MoraAún no hay calificaciones
- Guia Convección Libre 2020 - PDFDocumento5 páginasGuia Convección Libre 2020 - PDFIgnacio David Herrera SandovalAún no hay calificaciones
- Unidad I. Conceptos de Quimica. Parte IIDocumento13 páginasUnidad I. Conceptos de Quimica. Parte IICarlos GuerreroAún no hay calificaciones
- Química periódica y enlacesDocumento5 páginasQuímica periódica y enlacesBurGodAún no hay calificaciones
- Materiales Plasticos-E-2hDocumento32 páginasMateriales Plasticos-E-2hJose Marcelino Adsuara AlberolaAún no hay calificaciones
- Trabajo Escalonado - Grupo 6Documento26 páginasTrabajo Escalonado - Grupo 6Angel Trigoso CorteganaAún no hay calificaciones
- Practica 1Documento7 páginasPractica 1Lyly Llanes CarreónAún no hay calificaciones
- 9 1cristalizacionDocumento28 páginas9 1cristalizacionJulio TiradoAún no hay calificaciones
- Resumen Clase 3Documento10 páginasResumen Clase 3S Andrea Bravo MirandaAún no hay calificaciones
- Muestra de AguaDocumento3 páginasMuestra de AguaJhojan EspinosaAún no hay calificaciones
- Equilibrio MaterialDocumento28 páginasEquilibrio MaterialDome ObandoAún no hay calificaciones
- Hidratos de MetanoDocumento32 páginasHidratos de MetanodariannyAún no hay calificaciones
- Practica 1 Volumen Molar ParcialDocumento7 páginasPractica 1 Volumen Molar ParcialFabrizio Zevallos CuzmeAún no hay calificaciones
- Organica Practica 2Documento7 páginasOrganica Practica 2Eddy Andres Carvajal PadillaAún no hay calificaciones
- TAREA 8 AA GasesDocumento4 páginasTAREA 8 AA GasesLeonor DelgadoAún no hay calificaciones
- IntercambiadoresdecalorDocumento40 páginasIntercambiadoresdecalorGhiildhaa DooleyAún no hay calificaciones
- Tema 5 - Cinética QuímicaDocumento6 páginasTema 5 - Cinética QuímicaMiryam GarcésAún no hay calificaciones
- S09.s1 - Tarea Calificada RESUELTADocumento3 páginasS09.s1 - Tarea Calificada RESUELTAEmmer Raul Ayala SanchezAún no hay calificaciones
- Transferencia de calor en alambre de aluminioDocumento6 páginasTransferencia de calor en alambre de aluminioAngel MingaAún no hay calificaciones
- Pre Lab 2Documento13 páginasPre Lab 2Fátima MonroyAún no hay calificaciones
- G 6 L 7Documento3 páginasG 6 L 7SaraAún no hay calificaciones
- Pre Informe 6 Cuerpo NegroDocumento2 páginasPre Informe 6 Cuerpo NegromariaAún no hay calificaciones