Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Calor de Combustion
Cargado por
Isabela Mejia0 calificaciones0% encontró este documento útil (0 votos)
5 vistas1 páginaEl calor de combustión es la energía liberada cuando una sustancia, como un combustible o hidrocarburo, reacciona con oxígeno de forma exotérmica. Se mide usando una bomba calorimétrica, donde la sustancia se quema y calienta agua, midiendo la temperatura antes y después para calcular la energía liberada. La energía se divide por la masa de la sustancia para determinar el calor de combustión, que varía entre sustancias dependiendo de su inestabilidad química.
Descripción original:
trabajo
Título original
CALOR DE COMBUSTION
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl calor de combustión es la energía liberada cuando una sustancia, como un combustible o hidrocarburo, reacciona con oxígeno de forma exotérmica. Se mide usando una bomba calorimétrica, donde la sustancia se quema y calienta agua, midiendo la temperatura antes y después para calcular la energía liberada. La energía se divide por la masa de la sustancia para determinar el calor de combustión, que varía entre sustancias dependiendo de su inestabilidad química.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas1 páginaCalor de Combustion
Cargado por
Isabela MejiaEl calor de combustión es la energía liberada cuando una sustancia, como un combustible o hidrocarburo, reacciona con oxígeno de forma exotérmica. Se mide usando una bomba calorimétrica, donde la sustancia se quema y calienta agua, midiendo la temperatura antes y después para calcular la energía liberada. La energía se divide por la masa de la sustancia para determinar el calor de combustión, que varía entre sustancias dependiendo de su inestabilidad química.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
CALOR DE COMBUSTION
es la energía liberada cuando una determinada cantidad de material, por lo
general un mol, reacciona exotérmicamente con el oxígeno del aire. Se trata de
una propiedad termoquímica imprescindible en la caracterización de los
combustibles, alcoholes y, especialmente, hidrocarburos, tales como el butano y
metano.
Cuando una sustancia se quema libera luz y calor, que puede aprovecharse para
realizar trabajo sobre otros cuerpos. Por ejemplo, el calor generado es capaz de
calentar grandes volúmenes de agua
El calor de combustión varía entre todas las sustancias, aun cuando su naturaleza
química sea en esencia la misma. Esta variación corresponde a las estabilidades
relativas, es decir: mientras más inestable sea un compuesto, mayor será la
energía liberada, representada como -ΔH. El símbolo negativo significa que el
calor fluye hacia afuera.
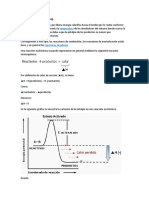
MEDICION
Para medir los calores de combustión se necesita de una bomba calorimétrica.
Dentro de ella la sustancia se hace reaccionar con el oxígeno por la activación de
una chispa eléctrica.
Luego, el calor liberado calienta un VOLUMEN de agua que rodea el
compartimiento de la muestra, midiéndose la temperatura antes y después de la
combustión, así como la masa de agua y del combustible.
Entonces, la energía liberada será igual a:
CeH2o·mH2O·ΔT
Donde CeH2o es el calor específico del agua, 4.184 J/g·ºC, mH2O la masa del
agua, y ΔT su cambio de temperatura. Finalmente, este calor, expresado en
unidades de joule o calorías, se divide entre la masa o los moles del combustible
colocado dentro de la bomba calorimétrica, para obtener así el calor de
combustión por unidad de masa o de moles.
También podría gustarte
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAún no hay calificaciones
- Uso de Equipo de Detección de GasesDocumento44 páginasUso de Equipo de Detección de GasesÁngel PiñónAún no hay calificaciones
- CALORIMETRÍADocumento22 páginasCALORIMETRÍAluisAún no hay calificaciones
- Trabajo Logistica Entregas CompletasDocumento31 páginasTrabajo Logistica Entregas CompletasIsabela MejiaAún no hay calificaciones
- Foro Colaborativo Subgrupo 22Documento28 páginasForo Colaborativo Subgrupo 22Isabela MejiaAún no hay calificaciones
- Material Proteccion Contra IncendiosDocumento162 páginasMaterial Proteccion Contra IncendiosBeluuBellini100% (1)
- Tercera Entrega Organizacion y MetodoDocumento35 páginasTercera Entrega Organizacion y MetodoIsabela MejiaAún no hay calificaciones
- CALORIMETRÍADocumento6 páginasCALORIMETRÍAmaria123Aún no hay calificaciones
- Segunda Entrega Organizacion y MetodoDocumento27 páginasSegunda Entrega Organizacion y MetodoIsabela MejiaAún no hay calificaciones
- Resumen Incendio y ExplosionesDocumento16 páginasResumen Incendio y Explosionesagustin yutrovicAún no hay calificaciones
- Informe 5 QMDocumento9 páginasInforme 5 QMKenneth AcostaAún no hay calificaciones
- Calor de CombustionDocumento3 páginasCalor de CombustionJONATHAN CASTILLEJOS LARAAún no hay calificaciones
- Infografia Calor de CombustiónDocumento1 páginaInfografia Calor de CombustiónDomingo Guerra100% (1)
- CombustionDocumento16 páginasCombustioncamilo_aguilar_2Aún no hay calificaciones
- Quimica Del Fuego, Evolución Del IncendioDocumento10 páginasQuimica Del Fuego, Evolución Del IncendioDavid S. Fornés MasAún no hay calificaciones
- CalorimetriaDocumento38 páginasCalorimetriaFabiola VelasquezAún no hay calificaciones
- Teoría de La CombustiónDocumento23 páginasTeoría de La Combustiónalinavfer1Aún no hay calificaciones
- Clase 3 Propagacion Del Calor CalderasDocumento113 páginasClase 3 Propagacion Del Calor CalderasMarilu Milagros Fernandez Alvarado De PachecoAún no hay calificaciones
- Calor de CombustiónDocumento5 páginasCalor de CombustiónJair DiazAún no hay calificaciones
- Poder Calorífico de Los CombustiblesDocumento4 páginasPoder Calorífico de Los CombustiblesFernando Coronado MamaniAún no hay calificaciones
- Cambio de FaseDocumento13 páginasCambio de Faseraquel lesly huamanccariAún no hay calificaciones
- Mechero de BunsenDocumento15 páginasMechero de BunsenLucero VeraAún no hay calificaciones
- Operación de Plantas Marinas - 094603Documento78 páginasOperación de Plantas Marinas - 094603Nelida RuizAún no hay calificaciones
- 3er Clase Calor - Presentacion - 2012-2Documento110 páginas3er Clase Calor - Presentacion - 2012-2Leonardo Rafael Martinez HuapayaAún no hay calificaciones
- 3er Clase Calor - Presentacion - 2017-1Documento110 páginas3er Clase Calor - Presentacion - 2017-1ANTUANETHE LETICIA OSORES LAUREANOAún no hay calificaciones
- SanchezA 2Documento14 páginasSanchezA 2Alan RangelAún no hay calificaciones
- Prevención e InvestigaciónDocumento48 páginasPrevención e InvestigaciónJhomny AquinoAún no hay calificaciones
- 0 Q1.Termoquímica Calorimetría 1 OKDocumento40 páginas0 Q1.Termoquímica Calorimetría 1 OKNicolas ArboledaAún no hay calificaciones
- Calorimetria Fisica 2 GRUPALDocumento26 páginasCalorimetria Fisica 2 GRUPALJOSUE MANUEL HERNANDEZ DAVILAAún no hay calificaciones
- Ficha 1 Prevencion Conceptos GeneralesDocumento47 páginasFicha 1 Prevencion Conceptos Generalesjuan santoroAún no hay calificaciones
- Termoterapia 1Documento21 páginasTermoterapia 1Rodo VidelaAún no hay calificaciones
- 1laboratorio N°6 - Temperatura CalorDocumento11 páginas1laboratorio N°6 - Temperatura CalorHeysem Chanel HUACANCA ROSALESAún no hay calificaciones
- Compre 300Documento14 páginasCompre 300Alan RangelAún no hay calificaciones
- Reacción ExotérmicaDocumento12 páginasReacción ExotérmicaRYUMASUAún no hay calificaciones
- 3.5 Termodinamica.Documento11 páginas3.5 Termodinamica.MaxDrucker100% (1)
- FFFFDocumento9 páginasFFFFCesar CardonaAún no hay calificaciones
- Tarea 1 ForoDocumento2 páginasTarea 1 ForoGENESIS JAELEEN FERNANDEZAún no hay calificaciones
- Termofisica y TermoquimicaDocumento7 páginasTermofisica y TermoquimicaGerardo Cipriano100% (1)
- USO DEL MECHERO Y ENSAYO DE LA LLAMA Laboratorio de QuimicaDocumento6 páginasUSO DEL MECHERO Y ENSAYO DE LA LLAMA Laboratorio de QuimicaDora MosqueraAún no hay calificaciones
- Calorimetria 2016Documento8 páginasCalorimetria 2016tanshinkouAún no hay calificaciones
- Modulo de Fisica 2022Documento15 páginasModulo de Fisica 2022Nicole De LeónAún no hay calificaciones
- Esfuerzos Combinados FluctuantesDocumento16 páginasEsfuerzos Combinados FluctuantesMartín OcampoAún no hay calificaciones
- Trabajo Combustión Grupo 1Documento49 páginasTrabajo Combustión Grupo 1alvarovegaAún no hay calificaciones
- Intro Tecnica×220421×guia de Estudio×u.01 Calor TemperaturaDocumento30 páginasIntro Tecnica×220421×guia de Estudio×u.01 Calor TemperaturaKaren AcostaAún no hay calificaciones
- GasesDocumento29 páginasGasesGaboooAún no hay calificaciones
- GR-16 Fisica Térmica QUISHPE JOELDocumento15 páginasGR-16 Fisica Térmica QUISHPE JOELjoel QuishpeAún no hay calificaciones
- CALORIMETRIADocumento5 páginasCALORIMETRIA205 44 Suhealy Jennifer Vazquez SanchezAún no hay calificaciones
- Ii CalorDocumento30 páginasIi CalorValeria Michelle Villagrana AlvaradoAún no hay calificaciones
- MECHERODocumento27 páginasMECHEROkatyushka29Aún no hay calificaciones
- Calor y TemperaturaDocumento17 páginasCalor y TemperaturaInmaGarcíaAún no hay calificaciones
- Preinforme Práctica 2 Grupo 6 Equipo 3Documento8 páginasPreinforme Práctica 2 Grupo 6 Equipo 3Juan Jose Castro RicoAún no hay calificaciones
- INFORME-10Documento16 páginasINFORME-10Ailen LeydaAún no hay calificaciones
- II.11. Naturaleza Del Fuego PDFDocumento15 páginasII.11. Naturaleza Del Fuego PDFdaniAún no hay calificaciones
- TermoquímicaDocumento4 páginasTermoquímicacamila alvaradoAún no hay calificaciones
- Química Del Fuego 0.2Documento25 páginasQuímica Del Fuego 0.2Andres Mizael Zaquiel Danielle BenaventtiAún no hay calificaciones
- Practica 9 - DETERMINACIÓN DE CALOR ESPECÍFICODocumento15 páginasPractica 9 - DETERMINACIÓN DE CALOR ESPECÍFICOAshley AraneaAún no hay calificaciones
- Práctica 9Documento14 páginasPráctica 9Isaac GuillenAún no hay calificaciones
- El Oxígeno Tiene La Capacidad de Combinarse Con Diversos Elementos para Producir ÓxidosDocumento2 páginasEl Oxígeno Tiene La Capacidad de Combinarse Con Diversos Elementos para Producir ÓxidosYordi VelasquezAún no hay calificaciones
- Calculo de Entalpía y Calor de Combustión.Documento28 páginasCalculo de Entalpía y Calor de Combustión.Fernando RoblesAún no hay calificaciones
- Diseño GraficoDocumento4 páginasDiseño GraficoAdolfo Vallejos VillegasAún no hay calificaciones
- Unidad 1 Combustible y CombustionDocumento11 páginasUnidad 1 Combustible y CombustionAngel Lopes cupilAún no hay calificaciones
- Pruebas Bondad Ajuste ClaseDocumento42 páginasPruebas Bondad Ajuste ClaseIsabela MejiaAún no hay calificaciones
- Primera Entrega Organizacion y MetodoDocumento12 páginasPrimera Entrega Organizacion y MetodoIsabela MejiaAún no hay calificaciones
- Pruebas Bondad Ajuste ClaseDocumento11 páginasPruebas Bondad Ajuste ClaseIsabela MejiaAún no hay calificaciones
- Pruebas - Bondad - Ajuste - Clase VV6Documento35 páginasPruebas - Bondad - Ajuste - Clase VV6Isabela MejiaAún no hay calificaciones
- Primera Entrega Procesos IndustrialesDocumento12 páginasPrimera Entrega Procesos IndustrialesIsabela MejiaAún no hay calificaciones
- Pruebas - Bondad - Ajuste - Clase VV6Documento65 páginasPruebas - Bondad - Ajuste - Clase VV6Isabela MejiaAún no hay calificaciones
- Calculo 1 Transporte AereoDocumento3 páginasCalculo 1 Transporte AereoIsabela MejiaAún no hay calificaciones
- Informe Entrega Previa 1 Programacion EstocasticaDocumento8 páginasInforme Entrega Previa 1 Programacion EstocasticaIsabela MejiaAún no hay calificaciones
- Hoja 02 C. Reconstruir GráficamenteDocumento4 páginasHoja 02 C. Reconstruir GráficamenteIsabela MejiaAún no hay calificaciones
- Actividad de Puntos Evaluables - Escenario 6 - PRIMER BLOQUE-CIENCIAS BASICAS - ALGEBRA LINEAL - (GRUPO B05)Documento5 páginasActividad de Puntos Evaluables - Escenario 6 - PRIMER BLOQUE-CIENCIAS BASICAS - ALGEBRA LINEAL - (GRUPO B05)Isabela MejiaAún no hay calificaciones
- Primera Entrega Organizacion y MetodoDocumento16 páginasPrimera Entrega Organizacion y MetodoIsabela MejiaAún no hay calificaciones
- Trabajo Colaborativo Semana 5 QuimicaDocumento2 páginasTrabajo Colaborativo Semana 5 QuimicaIsabela MejiaAún no hay calificaciones
- Metodo de HillDocumento2 páginasMetodo de HillIsabela MejiaAún no hay calificaciones
- HumedadDocumento3 páginasHumedadIsabela MejiaAún no hay calificaciones
- Entrega Previa N°2 Taller FinancieroDocumento7 páginasEntrega Previa N°2 Taller FinancieroIsabela MejiaAún no hay calificaciones