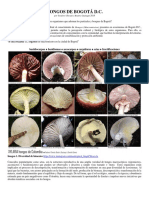
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Macrohongos en Un Predio de Quercus Humboldtii
Cargado por
Nathalia FlorianDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Macrohongos en Un Predio de Quercus Humboldtii
Cargado por
Nathalia FlorianCopyright:
Formatos disponibles
See discussions, stats, and author profiles for this publication at: https://www.researchgate.
net/publication/257262955
Macrohongos de un bosque de roble Quercus humboldtii (Fagaceae)
Chapter · January 2007
CITATION READS
1 748
1 author:
Aida Vasco
University of Antioquia
56 PUBLICATIONS 2,670 CITATIONS
SEE PROFILE
Some of the authors of this publication are also working on these related projects:
A new species of Leccinum (Basidiomycota, Boletales) from Belize View project
Casanare Macrofungi Exploration View project
All content following this page was uploaded by Aida Vasco on 15 July 2015.
The user has requested enhancement of the downloaded file.
Maratón en Biodiversidad – Jardín - Antioquia 2007
Macrohongos de un Bosque de Roble, Quercus humboldtii Bonpl., en la Vereda
Contrafuerte, Municipio de Andes (Colombia).
Carlos Alberto López-Q.1
Aída Marcela Vasco-Palacios2
Ana Esperanza Franco-Molano3
carpez99@yahoo.com1, avascop@yahoo.com.2, afranco@quimbaya.udea.edu.co3
Laboratorio de Taxonomía y Ecología de Hongos, Instituto de Biología, Universidad de
Antioquia. A.A.1226, Medellín, Colombia1,2,3. Fundación Biodiversa Colombia2.
Resumen
Durante la Maratón en Biodiversidad desarrollada en la Reserva Natural Cuchilla Jardín -
Támesis , en los municipios de Andes y Jardín, en el departamento de Antioquia el 19 de
mayo del 2006, se realizó una recolección de macrohongos en un pequeño relicto de bosque
dominado por robles (Quercus humboldtii Bonpl.), localizado en la Vereda Contrafuerte del
Municipio de Andes. En total se realizaron 44 colecciones de macrohongos, y se
identificaron 42 especies, de las cuales, 39 están distribuidas en 35 géneros, 26 familias y
11 órdenes del phylum Basidiomycota, las 3 especies restantes pertenecientes a 2 géneros,
2 familias y 2 órdenes del phylum Ascomycota. El 35% de las especies colectadas son
ectomicorrizas y el 65 % descomponedores de materia orgánica.
Palabras clave: Ectomicorriza, roble, descomponedores, diversidad fúngica, región andina.
Abstract
During the marathon in biodiversity carried out in the natural reserve located in the cuchilla
Jardín-Tamesis, in the department of Antioquia, at 19th May of 2006, a collection of
macrofungi was made in a small forest fragment dominated by oaks (Quercus humboldtii
Bonpl.). The fragment is located in the vereda Contrafuerte in the Andes municipality. In
total, 44 collections were registered, 42 species were identified from which 39 species are
Maratón en Biodiversidad – Jardín - Antioquia 2007
distributed in 35 genera, 26 families and 11 orders that belongs to Phylum Basidiomycota,
the other three species are distributed in 2 genus, 2 families and 2 orders of the phylum
Ascomycota. 35% of collected species are ectomycorrhizal and 65% is constituted by
decomposer macrofungi.
Key words: Ectomicorrhiza, oak, decomposers, fungal diversity, andean region.
Agradecimientos
Deseamos expresar nuestros más sinceros agradecimientos a las personas que nos
acompañaron en la recolección de los hongos el día de la maratón, y al Laboratorio de
Taxonomía y Ecología de Hongos, de la Universidad de Antioquia, donde se realizó la
identificación de los especimenes. De forma muy especial extendemos nuestros
agradecimientos al agrónomo de la Universidad de Caldas, Marcelo Betancur y al biólogo
José David Sierra por su ayuda en campo y la identificación de algunas de las colecciones.
Al Dr. Roy Halling y a la bióloga Ruth Aldana Gómez por el préstamo de algunas de las
imágenes usadas en este trabajo (Figuras 5, 7, 9 Halling; Figura 4 Aldana)
Introducción
Los hongos son organismos eucarióticos, heterotróficos, cuya nutrición se da por absorción,
tomando los nutrientes del medio, que ya han sido digeridos previamente gracias a su carga
enzimática. Estos organismos están conformados por estructuras filamentosas
multinucleadas llamadas hifas, caracterizadas por poseer pared celular, compuesta
principalmente por quitina y β-glucanos que le proporcionan rigidez; estos organismos no
poseen movimiento y su reproducción se realiza por esporas sexuales o asexuales. Los
hongos fueron, durante muchos años, incluidos dentro del Reino de las plantas y por tanto
comprendidos en los estudios botánicos, sin embargo, estudios recientes demuestran que
los hongos son un Reino independiente y que están más relacionados con los animales que
con las plantas, probablemente por un ancestro coenoflagelado.
Maratón en Biodiversidad – Jardín - Antioquia 2007
El Reino de los Hongos (Fungi) inicialmente se dividió de forma artificial en dos grandes
grupos: el primero conocido como hongos superiores incluía a todos aquellos organismos
conformados por hifas septadas, y el segundo grupo, denominado hongos inferiores, en
donde se ubicaron aquellos organismos que en la actualidad hacen parte de los Reinos
Protista y Cromista, caracterizados principalmente por poseer hifas coenocíticas y una fase
móvil dentro de su ciclo reproductivo. En años recientes y con el advenimiento de las
técnicas moleculares, se ha contribuido fuertemente a alcanzar un arreglo mucho más
objetivo y filogenético del Reino Fungi, el cual promete una mayor estabilidad (Gams et
al., 1998).
Los hongos y sus parientes constituyen uno de los grupos más grandes y menos conocidos
de organismos, a pesar de su ubicuidad e importancia en la naturaleza (Mueller et al.,
2004). Su diversidad se ha estimado en 1,5 millones de especies, de las que se encuentran
descritas aproximadamente el 5%, es decir, alrededor de 75.000 (Hawksworth, 2001).
Considerando únicamente la diversidad de macrohongos1 a escala mundial usando el
modelo de extrapolación a partir de la proporción planta-hongo propuesta por Hawksworth
(1991) y con los datos de un estudio realizado en México, podría estimarse que el total de
macrohongos sería aproximadamente un millón de especies.
Adicionalmente, la literatura disponible sugiere que la diversidad fúngica en los trópicos es
mucho mayor que en las regiones templadas (Hawksworth, 2001). Muchos factores
influencian la diversidad de los macrohongos en un sitio determinado, entre los que se
1
El término macrohongo se aplica a aquellos carpóforos mayores de un milímetro de
diámetro (Gams, 1992) los cuales, en su mayoría pertenecen a los phyla Ascomycota o
Basidiomycota (Mueller et al., 2004). No obstante, muchas de las especies pertenecientes a
las clases Uredinomycetes, Ustilaginomycetes, Myxomycetes y algunos de la clase
Ascomycetes forman estructuras que son visibles a simple vista, pero, no se incluyen dentro
de esta clasificación artificial (Arnolds, 1992; Gams, 1992).
Maratón en Biodiversidad – Jardín - Antioquia 2007
incluyen la naturaleza del hábitat, la diversidad de especies vegetales, la diversidad de
sustratos, la localización geográfica, los tipos de suelo y el clima (Lodge, 1995, 1997;
Mueller et al., 2004).
En la actualidad, las mayores limitaciones que se presentan en los estudios de la diversidad
de macrohongos son la escasez de taxónomos especialistas y de recursos para la
identificación del material fúngico. Mueller y colaboradores (2004), afirman, que no existe
alguna región del mundo con una micota completamente identificada, como si ocurre en el
caso de la flora de plantas vasculares, condición que posiblemente va a persistir por algún
tiempo.
A medida que los hábitats son degradados y destruidos cada año, cientos o quizás miles de
especies desaparecen, incluso antes de que estas sean conocidas (Mueller et al., 2004;
Lewis 2006). La explotación irracional y la tala indiscriminada de grandes extensiones de
bosques tropicales promueven, como lo demuestra Laurence (1998), un decline tanto en la
diversidad de organismos, como de su biomasa. De igual manera, el efecto de la
fragmentación causa perdidas en la diversidad de especies del sotobosque, especialmente
plántulas de árboles, dejando en peligro el mantenimiento de la biodiversidad de los
bosques tropicales lluviosos y comprometiendo la regeneración futura de los bosques
(Benitez & Martinez, 2003).
Como producto del esfuerzo de especialistas y personal capacitado en algunos de los
diferentes grupos de organismos que conforman la biodiversidad colombiana (Plantas,
Aves e Insectos), se ha confirmado que Colombia es uno de los países mega-diversos del
planeta (Forero, 1999). Sin embargo, el desconocimiento de grupos tan importantes como
el de los hongos es evidente, a pesar de que es un grupo tan diversos como el de los
insectos.
Es de anotar que las pocas exploraciones micológicas en el país se han realizado en la
región andina, principalmente en ecosistemas de bosque dominados por robles (Quercus
Maratón en Biodiversidad – Jardín - Antioquia 2007
humboldtii Bonpl.), eucaliptos o pinos (Franco-M. et al., 2000). Adicionalmente, un par de
trabajos han sido realizados en la cuenca amazónica, en los que se han registrado los
macrohongos de la región del medio Caquetá y del parque Natural Nacional Amacayacu en
el departamento del Amazonas (Franco-M. et al., 2005; Vasco-P. et al., 2005).
Método de muestreo
Existen dos formas básicas para el muestreo y monitoreo de macrohongos, la primera
consiste en la detección de micelio, esporas u otras estructuras microscópicas y la segunda
consiste en la recolección de las estructuras macroscópicas llamadas en general carpóforos,
esporóforos, esporocarpos o cuerpos fructíferos y basidiomas o basidiocarpos en el caso de
los macrohongos pertenecientes a la clase Basidiomycete y ascomas o ascodarpos para
aquellos de la clase Ascomycete (Standardized inventory methodologies for components of
Brithish Columbia’s Biodiversity, 1997). Para realizar las exploraciones micológicas en
alguna de estas dos formas básicas, existen diferentes técnicas basadas ya sea en el
establecimiento de parcelas o transectos o bien, simplemente recolecciones en recorridos al
azar.
En el muestreo realizado durante la Maratón en Biodiversidad en el área rural del municipio
de Andes, se hizo un recorrido al azar a través de un fragmento de bosque mixto dominado
por robles (Quercus humboldtii Bonpl.), y se colectaron los macrohongos siguiendo las
recomendaciones de literatura especializada (Cifuentes et al., 1986; Halling, 1986; Franco
et al., 2005; Zalamea, 2002). Las diferentes colecciones se describieron macroscópicamente
y se practicaron algunas pruebas macro-químicas (reacción de los diferentes tejidos en
hidróxido de potasio y sulfato ferroso). Toda la información se consignó en una base de
datos que además incluyó los datos de localidad, sustrato donde se encontró el espécimen,
hábito, colector y número de colección. En algunos casos se obtuvo un registro fotográfico
de la colección.
Maratón en Biodiversidad – Jardín - Antioquia 2007
Una vez documentadas las colecciones se deshidrataron para su conservación, para esto se
empleó un deshidratador de alimentos marca Dörrex SIGG, las colecciones se dejaron
aproximadamente 12 horas a 55º C; ya secas, éstas se empacaron en bolsas plásticas y se
llevaron al laboratorio de Taxonomía y Ecología de Hongos, del Instituto de Biología de la
Universidad de Antioquia, donde se realizaron las descripciones y mediciones
microscópicas y las pruebas microquímicas regulares sugeridas en la literatura (Largent et
al., 1977). La información obtenida en campo y las descripciones microscópicas fueron
necesarias para la identificación de los especímenes. Las colecciones se depositaron en el
Herbario de la Universidad de Antioquia (HUA).
Resultados
La sistemática del reino Fungi esta en continua reforma como consecuencia del
descubrimiento de nuevas especies, la identificación de patrones y asociaciones ecológicas,
la evidencia molecular y el incremento en los estudios filogenéticos de los miembros de
este reino. Por lo anterior, decidimos basarnos en la clasificación propuesta por el
diccionario de los hongos (Kirk et al., 2001), dicha clasificación esta fundamentada en
trabajos relativamente recientes, que utilizan la secuenciación de regiones de DNA, como
criterios taxonómicos para establecer las diferentes relaciones filogenéticas de las especies.
La misma clasificación puede ser accedida en la base de datos del Index Fungorum:
http://www.speciesfungorum.org/Names/Names.asp (Kirk, 2004).
Como resultado del esfuerzo de muestreo realizado el día 19 de mayo de 2006, en la vereda
Contrafuerte del municipio de Andes (Antioquia), se realizaron un total de 44 colecciones,
distribuidas en 11 órdenes, 26 familias, 35 géneros y 42 especies (Tabla 1) de los Phyla
Basidiomycota y Ascomycota del reino Fungi.
Las familias que registraron el mayor número de especies fueron: Cortinariaceae R. Heim
ex Pouzar, Tricholomataceae R. Heim ex Pouzar, Boletaceae Chevall., Marasmiaceae
Maratón en Biodiversidad – Jardín - Antioquia 2007
Roze ex kühner, Xylariaceae Tul. & C. Tul. y Russulaceae Lotsy, (Figura 1), para el resto
de familias solo se registró una especie.
7
6
5
4
3
2
1
0
Cortinariaceae
Trichlomataceae
Xylariacae
Boletaceae
Marasmiaceae
Russulaceae
Figura 1. Familias con el mayor número de especies colectadas en un fragmento de bosque
mixto con dominancia de robles (Quercus humboldtii) en la vereda Contrafuerte,
municipio de Andes (Antioquia).
Es relevante mencionar aquí que las familias Boletaceae, Cortinariaceae y Russulaceae,
además de, ser consideradas como saprofíticas, también desempeñan un importante papel
ecológico como simbiontes ectomicorrícicos de algunos árboles presentes en el sitio de
muestreo.
Discusión
Hongos ectomicorrízicos
Las asociaciones ectomicorrícicas (ECM) son llamadas “asociaciones ectotróficas” o
“micorrizas envolventes” y constituyen asociaciones mutualistas de hongos superiores y
Maratón en Biodiversidad – Jardín - Antioquia 2007
plantas Gymnospermas y Angiospermas, de las familias Pinaceae, Cyperaceae,
Fagaceae, Caesalpinaceae, Fabaceae, Mimosaceae, Myrtaceae, Meliaceae,
Euphorbiaceae y Ericaceae (Sivasithamparam et al., 2002), aunque no todos los géneros
pertenecientes a estas familias presentan este tipo de asociación.
Las asociaciones ectomicorrícicas confieren a sus integrantes varios beneficios, de los
cuales podemos mencionar aquellos refernciados por Sivasithamparam y otros (2002):
- Participación fundamental en el reciclaje de nutrientes (Vog et al., 1982)
- Transferencia de Carbón desde la planta hospedera (Setälä et al., 1999)
- Promoción de la estructura y química del suelo por efecto de las hifas (Griffiths et
al., 1991)
- Incremento de la resistencia de la planta hospedera contra el ataque de patógenos
(Morin et al., 1999).
Del total de especies identificadas, el 35% son ectomicorrizas asociadas a la única especie
de roble encontrada hasta ahora en Colombia, Quercus humboldtii Bonpl. entre las especies
encontradas en el muestreo están Cortinarius sp 1 y sp 2, Russula silvestris, Russula
puiggarii, Leccinum talamancae (Figura X.), Chalciporus cf. caribaeus y Rozites
colombiana. Esta última especie fue descrita con base a especimen colectado en Colombia,
en los Llanos de Cuivá, departamento de Antioquia, de acuerdo con los autores Halling y
Müeller (2005), que pudo tener su origen en el hemisferio norte y luego haber migrado
hacia el sur asociado al roble, esta suposición podría también aplicar para las otras especies
de hongos ectomicorrícicos registrados en este inventario, mas aún, podría ser la hipótesis
mas plausible para explicar la distribución de muchas otras especies de hongos
ectomicorrícicos que se encuentran comúnmente en plantaciones de pinos y eucaliptos.
Hongos descomponedores de materia orgánica
El 65 % de las colecciones restantes (29 especies), correspondieron a hongos
descomponedores, que crecen tanto en el suelo como en material vegetal o animal y que
Maratón en Biodiversidad – Jardín - Antioquia 2007
son tan importantes como los ectomicorrícicos, ya que desempeñan funciones claves en los
bosques tropicales, donde la producción de material vegetal reciclable es muy alta, en
donde la biomasa de micelio fúngico presente en este tipo de sustratos participa de forma
fundamental en el reciclaje de elementos (Killham, 1994; Wardle et al., 2004). Los hongos
descomponedores junto con los líquenes (simbiosis obligada entre un hongo y un alga)
participan en la formación y estabilidad de agregados en el suelo, promoviendo la
formación de nichos para organismos microscópicos tales como, protozoos, bacteria,
rotíferos y nematodos; la mineralización de nutrientes inorgánicos promueve el crecimiento
vegetal y mejora la fertilidad del suelo (Dighton, 2003). Otra función importante de los
hongos descomponedores, en la que participan también otros organismos del suelo y es la
de secuestrar en su biomasa los elementos disponibles en el suelo, previniendo así la
pérdida de estos por lixiviación, actuando en algunos casos como bioremediadores,
incorporando en sus tejidos aquellos elementos que son considerados como contaminantes.
Los hongos son un grupo de organismos claves en la regulación de procesos en los
ecosistemas naturales, debido a su interacción con factores bióticos y abióticos. Como
producto de la descomposición de material vegetal (hojas, vástagos, ramas, troncos, flores,
semillas y frutos) o animal, vivo o muerto, se reintegran al medio sustancias tan
importantes como el carbono, conduciendo el ciclo global del carbón.
Sustratos
Los hongos colectados durante el muestreo realizado en el relicto de bosque ubicado en el
municipio de Andes (Antioquia), se encontraron sobre sustratos como el suelo, la madera y
la hojarasca (Figura 2), no se hallaron hongos creciendo sobre material de origen animal.
Del total de especies encontradas, el 54.5% correspondió a hongos creciendo sobre el suelo,
y el 34.1% sobre madera en diferente grado de descomposición y de diferente origen
(Especie arbórea y tipo de madera: ramas, troncos, vástagos etc.). Por último, las
colecciones encontradas sobre hojas constituyeron solo el 6.8% del total de colecciones
realizadas en la salida.
Maratón en Biodiversidad – Jardín - Antioquia 2007
Figura 2. Sustratos sobre los que se encontraron las especies colectadas en un fragmento
de bosque mixto con dominancia de robles (Quercus humboldtii) en la vereda Contrafuerte,
municipio de Andes (Antioquia).
El carácter ectomicorrícico de estos bosques y la disponibilidad de nutrientes en el suelo
son probablemente algunas de las razones para explicar porque se presentó un número tan
alto de colecciones sobre el sustrato suelo. La cantidad de carpóforos y especies colectadas
sobre madera depende en gran medida de la calidad, abundancia y grado de
descomposición de este sustrato. El bajo número de especies de macrohongos encontrados
creciendo sobre la hojarasca podría explicarse, por factores similares a los de la madera y
además a la estacionalidad propia de los hongos.
Usos
Algunas de las especies encontradas en este estudio están registradas en la literatura como
comestibles, tal es el caso de: Schizophyllum commune Fr.:Fr., Auricularia fuscosuccinea
Mont. Henn., Cantharellus cf. cibarius Mont., Lentinus crinitus (Linn.:Fr.) Fr. y Tremella
mesenterica Retz., que además de presentar valores nutricionales importantes, en algunos
casos, presentan también propiedades medicinales (Franco-Molano et al., 2005).
Maratón en Biodiversidad – Jardín - Antioquia 2007
Conclusiones
Los datos presentados en este trabajo son el resultado de una única jornada de colecta en un
pequeño remanente de bosque de robles, que sobrevive aún en los alrededores del
Municipio de Andes. Estos muestran apenas un leve esbozo de la micota presente en este
tipo de ecosistemas y la conclusión principal que podemos sacar de este ejercicio es la de
una clara necesidad de realizar inventarios exhaustivos que nos permita conocer los
recursos que tenemos, así como también investigaciones de tipo ecológico tanto en los
bosques de robles, como en los otros tipos de bosques que se presentan en la zona que
evalúen el papel de los hongos en los ecosistemas andinos.
Bibliografía
- Calonge, F.D.; Castellanos, J.; Cuesta, J.; Daniel-Arranz, J.; García-Rollán, M.;
Moreno, G.; Navarro, J.; Daniëls, P.P.; Roqué, F. y Santos, J.M. 1999. Setas de
Madrid y alrededores 2. Gasteromycetes. Publ. Soc. Micol. Madrid. 159 pp.
- Cifuentes, J.; Villegas, M. y Pérez-Ramirez, L. 1986. Hongos. En: Lot A. & Chiang, F
(edts.) Manual de Herbario. Administración y manejo de colecciones, técnicas de
recolección y preparación de ejemplares botánicos. Consejo Nacional de Flora de
México. México.
- Coker, W.C. & Couch, J.N. 1974. The Gasteromycetes of the Eastern United States and
Canada with a supplementary article "The Gasteromycetes of Ohio". New York.
201 pp.
- Cuesta, J.; Daniel-Arranz, J.; Calonge, F.D.; García-Rollán, M.; Horcajada, G.M.;
Parra, L.A.; Campoamor, J:N.; Daniëls, P.P.; Roqué, F. Santi-Sanz, J:M. 1999.
Setas de Madrid y alrededores 2. Gasteromycetes. Publicación de la Sociedad
Micológica de Madrid. 159 pp.
- Dennis, R.G.W. 1970. Fungus Flora of Venezuela and Adjacent Countries. Kew Bulletin
Additional Series III. Royal Botanic Gardens, Kew. England. 531 pp.
- Dighton, J. 2003. Fungi in Ecosystems Processeses. Mycology Vol. 17. Marcel Dekker,
Inc. USA. 432pp.
Maratón en Biodiversidad – Jardín - Antioquia 2007
- Franco-M, A.E.; Aldana-G, R. y Halling, R.E. 2000. Setas de Colombia (Agaricales,
Boletales y otros hongos). Multimpresos, Medellín. 156 pp.
- Franco-Molano A. E., Vasco P. A., López-Q C. A., Boekhout T. 2005. Macrohongos
de la región del medio Caquetá-Colombia. Guía de Campo. Multimpresos,
Medellín. 211pp.
- Forero, E. 1999. La Sistemática en Colombia para el siglo XXI. Revista de la Academia
Colombiana de Ciencias Exactas y Naturales 23(86): 129-137
- Gams, W., Van der Aa, H. A., Aptroot, A., Boekhout, T., de Cock, A. W. A. M.,
Hoekstra, E. S., de Hoog, G. S., Samson, R. A., Smith, M. Th., Stalpers, J. A.,
Tan, C. S., Verkley, G. J. M. 1998. CBS Course of Micology. Centraalbureu voor
Schimmelcultures. The Netherlands. 165pp.
- Griffiths, R.P.; Ingham, E.R.; Caldwell, B.A.; Castellano, M.A. Cromack, K.J. 1991.
Microbial characteristics of ectomycorrhizal mat communities in Oregon and
California. Biology and Fertility of Soils 11: 196-202.
- Halling, R.E. y Mueller, G.M. 2005. Common mushrooms of the Talamanca Mountains,
Costa Rica. The New York Botanical Garden. New York. 195 pp.
- Halling, R.E. y Ovrebo, C.L. 1987. A new species of Rozites from oak forests of
Colombia, with notes on biogeography. Mycologia 79(5): 674-678.
- Halling, R. 1986. Recommendations for collecting mushrooms. En: Alexiades, M. (Edt.)
selected guidelines for ethnobotanical research: A field manual. The New York
Botanical Gardens, Bronx, U.S.A. pp. 135-141.
- Hawksworth, D. L. 1991. The fungal dimension of biodiversity: magnitude, significance,
and conservation. Mycological Research 95: 641-655.
- Hawksworth, D. L. 2001 The magnitude of fungal diversity: the 1.5 million species
estimate revisited. Mycological Research 105: 1422-1432.
- Killham, K. 1994. Soil Ecology. Cambridge University Press.
- Kirk, P.M.; Cannon, P.F.; David, J.C. & Stalpers, J.A. 2001. Ainsworth & Bisby's
Dictionary of the Fungi. 9th Edition. CAB International. 655 pp.
-Kirk, P.M. 2004. Index Fungorum. CABI Bioscience Databases. Consultada en Octubre
de 2006. http://indexfungorum.org/Names/names
Maratón en Biodiversidad – Jardín - Antioquia 2007
- Largent, D. ; Johnson, D. ; Watling, R. 1977. How to identify mushrooms to genus III.
Microscopic features. Mad River Press, Inc. 148 pp.
- Largent, D.; Baroni, T.J. 1988. How to Identify Mushrooms to Genus VI: Modern
Genera. Mad River Press, Inc. 277 pp.
- Laurance W. F.; Ferreira L. V.; Gascon C. 1998. Biomass Decline in Amazonian
Forest Fragments. Science 282: 1611a
- Lentz, P.L. 1995. Stereum and allied genera of fungi in the upper Mississippi valley.
Agriculture Monograph No. 24. Department of agriculture, Washington DC. 74 pp.
- Lewis S. L. 2006. Review. Tropical forests and the changing earth system. Philosophical
Transactions of the Royal Society B: Biological Sciences. 361: 195-210.
- Lodge, D.J.; Cantrell S. 1995. Fungal communities in wet tropical forests: variation in
time and space. Canadian Journal of Botany 73(Suppl. 1): S1391-S1398.
- Miller, Jr. O.K. y Miller, H. H. 1988. Gasteromycetes: Morphological and development
features with keys to orders, families and genera. Mad River Press, Inc. 157 pp.
- Morin, C.; Samson, J.; Dessureault, M. 1999. Protection of black spruce seedlings
against Cylindrocladium root rot with ectomycorrhizal fungi. Canadian Journal of
Botany. 77: 169-174.
- Mosser, M. 1983. Keys to Agarics & Boleti. 4th Edition. Verlag Stuttgart. 535 pp.
- Mueller G. M.; Bills G. F. and Foster M. S. 2004. Biodiversity of Fungi. Inventory and
Monitoring Methods. Elsevier Academic Press.
- Müeller, G.M. y Vellinga, E.C. 1986. Taxonomic and nomenclatural notes on Laccaria
B. & Br. Laccaria amathystea, L. fraterna, L. laccata, L. pumila and their
synonyms. Persoonia.13: 27-43 pp.
- Nuñez, M. y Ryvarden, L. 2001. East Asian polypores Vol. 2. Synopsis Fungorum 14.
Fungiflora. Oslo, Norway. 522 pp.
- Pegler, D.N. 1983. Agaric flora of the lesser Antilles. Kew Bulletin Additional series IX.
Royal Botanic Gardens. England. 668 pp.
- Petersen, R. H. 1975. Ramaria subgenus Lentoramaria with emphasis on North
American taxa. Bibliotheca Mycologica No. 43. J. Cramer. Germany. 161 pp.
Maratón en Biodiversidad – Jardín - Antioquia 2007
- Setälä, H.; Kulmala, P.; Mikola, J.; Markkola, A.M. 1999. Influence of
ectomycorrhiza on the structure of detrital food webs in rhizosphere. Oikos 87: 113-
122.
- Singer, R. 1976. Marasmieae (Basidiomycetes-Tricholomataceae). Flora Neotropica
Monograph No. 17. The New york Botanical Garden. 347pp.
- Singer, R. 1986. The Agaricales in modern taxonomy. Fourth edition. Koeltz Scientific
Books. Federal Republic of Germany. 981pp.
- Sivasithamparam, K.; Dixon, K.W.; Barret, R.L. 2002. Microorganisms in Plant
Conservation and Biodiversity. Kluwer Academic Publishers. The Netherlands. 378
pp.
- Standardized inventory methodologies for components of Brithish Columbia’s
Biodiversity: Macrofungi. Versión 1.1. January 1997. Prepared by the Ministry
of Environment, Lands and parks Resources Inventory Branch for the Terrestrial
Ecosystems Task Forces, Resources Inventory Committee. 51pp.
- Thind, K. S. 1961. The Clavariaceae of India. Indian Council of Agricultural Research
(ICAR) New Delhi, India. 197 pp.
- Vogt, K.A.; Grier, C.C.; Meier, C.E.; Edmons, R.L. 1982. Mycorrhizal role in net
primary production and nutrient cycling in Abies amabilis ecosystems in western
Washington. Ecology. 63: 370-380.
- Wardle David A.; Bardgett, R.D.; Klironomos, J. N.; Setälä, H.; van der Putten, W.
2004. Ecological linkages between aboveground and belowground biota. Science
304: 1629-1633
- Zalamea, M. 2002. Guía para recolectar hongos macromicetes del orden Aphyllophorales
s.l. Pérez- Arbelaezia 13 : 115-132.
-Vasco-Palacios A.M.; Franco-Molano, A.E. & López-Q, C.A. 2005. Macromicetes
(Ascomycota, Basidiomycota) de la región del medio Caquetá, departamentos de
Caquetá y Amazonas. Biota Colombiana 6 (1): 127-140Tabla 1. Especies de
macrohongos encontrados en un relicto de bosque de Quecus humboldtii, en la
vereda Contrafuerte, Municipio de Andes.
Maratón en Biodiversidad – Jardín - Antioquia 2007
Especie # Colección HUA Sustrato Observaciones Publicación original*
Ascomycota
Leotiales
Leotiaceae
Leotia lubrica (Scop.) Pers. M Betancur 48 Suelo Ectomicorrícico Comment. Fungis Clavaeform: 3
Xylariales
Xylariacae
Xylaria polymorpha (Pers.:Fr.) Grev. JDST 190 Madera Descomponedor Fl. Edin.: 355 (1824)
Xylaria sp. A Vasco-P. 1139 Madera Descomponedor Xylaria Hill ex Schrank, Baier.
Basidiomycota
Agaricales
Agaricaceae
Agaricus sp. A Vasco-P. 1125 Suelo Descomponedor Agaricus L.,: 1171 (1753)
Bolbitiaceae
Panaeolus campanulatus (L.) Quél. M Betancur 43 Suelo Descomponedor Mém. Soc. Émul. Montbéliard, S
Cortinariaceae
Cortinarius iodes Berk. & M.A. Curtis JDST 186 Suelo Ectomicorrícico Saccardo's Syll. fung. V: 920; X
Cortinarius (Pers.) Gray, Nat. ar
Cortinarius sp 3 M Betancur 52 Hojarasca Ectomicorrícico 627 (1821)
Cortinarius (Subgenero Phlegmacium) sp. Cortinarius (Pers.) Gray, Nat. ar
1. M Betancur 50 Suelo Ectomicorrícico 627 (1821)
Cortinarius (Subgenero Phlegmacium) sp. Cortinarius (Pers.) Gray, Nat. ar
2. A Vasco-P. 1127 Suelo Ectomicorrícico 627 (1821)
Gymnopilus cf. lateritius (Pat.) Murr. M Betancur 53 Madera Descomponedor Mycologia 5: 19 (1913)
Inocybe hystrix (Fr.) P. Karst., M Betancur 56 Suelo Descomponedor Bidr. Känn. Finl. Nat. Folk 32: 4
Rozites colombiana Halling & Ovrebo JDST 187 Suelo Ectomicorrícico Mycologia 79(5): 674 (1987)
Entolomataceae
Inopilus cystidiophorus (Dennis) Pegler JDST 198 Suelo Descomponedor Kew Bull., Addit. Ser. 9: 354 (19
Hydnangiaceae
Laccaria cf. laccata var. pallidifolia JDST 196. A. Vasco-
(Peck) Peck P. 1140 Suelo Ectomicorrícico Ann. Rep. N. Y. state Mus. 157:
Lycoperdaceae
Lycoperdon Pers., Syn. meth.
Lycoperdon sp. M Betancur 49 Suelo Descomponedor (1801)
Marasmiaceae
Favolaschia pantherina Singer JDST 197 Madera Descomponedor Beih. Nova Hedwigia 50: 103 (1
Marasmiellus distantifolius (Murr.) Sing. JDST 193 Madera Descomponedor Sydowia 15(1-6): 58 (1962) [196
Marasmius cohaerens (Albert & Schwein:
Fr.) Cooke & Quél. A Vasco-P. 1126 Hojarasca Ectomicorrícico Clavis syn. Hymen. Europ. (187
Pleurotaceae
Hohenbuehelia atrocoerulea (Fr.) Singer A Vasco-P. 1138 Madera Descomponedor [as 'atrocaerulea'], Lilloa 22: 25
Schizophyllaceae
Maratón en Biodiversidad – Jardín - Antioquia 2007
[as 'Schizophyllus communi
Schizophyllum commune Fr.:Fr. M Betancur 44 Madera Descomponedor (Kjøbenhavn) 1: 103 (1815)
Strophariaceae
Melanotus cf. alpiniae (Berk.) Pilát JDST 189 Madera Descomponedor Trans. Br. Mycol. Soc. 33: 216 (
Trichlomataceae
Camarophyllus cf. buccinulus (Speg.)
Pegler M Betancur 51 Hojarasca Descomponedor Kew Bull., Addit. Ser. 9: 48 (198
Collybia (Fr.) Staude, Schw
Collybia sp. A Vasco-P. 1133 Suelo Descomponedor xxviii, 119 (1857)
Hygrocybe laeta (Pers.) P. Kumm M Betancur 45 Suelo Descomponedor Führer Pilzk.: 112 (1871)
Hygrocybe (Fr.) P. Kumm., F
Hygrocybe sp. A Vasco-P. 1134 Suelo Descomponedor (Zwickau): 26, 111 (1871)
Auriculariales
Auriculariaceae
Auricularia fuscosuccinea Mont. Henn. M Betancur 42 Madera Descomponedor [as 'fusco-succinea'], Bot. Jb. 17
Boletales
Boletaceae
Boletus sp. A Vasco-P. 1141 Suelo Ectomicorrícico Boletus Fr., Syst. mycol., Index
A Vasco-P. 1135 y
Chalciporus cf. caribaeus Pegler 1130 Suelo Ectomicorrícico Kew Bull., Addit. Ser. 9: 354 (19
Leccinum Gray, Nat. arr. Brit
Leccinum sp. A Vasco-P. 1129 Suelo Ectomicorrícico (1821)
Leccinum talamancae Halling, L:D:
Gómez & Lannoy A Vasco-P. 1128 Suelo Ectomicorrícico Kew Bull. 54(3): 750 (1999)
Calostomataceae
Calostoma cinnabarinum Corda JDST 183 Suelo Descomponedor Anleitung 2: 94 (1809)
Cantharellales
Cantharellaceae
Cantharellus cf. cibarius Mont. A Vasco-P. 1132 Suelo Ectomicorrícico Syst. mycol. (Lundae) 1: 318 (18
Hydnaceae
Hydnum repandum L.: Fr. JDST 192 Suelo Descomponedor Sp. Plantarum: 1178 (1753)
Hymenochaetales
Hymenochaetaceae
Cyclomyces sp. JDST 188 Madera Descomponedor Cyclomyces Kunze, Linnaea 5:
Phallales
Gomphaceae
Ramaria Fr. ex Bonord., H
Ramaria sp. A Vasco-P. 1137 Suelo Descomponedor (Stuttgart): 166 (1851)
Polyporales
Coriolaceae
Pycnoporus sanguineus (L.:Fr.) Murril JDST 185 Madera Descomponedor Bull. Torrey bot. Club 31(8): 42
Lentinaceae
Lentinus crinitus (Linn.:Fr.) Fr. M Betancur 47 Madera Descomponedor Nov. Symb. Myc.: 34 (1825)
Polyporaceae
Polyporus arcularius Batsch.:Fr. JDST 194 Madera Descomponedor Syst. mycol. (Lundae) 1: 342 (18
Russulales
Russulaceae
Russula cf. puiggarii (Speg.) Singer M Betancur 53 Suelo Ectomicorrícico Index of Fungi 2: 108 (1951-196
Maratón en Biodiversidad – Jardín - Antioquia 2007
Russula silvestris (Singer) Reumaux A Vasco-P. 1131 Suelo Ectomicorrícico Reumaux, Bidaud & Moënne-Lo
Stereaceae
Stereum hirsutum (Willd.: Fr.) S. F. Gray JDST 195 Madera Descomponedor Observ. mycol. (Lipsiae) 2: 90 (
Tremellales
Tremellaceae
Tremella mesenterica Retz. M Betancur 46 Madera Descomponedor K. svenska Vetensk-Akad. Hand
• Tomado de Kirk, 2004
Maratón en Biodiversidad – Jardín - Antioquia 2007
View publication stats
También podría gustarte
- Disección de Una ConchaDocumento3 páginasDisección de Una ConchaJorge Bryan Tomalá Domínguez0% (1)
- Actividad #3 Sistematica y Taxonomia. Amaya, Arcón, Gonzalez. 2020Documento4 páginasActividad #3 Sistematica y Taxonomia. Amaya, Arcón, Gonzalez. 2020MIGUEL ANGEL AMAYA ORTEGAAún no hay calificaciones
- TesisBiol DiegoVegaDocumento40 páginasTesisBiol DiegoVegajmmocaAún no hay calificaciones
- Hongos de San Ciprino - Bosque HumedoDocumento19 páginasHongos de San Ciprino - Bosque HumedomarisAún no hay calificaciones
- Hongos en Laguna LachuáDocumento58 páginasHongos en Laguna LachuáSilviohgAún no hay calificaciones
- Contribución Al Estudio de Los Arácnidos (Arachnida) Asociados A Un Bosque de Galería en Meta (Colombia)Documento7 páginasContribución Al Estudio de Los Arácnidos (Arachnida) Asociados A Un Bosque de Galería en Meta (Colombia)David MoralesAún no hay calificaciones
- Revista Mexicana de BiodiversidadDocumento8 páginasRevista Mexicana de BiodiversidadSuryagonzalezjAún no hay calificaciones
- Colepteros NecrócolosDocumento7 páginasColepteros NecrócolosJuan Jose SotoAún no hay calificaciones
- CARBONO ContentServerDocumento11 páginasCARBONO ContentServerjhonerAún no hay calificaciones
- Hongos Del Caribe Nicaragüense 2017Documento11 páginasHongos Del Caribe Nicaragüense 2017Asdrubal Flores PachecoAún no hay calificaciones
- Escarabajos Scarabaeidae Pleurosticti de La SelvaDocumento34 páginasEscarabajos Scarabaeidae Pleurosticti de La SelvaWalter Eduardo Flores MirandaAún no hay calificaciones
- COLECCIÓN DE MACROMICETES VERSION ADRI - Version PreliminarDocumento34 páginasCOLECCIÓN DE MACROMICETES VERSION ADRI - Version PreliminarAdriana CorralesAún no hay calificaciones
- 044-059 - Libro - Biodiversidad - Cuba - Capítulo 4Documento16 páginas044-059 - Libro - Biodiversidad - Cuba - Capítulo 4Daniel Zarcos LòpezAún no hay calificaciones
- Informe MoluscoDocumento8 páginasInforme MoluscoVigilante AAún no hay calificaciones
- Leyte Manriqueetal2022Documento13 páginasLeyte Manriqueetal2022AlekkerAún no hay calificaciones
- Biodiversidad, Clasificación y FilogeniaDocumento17 páginasBiodiversidad, Clasificación y FilogeniaYessenia OropezaAún no hay calificaciones
- Porcel Etal2022 HormigasCacaoBio2022Documento6 páginasPorcel Etal2022 HormigasCacaoBio2022Alexandra VásquezAún no hay calificaciones
- Acero-Murcia Et Al 2018.en - EspañolDocumento26 páginasAcero-Murcia Et Al 2018.en - EspañolRosa Alicia ClarosAún no hay calificaciones
- La Importancia de Los Manglares y Su Microbiología (Cangrejos)Documento17 páginasLa Importancia de Los Manglares y Su Microbiología (Cangrejos)elliottAún no hay calificaciones
- Amat Garcia - Diversidad Taxonomica y Ecologica de La EntomofDocumento10 páginasAmat Garcia - Diversidad Taxonomica y Ecologica de La EntomofLetyfungosAún no hay calificaciones
- Reciclaje de NutrientesDocumento11 páginasReciclaje de NutrientesRoyce BustillosAún no hay calificaciones
- Revista Comunicaciones Cientificas y Tecnologicas Vol 5 No 1 Diciembre 2019 Art5Documento21 páginasRevista Comunicaciones Cientificas y Tecnologicas Vol 5 No 1 Diciembre 2019 Art5Kerlin Marbella Saavedra ShanocuaAún no hay calificaciones
- Poveda-Diaz Et Al.Documento10 páginasPoveda-Diaz Et Al.Agustina LongoAún no hay calificaciones
- Fisiologia Del ÑameDocumento21 páginasFisiologia Del ÑameMarcela CuitivaAún no hay calificaciones
- 36393-Texto Del Artículo-151951-1-10-20130103Documento15 páginas36393-Texto Del Artículo-151951-1-10-20130103Yesenia MosqueraAún no hay calificaciones
- Inf JF157Documento29 páginasInf JF157Luis PintoAún no hay calificaciones
- Lectura de ArtropodosDocumento7 páginasLectura de ArtropodosAna EscobarAún no hay calificaciones
- La Importancia de Los Acociles en Los Sistemas AcuaticosDocumento3 páginasLa Importancia de Los Acociles en Los Sistemas AcuaticosCar PetaAún no hay calificaciones
- Biodiversidad de Hongos en MéxicoDocumento6 páginasBiodiversidad de Hongos en MéxicoAdair Abundis IbarraAún no hay calificaciones
- Yoshimoto Etal 2021 RMBDocumento13 páginasYoshimoto Etal 2021 RMBmaewagyuchoAún no hay calificaciones
- Protozoarios (Protozoa) Mayén-EstradaDocumento6 páginasProtozoarios (Protozoa) Mayén-EstradaFatima del Rosario Sanchez HernandezAún no hay calificaciones
- Especies de Phasmatodea y Mantodea Depositadas en La Colección EntomológicaDocumento6 páginasEspecies de Phasmatodea y Mantodea Depositadas en La Colección EntomológicaAntonio LealAún no hay calificaciones
- Composición de Lianas y Bejucos - Chocó Colombiano - Bonilla Et Al-2015Documento11 páginasComposición de Lianas y Bejucos - Chocó Colombiano - Bonilla Et Al-2015IGNACIO SANCHEZ FLOREZAún no hay calificaciones
- El Estudio de La Biodiversidad en M Xico Una 2014 Revista Mexicana de BioDocumento9 páginasEl Estudio de La Biodiversidad en M Xico Una 2014 Revista Mexicana de BioFabian MorenoAún no hay calificaciones
- Em 618-625Documento8 páginasEm 618-625Jorge PonteAún no hay calificaciones
- Murciélagos Zotz Bioindicadores de La Perturbación Ambiental Medellin and Víquez 2014Documento20 páginasMurciélagos Zotz Bioindicadores de La Perturbación Ambiental Medellin and Víquez 2014María José TorallaAún no hay calificaciones
- Biologia 28 Tarea 4 BrianLopesierraDocumento5 páginasBiologia 28 Tarea 4 BrianLopesierraBryant L'pAún no hay calificaciones
- Biodiversidad en MichoacanDocumento4 páginasBiodiversidad en MichoacanEdgar TrujilloAún no hay calificaciones
- ALBERTO NEYID ESPARRAGOZA MARTINEZ-Tarea4Documento7 páginasALBERTO NEYID ESPARRAGOZA MARTINEZ-Tarea4Valentina Anillo martinezAún no hay calificaciones
- Protocolo La JoyaDocumento14 páginasProtocolo La JoyaJuan Gallegos Rojas100% (1)
- Biodiversidad de Ciliophora en MéxicoDocumento10 páginasBiodiversidad de Ciliophora en MéxicoWendy GrimesAún no hay calificaciones
- Una Revisión Aspectos Ecológicos Utricularia Gibba ResumenDocumento4 páginasUna Revisión Aspectos Ecológicos Utricularia Gibba ResumenHanz Miguel AndradeAún no hay calificaciones
- Los Coleópteros y El CompostDocumento4 páginasLos Coleópteros y El CompostLaura Quiceno BoteroAún no hay calificaciones
- Mesofauna de Los ColémbolosDocumento4 páginasMesofauna de Los ColémbolosLaura Quiceno BoteroAún no hay calificaciones
- Hongos en Humedales Cerros y Páramos de Bogotá, 2018Documento6 páginasHongos en Humedales Cerros y Páramos de Bogotá, 2018Teodoro Chivatá BedoyaAún no hay calificaciones
- Peso y Medición de OligoquetosDocumento12 páginasPeso y Medición de OligoquetosClara Elena VeraAún no hay calificaciones
- Filo ArthropodaDocumento4 páginasFilo ArthropodaJuanita RodriguezAún no hay calificaciones
- Informe de MurcielagosDocumento5 páginasInforme de Murcielagosyuly castroAún no hay calificaciones
- Macrohongos Del Volcán MombachoDocumento19 páginasMacrohongos Del Volcán MombachoChen Wu SánchezAún no hay calificaciones
- Nota Del SueloDocumento8 páginasNota Del SueloManuel Alva ObregonAún no hay calificaciones
- Los Productos Forestales No Maderables de Mexico-29 Nov 2018Documento41 páginasLos Productos Forestales No Maderables de Mexico-29 Nov 2018sarj100% (1)
- Revista Mexicana de Biodiversidad: Geastrum ViolaceumDocumento4 páginasRevista Mexicana de Biodiversidad: Geastrum ViolaceumAntonio Moreno TalamantesAún no hay calificaciones
- Líquenes en MéxicoDocumento18 páginasLíquenes en Méxicojossua camposAún no hay calificaciones
- Insect Oster Rest ResDocumento32 páginasInsect Oster Rest ResCandela GaunaAún no hay calificaciones
- Diversidad de Anfi Bios y Reptiles de LaDocumento13 páginasDiversidad de Anfi Bios y Reptiles de LaSalvador RodriguezAún no hay calificaciones
- Flora y Fauna de Cuatro Bosques de PolylepisDocumento13 páginasFlora y Fauna de Cuatro Bosques de PolylepisLucely Lucero Vilca BustamanteAún no hay calificaciones
- Schondubeetal 2018chapter12 EcologayConservacindeFaunaenAmbientesAntropizadosDocumento31 páginasSchondubeetal 2018chapter12 EcologayConservacindeFaunaenAmbientesAntropizadosJohana Reyes HerreraAún no hay calificaciones
- Diversity of Xanthoparmelia Parmeliaceae Species IDocumento11 páginasDiversity of Xanthoparmelia Parmeliaceae Species IYUNA RATNA WULANSARIAún no hay calificaciones
- 8 Riqueza y Abundancia de Organismos Andakí - ColAmaz12Documento22 páginas8 Riqueza y Abundancia de Organismos Andakí - ColAmaz12jesabel carreto trinidadAún no hay calificaciones
- Catálogo de los copépodos (Crustacea: Copepoda: Calanoida y Cyclopoida) de cuerpos de agua temporales de Jalisco, México: Taxonomía y distribuciónDe EverandCatálogo de los copépodos (Crustacea: Copepoda: Calanoida y Cyclopoida) de cuerpos de agua temporales de Jalisco, México: Taxonomía y distribuciónAún no hay calificaciones
- Encinos. Respuestas Morfofisiológicas a la sequíaDe EverandEncinos. Respuestas Morfofisiológicas a la sequíaAún no hay calificaciones
- SubespecieDocumento2 páginasSubespecieliveAún no hay calificaciones
- Aspectos Sintéticos Sobre La Flora Vascular Del Sistema IbéricoDocumento23 páginasAspectos Sintéticos Sobre La Flora Vascular Del Sistema IbéricoalbertoAún no hay calificaciones
- FRACCIONES, DECIMALES Y PORCENTAJES ResolucionDocumento5 páginasFRACCIONES, DECIMALES Y PORCENTAJES ResolucionGomez Tito Jose SaulAún no hay calificaciones
- 5 Reinos IBDocumento7 páginas5 Reinos IBAriana VfAún no hay calificaciones
- JKKKDocumento12 páginasJKKKalaAún no hay calificaciones
- Taller 8. Código Nomenclatura ZoológicaDocumento8 páginasTaller 8. Código Nomenclatura ZoológicaBrandonUrregoAún no hay calificaciones
- Biologia Semana 13Documento3 páginasBiologia Semana 13Gloria VilcaAún no hay calificaciones
- Mosasaurios Eran Depredadores de PacientesDocumento4 páginasMosasaurios Eran Depredadores de PacientesIrma MatiasAún no hay calificaciones
- Salazar & Donoso - 2014 - El Mundo de Los Invertebrados, en Busca Del Número Total de Especies Del Ecuador PDFDocumento4 páginasSalazar & Donoso - 2014 - El Mundo de Los Invertebrados, en Busca Del Número Total de Especies Del Ecuador PDFAlejandro ChicaizaAún no hay calificaciones
- Dinosaur IosDocumento80 páginasDinosaur IosEdgardo VillafuerteAún no hay calificaciones
- Arctica IslandicaDocumento2 páginasArctica IslandicaTeo CarraldaAún no hay calificaciones
- Botanica Economica 2 GeneralidadesDocumento36 páginasBotanica Economica 2 GeneralidadesmilanAún no hay calificaciones
- ZOOLOGÍA DE VERTEBRADOS Clase 7 Tetrápodos Reptiles IIDocumento35 páginasZOOLOGÍA DE VERTEBRADOS Clase 7 Tetrápodos Reptiles IIJordan RuizAún no hay calificaciones
- 1299-Texto Del Artículo-4048-1-10-20160114 PDFDocumento58 páginas1299-Texto Del Artículo-4048-1-10-20160114 PDFPaola AceroAún no hay calificaciones
- Taller EvoluciónDocumento10 páginasTaller EvoluciónDaniel Vera CastroAún no hay calificaciones
- TaxonomiaDocumento20 páginasTaxonomiaYANILE ALFONSOAún no hay calificaciones
- Los 5 Reinos de Los Seres Vivos : SignificadoDocumento3 páginasLos 5 Reinos de Los Seres Vivos : SignificadoBeatriz MendezAún no hay calificaciones
- Taller-Laboratorio-Sistema-2 DanyDocumento6 páginasTaller-Laboratorio-Sistema-2 Danydany luzAún no hay calificaciones
- Familia BlechnaceaeDocumento10 páginasFamilia BlechnaceaeGuadaAún no hay calificaciones
- Características de Los Poríferos o EsponjasDocumento4 páginasCaracterísticas de Los Poríferos o EsponjasGUISELLAAún no hay calificaciones
- El Megalodón o MegalodonteDocumento3 páginasEl Megalodón o MegalodonteEdìth 'Bautìsta100% (1)
- Ensayo BiologiaDocumento5 páginasEnsayo BiologiaHome WordAún no hay calificaciones
- TAXONOMIDocumento7 páginasTAXONOMIPaulo CesarAún no hay calificaciones
- Los Reinos Biologicos para Primer Grado de SecundariaDocumento4 páginasLos Reinos Biologicos para Primer Grado de SecundariaARMY FOREVER KIMAún no hay calificaciones
- Tarea MapaConceptual Trogonidos-Quetzal ISEM2023Documento3 páginasTarea MapaConceptual Trogonidos-Quetzal ISEM2023Melissa de LeónAún no hay calificaciones
- Ejercicio3 - Pretarea - Mapa Mental Angela OrtizDocumento1 páginaEjercicio3 - Pretarea - Mapa Mental Angela OrtizAngela OrtizAún no hay calificaciones
- en EsDocumento18 páginasen EsThania MallmaAún no hay calificaciones
- Biografia CarlosLinneoDocumento6 páginasBiografia CarlosLinneoKimairi HernandezAún no hay calificaciones